青藏高原北麓河流域不同退化程度高寒草甸生产力和群落结构特征
李成阳,赖炽敏,彭 飞,薛 娴,尤全刚,张文娟,刘斐耀
(1.中国科学院西北生态环境资源研究院 / 中国科学院沙漠与沙漠化重点实验室,甘肃 兰州 730000;2.中国科学院大学,北京 100049;3.福建农林大学林学院,福建 福州 350000)
自20世纪70年代以来,全球表面温度持续上升,且高纬度和高海拔地区增温幅度显著高于北半球同纬度地区[1]。青藏高原平均海拔在4 000 m以上,素有“世界屋脊”和“第三极”之称,对中国乃至整个亚洲的生态环境都具有重要的意义[2-3]。受气候变暖影响,青藏高原冰川缩减[4]、多年冻土退化[5]等使高寒草地退化面积增加[6],草甸水源涵养功能衰退[7],严重影响了当地乃至全国的生态环境安全。
高寒草甸是青藏高原畜牧业发展的重要物质基础,面积约 7 × 105km2,约占可用草地总面积的1/2,是我国主要的家畜放牧区,同时也是多年冻土区分布最广泛的草地类型[8]。大量研究表明,近几十年来,由于长期超载过牧和暖干化气候的共同作用[9-10],高寒草甸发生了明显退化[11-14]。据报道,青藏高原高寒草甸只有约30%处于良好状态;约30%处于过度放牧状态,合理的草地管理措施可使这一部分恢复;约40%接近或处于完全退化状态[15]。随草地退化程度加剧,植被盖度、高度显著降低[16-17],地上、地下生物量减少[18],物种丰富度、多样性指数锐减[9],优良牧草比例及重要值急剧下降,毒杂草比例及重要值明显增加[16-17],牧草饲用价值大幅降低[19],导致草地承载能力降低,严重威胁着草地的可持续发展。
生态系统本身具有抗御外界干扰、恢复平衡状态的能力,但有一定的临界限度,超过了这个阈值,极难恢复[20]。在草地不同退化阶段中,也存在着关键阶段,但这个关键阶段会随不同自然条件、植被类型而异[21]。例如,纪磊等[13]在对川西北高原不同退化程度高山草甸与亚高山草甸草地研究发现,高山草甸地上生物量在重度退化阶段开始显著下降,而亚高山草甸则发生在中度退化阶段。柳小妮等[11]在东祁连山高寒草甸发现,地上生物量在重度退化阶段开始显著下降,而地下生物量则发生在轻度退化阶段。王合云等[17]在内蒙古大针茅(Stipa grandis)草原发现,地上、地下生物量均在中度退化阶段开始显著降低。不同区域自然条件和植被组成各异以及没有统一的针对退化阶段的指标体系可能是造成退化过程中植被发生变化的关键阶段不同的主要原因。虽然研究人员对多年冻土区高寒草甸植被群落结构特征有一些研究,但还远远不够。如王俊峰和吴青柏[22]在风火山对退化沼泽草甸研究表明,退化显著降低了植被盖度和地上生物量,浅层土壤中氮、磷、钾、有机质质量分数严重下降,而pH和容重则显著增加,导致土壤贫瘠化。文晶等[23]在北麓河地区对严重退化高寒草甸研究发现,退化后,土壤表层粗粒程度和土壤容重增大,土壤含砂量增多,沙质化严重。以上仅对单一退化程度进行了研究,未对不同退化程度植被群落结构特征进行调查。因此,研究不同退化程度多年冻土区高寒草甸植被群落结构特征的关键阶段对认识多年冻土区草地退化过程及退化草地恢复具有重要现实意义。本研究在青藏高原多年冻土区根据植被和土壤特征选取了未退化到极度退化的5个退化梯度,探讨不同退化程度对植被地上、地下生物量以及各功能群相对盖度的影响,旨在为揭示多年冻土区高寒草甸植被退化关键阶段提供参考。
1 材料与方法
1.1 研究区概况
研究区位于青藏高原腹地多年冻土区北麓河流域内,试验场位于距中国科学院冻土工程国家重点实验室青藏高原北麓河冻土工程与环境综合观测研究站 (34.82° N、92.92° E)约 100 m 处的开阔地,平均海拔约为4 630 m,该地区属于高寒半干旱气候,年平均气温为-5.3 ℃,年均最高气温和最低气温分别为 4.5 和-11.0 ℃[6];年均降水量为 290.9 mm,其中93%的降水发生在植物生长季(5-9月),年均蒸发量为 1 316.9 mm,年均风速为 4.1 m·s-1,年均相对湿度为57%,冻结期为10月至翌年4月[24]。该地区夏季放牧,植被类型为高寒草甸,植被组成以密丛短根茎地下芽嵩草属高山嵩草(Kobresia pygmaea)为建群种,以寒冷中生多年生草本植物为优势种[6],植被平均高度约为5 cm[24]。试验样地主要禾本科物种有垂穗披碱草(Elymus nutans)、紫花针茅 (Stipa purpurea)、梭罗草 (Roegneria thoroldiana)、冷地早熟禾(Poa crymophila),莎草科物种有高山嵩草、藏嵩草 (K.tibetica)、黑褐苔草 (Carex atrofusca)、矮嵩草 (K.humilis)、线叶嵩草 (K.capillifolia),杂草类植物有矮火绒草(Leontopodium nanum)、多枝黄芪(Astragalus polycladus)、 星 毛 委 陵 菜 (Potentilla acaulis)、多裂委陵菜(P.multifida)、珠芽蓼(Polygonum viviparum)、西伯利亚蓼 (P.sibiricum)、高山唐松草(Thalictrum alpinum)、铺散亚菊 (Ajania khartensis)、唐古拉翠雀花(Delphinium tangkulaense)、美丽风毛菊 (Saussurea superba)、细小棘豆 (Oxytropis pusilla)、萎软紫菀(Aster flaccidus)、欧式马先蒿(Pedicularis oederi)。
1.2 样地设置
于2017年通过对多年冻土区北麓河流域植被和土壤特征实地调查,参照Xue等[25]在黄河源和长江源划分草地退化5级梯度标准。采用空间退化梯度代替时间退化序列的方法[25],选择未退化(CK,intact)、轻度退化 (LD,slightly degraded)、中度退化(MD,moderately degraded)、重度退化 (SD,severely degraded)和极度退化 (ED,extremely degraded)5个退化演替阶段。每个退化演替阶段共有3个重复,一共 15 个样方,每个样方大小为 2 m × 2 m。不同退化程度草地特征等级划分[23]为:CK,植被盖度90%以上,无裸地出现,无明显土壤风蚀;LD,植被盖度80%~90%,出现少量斑状裸地,土壤轻度风蚀;MD,植被盖度50%~80%,出现片状裸地,土壤明显风蚀;SD,植被盖度30%~50%,大片裸地出现,风蚀严重;ED,植被盖度30%以下,低者不足10%,大片裸地出现,风蚀严重。
1.3 植被群落特征测定
在2018年生长季5-9月,记录每个样方内物种数,用特制直尺按对角线测量对高度进行测量,分两条对角线,每条对角线随机测20个高度;植被盖度采用 27 cm × 27 cm 的样方框进行测定,将网格尺寸为 2.5 cm × 2.5 cm 的硬铁丝网 (网格数为100个)平铺在样方框内,对被植被覆盖的硬铁丝网小方格进行统计,取每一部分盖度的平均值作为该样地的盖度[26]。同时,统计每个物种盖度,然后计算出每个物种的相对盖度。将每个样方所有物种划分为禾本科、莎草科和杂草3个功能群,对所属功能群的物种相对盖度相加得到各功能群的相对盖度。采用如下公式[26]对地上生物量进行计算:
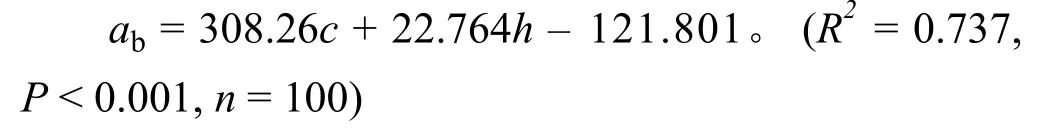
式中:ab为地上生物量(g·m-2),c为盖度(%),h为高度(cm)。
于5月底,采用土钻法对地下生物量进行获取,即每个样地用内径为7 cm的土钻分不同土层0-10、10-20、20-30 和 30-50 cm 钻取根系样品[6]。取完土样后,填埋粒径相同的无根细沙,并做上记号。将取得的土样装好运回实验室水洗分离出土壤和根系,然后将根放进75 ℃的烘箱中烘干48 h至恒重,称重作为地下生物量。在9月底采用同样方法对5月底填埋粒径相同的无根细沙处对地下净初 级 生 产 力 (below-ground net primary productivity,BNPP)进行获取。将取得的土样装好运回实验室水洗分离出土壤和根系,然后将根放进75 ℃的烘箱中烘干48 h至恒重,称重后为BNPP。
1.4 数据处理
本研究中采用 Microsoft Excel 2010、SPSS 23.0软件对数据进行分析处理。采用最小显著差异法(LSD)分析不同退化程度地上生物量、各土壤深度BNPP所占比例及各功能群相对盖度(α= 0.05)。采用分段线性回归 (piecewise linear regression)分析地上生物量、地下生物量、BNPP及BNPP占地下生物量比例与退化梯度的关系。采用Person相关系数分析不同退化程度各功能群相对盖度和不同土壤深度BNPP比例的关系。图中误差线均为标准误。
2 结果
2.1 群落结构动态变化
5月,禾本科植物相对盖度在ED阶段较CK显著增加(P< 0.05);随着退化程度的加剧,莎草科植物相对盖度逐渐减小,杂草相对盖度逐渐增加,与CK相比,莎草科植物相对盖度在各退化阶段均显著降低(P< 0.05),杂草相对盖度在MD、SD和ED阶段均显著增加(图1)。6月,与CK相比,只有ED阶段禾本科植物和杂草相对盖度显著增加;莎草科植物相对盖度在SD和ED阶段较CK均显著降低。7月,与CK相比,只有SD阶段禾本科植物相对盖度显著增加;莎草科植物相对盖度在MD、SD和ED阶段较CK均显著降低;杂草相对盖度在SD和ED阶段较CK均显著增加。8月,与CK相比,SD和ED阶段禾本科植物和杂草相对盖度显著增加,莎草科植物相对盖度显著降低。9月,各退化阶段禾本科植物相对盖度均无显著差异(P> 0.05);与CK相比,SD和ED阶段杂草相对盖度显著增加,莎草科植物相对盖度显著降低。
2.2 生物量
2.2.1 地上生物量动态
在5-9月,不同退化程度地上生物量均表现出先增加后减少的趋势,7、8月地上生物量最高,最低则出现在5月。随着退化程度加剧,地上生物量呈现降低趋势。地上生物量在CK和LD之间无显著差异 (P> 0.05),LD 至 SD 阶段显著降低 (P<0.05),至ED降至最低。此外,分段回归结果发现,地上生物量在MD之前,回归系数为8.93;MD之后,回归系数为-94.79(P< 0.001)(图 2)。
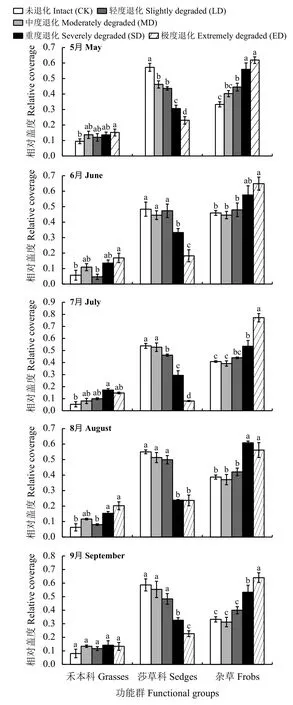
图1 不同退化程度生长季各功能群相对盖度动态变化Figure 1 Dynamic change of relative coverage of each functional group in growth seasons at different degrees of degradation
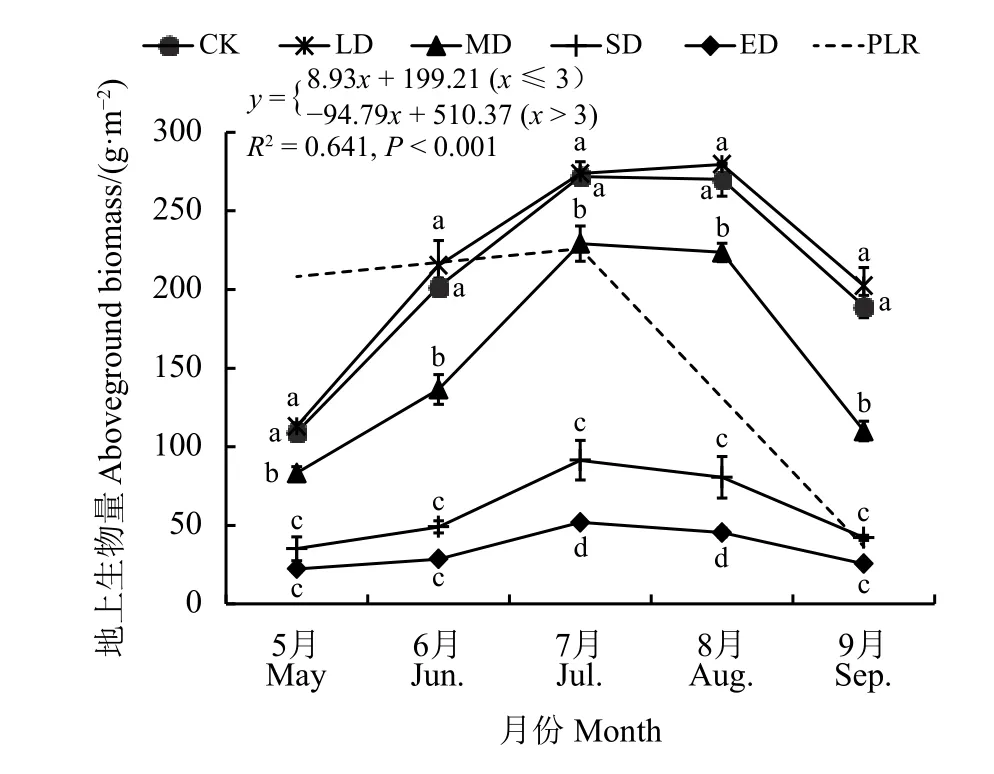
图2 不同退化程度生长季地上生物量动态变化Figure 2 Dynamic changes of aboveground biomass in growing seasons at different degrees of degradation
2.2.2 地下生物量和地下净初级生产力
不同退化程度下地下生物量先升高后降低(图3)。0-50 cm地下生物量均值在LD达到最大,为 1 343.99 g·m-2,较 CK 增加了 204.69 g·m-2,但不显著(P= 0.21)。MD至SD阶段,地下生物量开始极显著下降(P< 0.001),至ED降至最低,SD至ED阶段并无显著变化。分段回归结果表明,地下生物量在MD之前,回归系数为36;MD之后,回归系数为-560.87。
与地下生物量的变化趋势相似,不同退化程度下BNPP在MD以前无显著变化,在LD阶段达到最大值 (106.07 g·m-2),MD 至 SD 阶段,BNPP 开始快速降低(图3)。分段回归结果表明,在MD之前,BNPP回归系数为2.66;MD之后,BNPP回归系数为-47.94(P< 0.001)(图 3)。BNPP 占地下生物量比例呈显著上升趋势(图4,P= 0.002)。随着退化程度加剧BNPP在0-10 cm分布比例呈现显著下降趋势 (P< 0.05),在 CK 中,0-10 cm 的 BNPP 占 0-50 cm BNPP的比例最大,为0.59(图5)。在0-10 cm土壤深度,BNPP分布比例在CK至LD阶段无显著变化,MD至ED阶段均显著降低;10-20 cm土壤深度,各退化阶段BNPP分布比例均无显著差异;20-30 cm土壤深度,BNPP分布比例仅在ED阶段显著增加;30-50 cm土壤深度,BNPP分布比例在SD至ED阶段均呈显著增加趋势(图5)。

图3 不同退化程度下地下生物量和BNPPFigure 3 Belowground biomass and BNPP under different degrees of degradation

图4 不同退化程度BNPP占地下生物量比例Figure 4 BNPP accounts for the proportion of belowground biomass under different degrees of degradation
2.3 不同退化程度各功能群相对盖度和不同土壤深度BNPP比例的关系
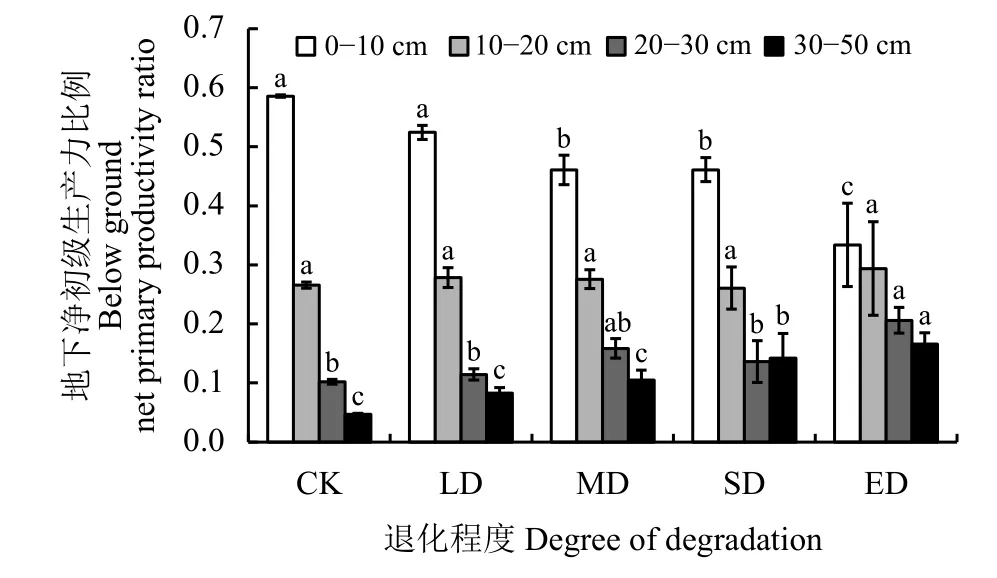
图5 不同退化程度下不同土壤深度BNPP分布比例Figure 5 The proportion of the BNPP at different soil depths under different degrees of degradation
不同退化程度禾本科植被相对盖度和不同土壤深度BNPP比例相关性均不显著(P >0.05)。不同退化程度莎草科植被相对盖度和BNPP在0-10 cm土壤深度比例极显著正相关 (P< 0.01),但在 10-20 cm 土壤深度无显著相关,20-30和30-50 cm土壤深度均显著负相关(P< 0.05)(图6)。不同退化程度杂草植被相对盖度和BNPP在0-10 cm土壤深度比例极显著负相关,但在 10-20 cm 土壤深度无显著相关 (P> 0.05),20-30和30-50 cm土壤深度显著、极显著正相关。
3 讨论与结论
草地植被是草地生态系统中受人为活动影响最敏感的部分[17]。植物群落物种组成和结构变化往往能反映草地的退化程度,如优良牧草比例显著减少、杂类草比例显著增加[11]。在本研究中,随着退化程度增加,禾本科和杂草类植物相对盖度有增加趋势,而莎草科植物相对盖度有逐渐减少的趋势。在整个生长季来看,MD以前,群落结构虽有调整变化,但并不能影响莎草科植物的主导地位;MD之后,群落结构发生显著变化。研究区高寒草甸植被以嵩草属植物为优势种,随着退化程度的加剧,莎草科植物在群落中的竞争力不断下降,莎草科植物相对盖度在未退化阶段超过0.5,至极度退化相对盖度只有0.2左右,而杂草类相对盖度由未退化阶段的0.35左右上升到极度退化的0.65左右,莎草科植物优势地位逐渐丧失,成为群落的伴生种,杂草类植物则过渡为群落的优势种。这与祁连山东段[11]、三江源区[16]高寒草甸退化后群落变化的结果一致。因此,中度退化是植被群落由莎草科为主过渡到以杂类草为主的关键阶段。
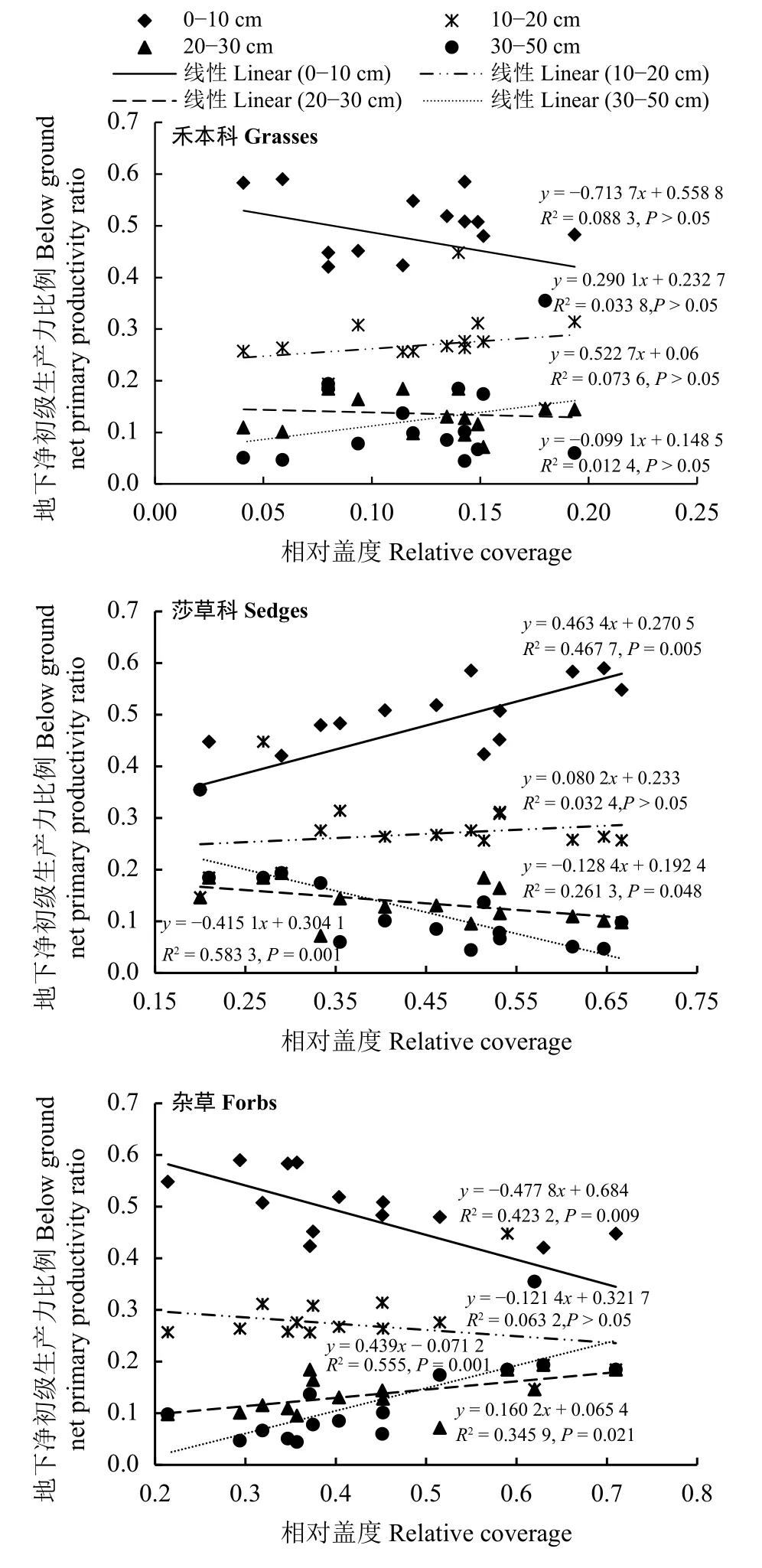
图6 不同退化程度各功能群相对盖度和不同土壤深度BNPP比例的关系Figure 6 Relationship between the relative coverage of different functional groups and BNPP accounts for the proportion of different soil depths
草地生物量是衡量草地生产力和植物生长发育的重要指标之一[27]。在本研究中,随着退化程度加剧,群落盖度降低,地上、地下生物量和BNPP呈显著下降趋势,BNPP在0-10 cm分布比例显著降低,而30-50 cm分布比例显著增加。在退化过程中,非生物环境的变化迫使植物群落发生调节是造成BNPP往深处移动的主要因素。例如,先前的研究表明,随着退化程度加剧,植被覆盖显著降低,土壤持水能力变差,土壤有机质显著减少[6],含水量降低,表层逐渐干旱化[28]。面对生存环境的变化,植被群落也相应在调整,将更多的部分分配至地下吸收土壤养分和水分,来维持植被生长需求。
在土壤表层0-10 cm,莎草科植物相对盖度与不同退化程度BNPP所占比例呈正相关关系,杂草相对盖度与不同退化程度BNPP所占比例呈负相关关系;而在土壤深层30-50 cm,莎草科植物相对盖度与不同退化程度BNPP所占比例呈负相关关系,杂草相对盖度与不同退化程度BNPP所占比例呈正相关关系(图6)。这表明莎草科植物BNPP主要分布在土壤表层0-10 cm,随着退化程度加剧,莎草科植物相对盖度显著降低,BNPP在土壤表层所占比例越来越少;而杂草植物相对盖度显著增加,杂草植物BNPP在深层30-50 cm所占比例则越来越大,在表层逐渐干旱的情况下,莎草科优势植物由于根系较浅生长逐渐受到抑制,而杂类草植物根系较深获取深层土壤水分的能力增强[29-30]。因此,随着多年冻土区高寒草甸退化程度的加剧,以浅根系为主的莎草科植物逐渐被以旱生、深根系和主根系的杂草所取代,植被自觉调节根系分布,也是植被在面对气候变暖下多年冻土退化[5]和土壤表层水分减少[6]的一种适应机制。
在本研究中,地上、地下生物量以及BNPP由不变至降低的临界点均出现在中度退化阶段。先前的研究中[6]发现,在中度退化阶段,土壤有机质显著降低,土壤容重显著增加,土壤入渗率显著降低,有限的降水在地表迅速流失,水土流失进一步加剧。土壤变化也进一步支持了地上、地下生物量在中度退化阶段发生变化的可能。中度退化阶段之后,地下生物量减少的速率显著高于BNPP减少的速率。这表明在中度退化之后,死根部分的流失可能是导致地下生物量减少最主要的原因。退化后,分解作用加剧[18],被侵蚀后带走[6],或被高原鼠兔等啮齿类动物所利用[31],这可能是死根部分的流失主要因素。因此,在本研究中,中度退化阶段是地上、地下生物量以及BNPP由不变或增加到降低的关键阶段。基于此结果,在实施草地恢复措施时,应针对不同的退化状态采用不同的措施,特别是在中度退化之前和中度退化之后。

