若尔盖地区沙化草地土壤酶协同和抑制效应
王 毅,刘碧颖,刘 苗,孙 建,曾 涛
(1.成都理工大学地球科学学院,四川 成都 610059;2.中国科学院地理科学与资源研究所,北京 100101)
若尔盖地区地处青藏高原的东部边缘,包括四川省的若尔盖县、红原县、阿坝县和甘肃省的玛曲县,是长江、黄河流域重要的水源涵养调节地及我国生物多样性保护的热点区域之一[1-4]。近年来,在不合理人类活动和自然因素的共同作用下,若尔盖地区高寒草甸生态系统遭到严重破坏,出现了不同程度的沙化现象[5]。草地沙化的加剧和草地面积的减少影响了其重要的生态调节功能,降低了草地生产力,阻碍了当地经济的发展[6]。
土壤是植物、微生物和土壤动物等生命活动的主要场所,其质量的好坏对构建稳定的生态系统具有重要的作用[7-8]。土壤理化性质直接或间接关系到植物根系吸收矿质营养成分,对植物生长产生重要影响[9-10],且一直以来都是土壤、环境和生态科学领域所关注的焦点和热点[11-13]。土壤酶是土壤系统中最活跃的组分之一,通过土壤微生物及植物根系的释放进入土壤,参与土壤重要生物化学反应和物质循环过程[14-16]。
高寒草甸地下部分已成为影响草地生态系统其结构、功能和规律中最不确定的因素[17-18]。针对沙化草地土壤理化性质和酶活性的研究发现,随着退化程度的加剧,多种土壤理化性质和酶活性均值表现为递减[19],而且在一定的环境下,碳、氮营养元素的添加,会增加土壤酶的活性[20-22];土壤胞外酶之间存在显著相关性[9],可以比土壤特性提前1~2年对环境胁迫做出响应[18]。但是,这些研究多为不同区域位置下的沙化阶段对比研究,不能很好地反映相关因子动态变化特征。因此,本研究在同一草地进行9个沙化梯度的区分,以期更加准确地反映土壤理化性质和酶活性动态过程。而且,一些研究指出,土壤酶活性与土壤肥力、土壤微生物和植物群落间存在相互协同、相互促进的现象[23-24];土壤酶活性间、土壤酶活性与土壤因子间的相互作用机制共同影响土壤物质的转化过程[25]。基于以上提出假设:不同的沙化梯度草地土壤酶之间可能存在协同或抑制效应,并对草地沙化做出响应。本研究分析若尔盖地区沙化草地土壤理化性质和酶活性,以期能为探索不同区域草地沙化土壤酶活性机理和草地生态系统保护提供科学依据和重要的参考价值。
1 材料与方法
1.1 研究区概况
试验区位于青藏高原东部的若尔盖地区,四川省阿坝州红原县瓦切乡 (图1),地理坐标为102°37′40″ E,33°07′35″ N,平均海拔在 3 600 m以上。年平均气温1.1 ℃,极端最低气温-36.2 ℃;年降水量为753 mm,主要集中在5-10月。气候类型属于大陆性高原寒温带季风气候,年均日照时数 2 400 h,年均积雪 90 d 左右,无绝对无霜期。土壤类型以亚高山草甸土为主,有部分沼泽土及沼泽化草甸土。近年来,该地区草地沙化面积大幅度扩大,沙化程度不断加剧,正沿着“草甸-退化草甸-沙化草地-沙化”这条生态恶化的道路越演越烈。植物群落中主要优势物种有紫羊茅(Festuca rubra)、老芒麦 (Elymus sibiricus)、四川嵩草 (Kobresia setchwanensis)、垂穗披碱草 (E.nutans)、早熟禾 (Poa annua) 等。

图1 研究区位置及采样示意图Figure 1 Location of the study area and sampling transect
1.2 样地设置
2017年8 月,在样地内,以植被覆盖度为沙化梯度划分标准,分9个沙化梯度(S1~S9)进行取样,其中S1沙化最轻,植被覆盖度为80%~100%,从S1至S9,每个梯度植被覆盖度减少10%,直至S9沙化最严重(0~10%)(图1b ),每个沙化梯度随机选取 3 组 50 cm × 50 cm 小样方,共计 27 个样方。分种调查植物的高度、盖度和丰富度;现场使用pH测定仪测定土壤温度、含水量和pH,使用土壤紧实度仪测定紧实度,以上测定均取3次重复。用直径4 cm的土钻在各个小样方内采集3钻土壤样品,每钻采集0-10、10-20和20-30 cm的土层,用于测定土壤理化性质和土壤酶活性等,其中土壤理化性质测定3层土样,土壤酶活性仅测定0-10 cm土样。用200 cm3的环刀在小样方内分3次采集土壤样品,每次分别采集0-10、10-20和20-30 cm的土层,用于测定土壤容重。以上样品采集后,均严格按照标准处理方式保存并带回实验室进行测定。
1.3 测定指标与方法
土壤容重采用环刀法测定;土壤理化性质测定了有机碳、全碳、速效氮、全氮、速效磷和全磷6项指标,分别采用重铬酸钾氧化法、高温灼烧法、碱解蒸馏法、凯氏蒸馏法、磷钼蓝比色法和硫酸-高氯酸消煮法[26]测定。8种土壤酶活性均采用微量法对样本进行预处理,使用的仪器为可见分光光度计/酶标仪 (Thermo, Multiskan Go 1510)[27]。亮氨酸氨基肽酶 (soil-leucine aminopeptidase, S-LAP)活性测定采用L-亮氨酸对硝基苯胺盐酸盐法;脲酶(soil-urease, S-UE)的性测定采用靛酚蓝比色法;碱 性 磷 酸 酶 (soil alkaline phosphatase, S-ALP)活性测定采用磷酸苯二钠法;木质素过氧化物酶(soil lignin peroxidase, S-Lip)活性测定采用黎芦醇氧化速率法;多酚氧化酶 (soil-Polyphenol oxidase,S-PPO)和过氧化物酶 (soil-peroxidase, S-POD)活性测定采用采用邻苯三酚比色法;β-葡萄糖苷酶(soil-β-glucosidase, S-β-GC)和 N-乙酰-β-D-葡萄糖苷酶 (soil-N-acetyl-β-D-glucosidase, S-NAG)活 性 测 定采用可见分光广度法。
1.4 数据统计分析方法
采用Excel 2016进行数据统计和比较。采用SPSS (IBM SPSS Statistics 24) 对数据进行分析,其中,对土壤理化性质和酶活性进行Pearson相关性分析,对不同沙化梯度下土壤酶活性的差异显著性采用One-Way ANOVA分析。采用ArcGIS(ESR 10.2)绘制研究区示意图,采用SigmaPlot (14.0)进行动态图和相关性图的绘制。
2 结果与分析
2.1 土壤酶活性动态特征
在不同沙化梯度下,土壤亮氨酸氨基肽酶活 性 [(15.8~ 33.4 μmol·(d·g)-1]、 多 酚 氧 化 酶 活性[(36.8~40.9 μmol·(d·g)-1]和过氧化物酶活性 [56.7~73.1 μmol·(d·g)-1]在一定的范围内波动 ,没有表现出明显变化趋势(图2a、e、f)。土壤碱性磷酸酶活性在S1~S7随沙化梯度的增加而增加,变化范围为 2.4~8.8 μmol·(d·g)-1,在 S8降低至 7.5 μmol·(d·g)-1(图2c)。土壤脲酶活性在S1~S7的变化不明显,变化范围为 675~774 μmol·(d·g)-1,在 S8呈降低趋势,为 567 μmol·(d·g)-1(图 2b)。土壤木质素过氧化物酶活性除在 S6和 S7[2 960 μmol·(d·g)-1]异常外,随沙化梯度的增加而递减,变化范围为5 505~1 355 μmol·(d·g)-1(图 2d); 土 壤 β-葡 萄 糖 苷酶[(92.3~14.4 μmol·(d·g)-1]和 N-乙酰-β-D-葡萄糖苷酶活性 [(39.4~15.9 μmol·(d·g)-1]随着随沙化梯度的增加而递减,且土壤β-葡萄糖苷酶在S1和S4以及S1和 S9呈显著差异 (P<0.05)(图 2g和 h)。

图2 不同沙化梯度草地土壤酶活性变化Figure 2 Changes of soil enzymes along a desertification gradient
2.2 土壤理化性质动态特征
总体而言,除极少数梯度出现异常外,在土壤各层,其含水量、紧实度、有机碳、全碳、速效氮、全氮、速效磷和全磷都随着沙化梯度的增加而递减。以表层土壤(0 -10 cm)为例,土壤含水量20.7%~5.3%、紧实度 47.3~17.6 Pa、有机碳 22.7~3.4 g·kg-1、全碳 2.4%~0.3%、速效氮 414.2~39.7 mg·kg-1、全氮 0.24%~0.05%、速效磷 16.0~7.7 mg·kg-1和全磷0.5~0.4 g·kg-1(图 3a、c、f、g、h、i、j和 k)。其中,在S1~S6,0-10 cm土层含水量明显高于其他土层,在S7~S9各层土壤含水量差别变小(图3a);S2土壤紧实度高于其他梯度,随后逐渐递减,0-10 cm土层土壤紧实度明显高于其他土层,除S1外,其他各梯度均表现为20-30 cm土层紧实度高于10-20 cm土层(图3c);除S3出现异常外,土壤有机碳、全碳、速效氮、全氮、速效磷和全磷表现的特点为0-10 cm土层明显高于其他两层,且10-20和20-30 cm 土层间无明显差异 (图 3f、g、h、i、j和 k)。土壤温度随沙化梯度的变化并不明显,只是在一定的范围内波动(如表层土壤温度为19.9~22.1 ℃),但是各土层温度差异明显(图3b);除S6和S9异常外,在土壤容重随着沙化梯度的增加而增加(如表层土壤容重为1.1~1.4 g·cm-3),且容重大小表现为0-10 cm低于另外两层(图3d);除S7土壤pH呈现数值偏低的异常外,pH随着沙化梯度的增加而增加(如表层土壤pH为4.9~6.9),且pH在各土层之间的区别不明显(图3e)。
2.3 土壤理化性质和酶关系
总体而言,在不同沙化梯度下,土壤理化性质与脲酶、碱性磷酸酶、木质素过氧化物酶、β-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶具有一定的相关性,与其他3种酶不相关(表1)。土壤含水量与碱性磷酸酶极显著负相关 (P<0.01),与木质素酶、β-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶极显著正相关 (P<0.01);土壤容重与碱性磷酸酶极显著正相关(P<0.01),与木质素酶和β-葡萄糖苷酶极显著负相关 (P<0.01),与 N-乙酰-β-D-葡萄糖苷酶显著负相关(P<0.05);土壤pH与碱性磷酸酶极显著正相关(P<0.01),与木质素酶、β-葡萄糖苷酶和 N-乙酰-β-D-葡萄糖苷酶均极显著负相关 (P<0.01)。土壤6种营养元素与木质素过氧化物酶和β-葡萄糖苷酶相关性一致,均极显著正相关 (P<0.01),除速效磷外,其他5种营养元素与酶的相关性较强;除土壤速效氮和速效磷外,其他4种营养元素均与脲酶显著正相关(P<0.05);土壤速效磷和全磷与碱性磷酸酶无相关性。
2.4 土壤酶之间关系
土壤碱性磷酸酶与木质素过氧化物酶(R2=0.27,P<0.01)和 β-葡萄糖苷酶 (R2=0.17,P<0.05)均呈显著线性负相关关系 (图4a和b)。土壤木质素过氧化物酶与β-葡萄糖苷酶(R2=0.59,P<0.01)和N-乙酰-β-D-葡萄糖苷酶(R2=0.26,P<0.01)均呈显著线性正相关(图 4c和 d)。
3 讨论
3.1 不同沙化梯度草地对土壤酶活性影响
土壤酶是土壤系统的物质循环与能量转换的参与者,被认为是评价土壤质量的重要指标[17-18, 28-29]。土壤亮氨酸氨基肽酶可以水解蛋白质,可以从肽链的末端水解形成氨基酸和其他疏水氨基酸[30];多酚氧化酶、木质素过氧化物酶和过氧化物酶均为氧化还原酶,它们参与芳香族化合物的氧化以及木质素的分解,对土壤碳积累有重要影响[31];土壤碱性磷酸酶促进有机磷化合物的分解,可将磷酸酯类水解成磷酸及其他产物[31];土壤脲酶直接参与土壤含氮有机化合物的转化,分解尿素生成CO2和水;β-葡萄糖苷酶与有机碳的转化有关,水解纤维二糖和其他水溶性的纤维糊精产生形成葡萄糖;N-乙酰-β-D-葡萄糖苷酶与有机碳和氮的转化密切相关[32]。杨英等[29]和尹亚丽等[17]针对不同草地类型研究发现,土壤亮氨酸氨基肽酶、多酚氧化酶和过氧化物酶活性对不同退化阶段的草地有一定的响应,而本研究中这3种酶无明显特征(图2a、e和f),出现这样截然相反的结果,可能是因为本研究取样为同一草地环境,其土壤性质差异不大。西藏不同退化阶段高寒草地研究发现,土壤碱性磷酸酶活性呈现先增加后降低的特点[23],其结果与本研究一致(图2c)。脲酶在土壤氮素循环中具有重要的水解作用,本研究中,土壤脲酶活性随沙化梯度的增加而降低,特别在S7~S9梯度明显 (图2b),表现出随土壤环境变化的高度敏感性[33-34]。此外,土壤β-葡萄糖苷酶和土壤N-乙酰-β-D-葡萄糖苷酶活性随着随沙化梯度的增加而递减,且β-葡萄糖苷酶对沙化梯度的响应更加明显(图2g和h),这一结果与吴秀芝等[9]的研究一致。
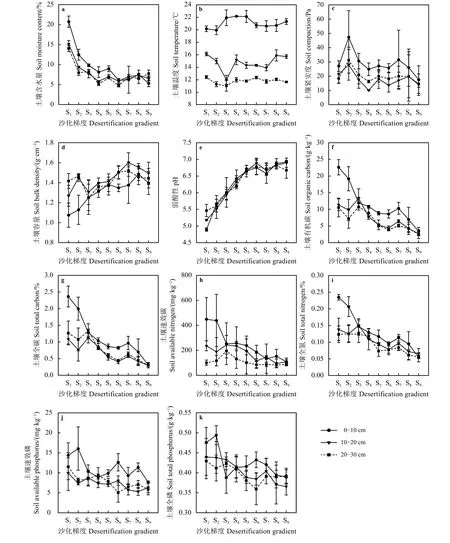
图3 不同沙化梯度草地土壤理化性质变化Figure 3 Changes of soil physical and chemical properties along a desertification gradient
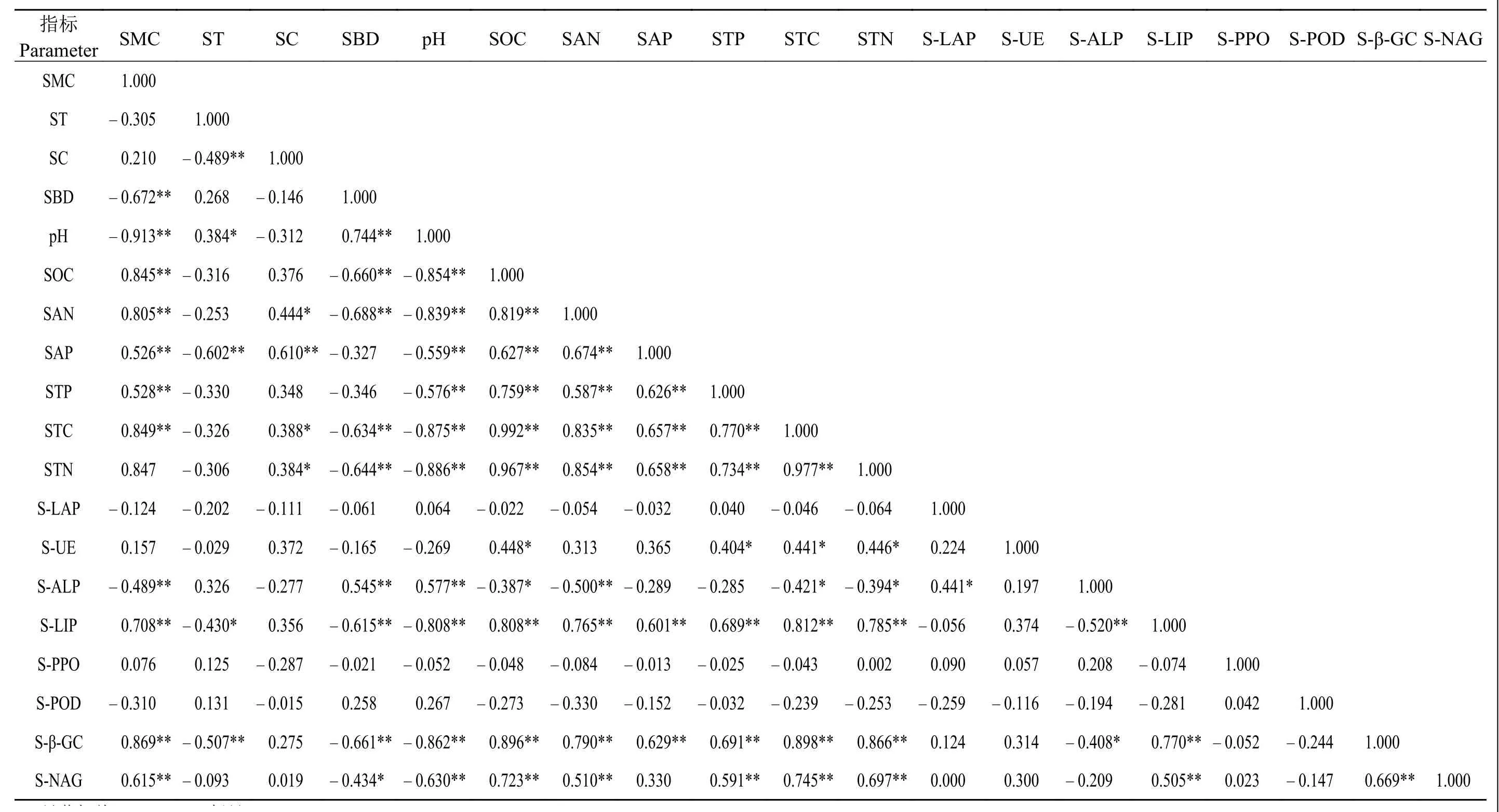
表1 不同沙化梯度草地土 壤理化性质和酶相关性Table 1 Correlation among soil physical and chemical properties and enzymes along a desertification gradient
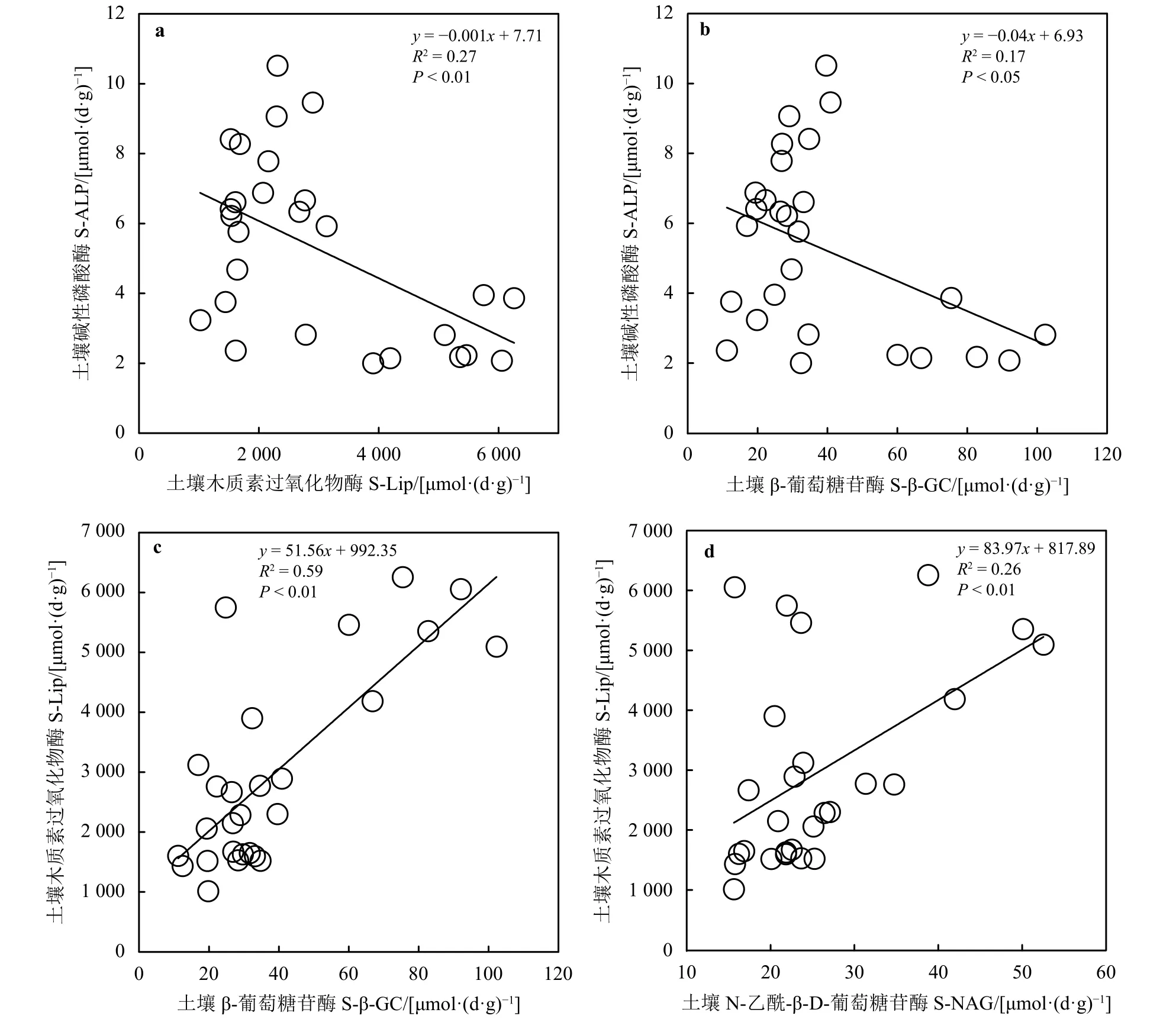
图4 土壤酶活性之间的关系Figure 4 Relationship between soil enzymes
3.2 不同沙化梯度草地对土壤理化性质的影响
土壤含水量、pH和容重是反映土壤质量的重要物质性参数[35-37]。本研究中,土壤含水量逐渐降低,且到S7后趋于缓和(图3a),同时,土壤容重呈增长趋势,且至S7后有缓慢降低(图3d),可能是由于在S7后,草地彻底沙化,土壤性质趋于稳定[37]。样地为酸性土壤,pH < 7,但是仍然呈现出随着沙化梯度的增加而增加的趋势(图3e),这一趋势无论在草地或者湿地,酸性土壤还是碱性土壤都能得到体现,而且酸性土壤中的表现更加强烈[23, 38],且在pH到一定程度后(S6)变化开始减弱(图3e),符合这一特点。在土壤各层,其养分(有机碳、全碳、速效氮、全氮、速效磷和全磷)随着沙化程度的增加而递减[39-41],且表层大于底层 (图 3f、g、h、i、j 和 k),主要是因为草地植物根系主要分布在表层土,枯落物和根系对草地土壤养分的贡献主要集中在表层土[41]。
3.3 土壤理化性质及酶的关系
有研究指出,在祁连山等地退化草地土壤含水量和多种酶正相关,可能是由于水分在影响土壤酶活性方面具有主效应,适宜的水分含量会使微生物之间正常竞争,酶活性达到最高[34]。本研究样地为沙化缺水草地,适当的水分能够促进土壤酶活性的提高,从而表现出水分含量的增加促进土壤酶活性增加的正向生态效应[42]。土壤容重是表征土壤松紧程度的一个重要指标,本研究土壤容重与木质素过氧化物酶、β-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶表现的相关性与前人的研究[43-45]有很多一致性,可能是由于随着沙化程度的加深,土壤容重变大,水热和通气条件等因素限制了土壤生物的代谢产酶能力,从而使土壤酶活性降低[42]。一些研究指出,土壤pH与脲酶显著正相关,与过氧化物酶、碱性磷酸酶和多酚氧化酶无相关性[33, 46]。本研究中,土壤pH与碱性磷酸酶、木质素过氧化物酶、β-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶表现的相关性说明土壤pH的增加促进碱性磷酸酶而抑制了其他酶的活性。而土壤碱性磷酸酶与木质素过氧化物酶和β-葡萄糖苷酶的负相关性(图4a和b)一定程度上说明,在不同的沙化梯度下,土壤碱性磷酸酶与木质素过氧化物酶和β-葡萄糖苷酶存在一定的抑制效应。一方面,可能是由于样地具有较高的土壤木质素过氧化物酶 [5 505 μmol·(d·g)-1]和 β-葡萄糖苷酶活性 [92.3 μmol·(d·g)-1],能够加快土壤碳氮循环,提高其利用效率,而土壤碱性磷酸酶的活性较低 [<10 μmol·(d·g)-1],植物受碳氮限制,会间接降低磷循环速率,进而抑制土壤碱性磷酸酶的活性[45-48];另一方面,随着沙化梯度的增加,土壤pH随之增加,从而促进碱性磷酸酶的水解,同时,pH的增加会使碳氮等多种营养元素降低,对土壤营养元素的循环和转化产生消极影响,进而间接抑制木质素过氧化物酶和β-葡萄糖苷酶活性[47-48]。
此外,土壤速效氮与木质素过氧化物酶、β-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶的相关性表明,这3类土壤酶活性能很好地反映土壤氮素状况,促进土壤中氮素的释放,而过高的氮循环会对碱性磷酸酶的活性产生抑制作用,从而表现出土壤速效氮与碱性磷酸酶的负相关性,这与吴秀芝等[9]基于荒漠草地沙化关于速效氮与酶的关系一致。本研究发现,在若尔盖地区样地土壤有机碳、全磷和全氮与脲酶均呈显著正相关关系(P<0.05);在三江源区高寒退化草地没有发现脲酶与这3种土壤养分的相关性[49];在黄河三角洲退化湿地,脲酶与全氮、速效氮显著正相关,与速效磷显著负相关,与全磷无相关性,脲酶活性与土壤理化性质可能因为退化环境不同呈现一定的差异[38]。目前,关于沙化草地土壤木质素过氧化物酶的研究不多,但是本研究发现,土壤木质素过氧化物酶与β-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶均呈显著线性正相关关系(P<0.01)(图4c和d),而且这 3 类酶活性和土壤营养元素的相关性基本一致(表1),它们之间存在一定的协同作用对草地沙化做出响应。即随着沙化程度的加深,土壤氧化过程占主导地位,但是没有过多的枯落物可供木质素过氧化物酶催化降解,其活性受到抑制,植物归还到土壤中的物质较少,代谢速率较慢,土壤β-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶等酶活性降低,表现为协同作用[25],符合前文关于不同草地沙化梯度下土壤酶之间的协同或抑制效应假设。
4 结论
若尔盖地区高寒草甸土壤理化性质和酶活性,随着沙化程度的变化产生一定的规律特征。除了温度变化不明显外,土壤含水量、紧实度、容重、pH以及土壤养分都有不同程度的响应。土壤碱性磷酸酶、脲酶、木质素过氧化物酶、β-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶活性随沙化梯度的变化表现出不同的变化趋势,特别是土壤β-葡萄糖苷酶具有显著差异。同时,土壤理化性质与这5种酶具有一定的相关性,与土壤亮氨酸氨基肽酶、多酚氧化酶和过氧化物酶不相关。本研究结果发现草地沙化过程中的不同土壤酶活性之间存在协同和抑制效应,能够为沙化草地土壤酶活性机理和草地生态系统质量评定,以及草地生态系统结构的稳定研究提出理论参考。

