藏北高寒草地土壤有机质化学组成对土壤CO2排放的影响
马书琴,鲁旭阳
(1.河南师范大学旅游学院,河南 新乡 453007;2.中国科学院水利部成都山地灾害与环境研究所山地表生过程与生态调控重点实验室,四川 成都 610041)
大气二氧化碳(CO2)是全球变暖的主要温室气体之一,对温室效应的贡献率高达60%[1-2]。土壤可通过生态系统呼吸过程向大气释放CO2,并受多种因素的影响,比如土壤动物和微生物活性,土壤水分、温度、有机质、铵态氮(NH4+-N)和硝态氮(NO3--N)含量等[3-5]。其中有机质作为土壤生态系统呼吸的主要碳源和能量来源,其含量的高低和化学组成特征直接关系着微生物代谢底物的多寡和质量[6-7]。草地生态系统作为全球碳循环的重要组成部分,其土壤环境及养分含量与植被类型密切相关。因此,不同类型草地土壤中有机质含量及组成可能通过影响土壤微生物数量和活性,进而影响土壤CO2的排放。
土壤有机质 (soil organic matter, SOM)是植物、微生物和动物残体在微生物分解及其他物理化学过程中变换而成的复合物质[8],这种复杂性使得在分子尺度上研究SOM具有一定挑战性。目前,热裂解气相色谱-质谱联用(pyrolysis-gas chromatography/mass spectrometry, Py-GC/MS)技术被广泛用于解析森林[9]、草原[10]和农田[11]等生态系统的SOM特征,该方法可以从分子尺度上获取SOM化学组成“指纹图谱”[12]。依据Py-GC/MS获取化合物的来源和相似性SOM主要分为多糖、木质素、蛋白质、酚类、脂肪酸类、烷烃类、芳香类、多环芳烃和萜烯类等物质,这些物质不同程度地影响着土壤微生物活性和土壤碳矿化过程[13]。如,Grandy等[14]研究加利福尼亚森林生态系统发现含氮化合物吡啶和吡咯的相对丰度与真菌和细菌比值呈负相关关系,而木质素衍生物相对丰度与真菌和细菌比值呈正相关关系;White等[15]和Yang等[16]研究北极苔原生态系统发现SOM中易降解成分初级多糖和蛋白质等,可以刺激微生物活性,从而促进自身转化为CO2。综上所述,SOM化学组成是影响土壤微生物活性和结构及土壤CO2排放的重要因素。
藏北高寒草地是世界上典型的高寒生态系统和生态脆弱带,其群落结构简单、自调节能力较弱,在全球碳循环调控中具有重要作用[17]。该区域由于低温限制,部分有机质成分被微生物降解利用,不易被微生物分解的成分则贮藏在土壤中,从而SOM在长期的不断累积和转化过程中形成了复杂的混合物[18]。关于藏北高寒草地生态系统的SOM化学组成和成分还尚未明确报道。另外,温度、水分被认为是影响青藏高原草地CO2排放的重要因子,植物凋落物混合物质和动物扰动也通过刺激微生物活性进而影响土壤CO2排放过程[19-20]。近年来研究认为,SOM的含量与土壤CO2排放量存在密切联系,而且青藏高原地区温度上升促进了SOM的分解,增加了土壤CO2的排放[21]。然而,SOM中哪些化学成分对土壤CO2排放起关键作用还鲜有研究。本研究利用Py-GC/MS方法研究SOM化学组成及其与土壤CO2排放和微生物数量的关系,分析藏北高寒草地土壤中是否存在某些特定的化学成分影响着SOM的生物稳定性以及土壤CO2排放潜力。
1 材料与方法
1.1 研究区域及试验设计
本研究对象是藏北两种不同类型草地(高寒草甸和高寒草原),分别以矮嵩草(Kobresia humilis)和紫花针茅(Stipa purpurea)为主要物种,采样点集中于西藏那曲市和阿里地区。该区域属高原亚寒带气候区,寒冷干燥,无绝对无霜期。平均年降水量为298~462 mm,一年中大部分降水集中于6-8月。年均气温-2.8 ℃,最暖月为7月,月均温度不及14 ℃,最冷月为1月,月均温度为-10 ℃以下[22-23]。
在高寒草甸和高寒草原各布设5个样点,共计10 样点。在每个样点选取 3 个 0.5 m × 0.5 m 样方,用铁铲挖取土体表层0-15 cm土壤,混匀后并装入塑封袋内。土壤样品分为两份,一份过0.25 mm筛后风干,用于测定土壤基本理化性质和SOM化学组成;另一份混匀并过2 mm筛后,4 ℃冷藏,用于室内培养测定CO2排放量和磷脂脂肪酸组成。野外采样于2016年8月完成。
2016年9 月至2017年4月进行室内培养试验。将相当于100 g干土的鲜土放置250 mL锥形瓶中,并用保鲜膜将瓶口封住后放置于恒温培养箱中。由于样品采自不同区域,本研究选择微生物生长较适宜的温湿度进行培养,设置每个处理中土壤水分为40%最大田间持水量(Water holding capacity, WHC),在室内 25 ℃ 培养 210 d,每个处理设置3个重复。土壤CO2气体的释放在培养的前14 d,每2 d测定一次;第15天到第49天,每3 d测定一次;第50天到第210天,除特定情况外,约7 d测定一次。每次测定开始前用橡胶塞封住培养瓶口,用真空泵将培养瓶中抽为真空状态,之后统一通入空气(空气为统一购置的干空气),并用注射器抽取空气10 mL测定CO2浓度(w1),然后在培养箱中恒温培养2 h后再用注射器抽取培养瓶中土壤上部空间气体10 mL测定CO2浓度(w2),w2-w1值为恒温培养2 h内土壤CO2排放量。气体样品在取样后24 h内用安捷伦气相色谱仪(Agilent 7890A,Agilent Technologies Inc., USA)测定。
1.2 样品测定
土壤化学性质采用常规分析法测定[24]。土壤NH4+-N以及NO3--N用流动注射分析仪测定;SOM含量和土壤全氮(TN)采用元素分析仪测定;pH采用酸度计测定;容重采用环刀法测定。用磷脂脂肪酸标记土壤微生物,采用HP6890-HP5973型气相色谱质谱联用仪分析氯仿-甲醇-柠檬酸缓冲液提取的磷脂脂肪酸的组成,获得细菌、真菌、放线菌、革兰氏阴性细菌和革兰氏阳性细菌磷脂脂肪酸标志物的含量[25]。
采用Py-GC/MS方法测定SOM化学组成。将收集的用于测定有机化学成分的土壤样品置阴凉处自由风干,然后将其研磨成细粉。测定时,称取磨细后的土壤样品10~20 mg,利用Pyrofoil包裹,然后利用居里点热裂解仪对样品在590 ℃进行高温裂解。将裂解后产品在线传送到气相色谱实验室,界面温度 250 ℃,分流比 50 ∶ 1,氦 (He)作为载气,流速1.0 mL·min-1。裂解产品在气相色谱柱中进行分离,分离时先在40 ℃保持5 min,然后以5 ℃·min-1速度加热到 270 ℃,接着以 30 ℃·min-1速度跳跃,使最终温度保持在300 ℃。将色谱柱分离的产品利用质谱仪进行检测,EI离子源电压为70 eV,传输线温度为 270 ℃,离子源温度为200 ℃[26]。将Py-GC/MS分析获取的峰利用自动质谱 图 解 卷 积 鉴 定 系 统 (The Automatic Mass Spectral Deconvolution and Identification System, AMDIS 2.72)、质谱库 (National Institute of Standards and Technology,NIST MS Library 2014)和已发表的相关文献进行分析和鉴定[27]。鉴定的化学成分利用相对丰度表示其含量大小,相对丰度不能反映出该化学成分在SOM中绝对的丰度,但是能反映出SOM各化学成分的相对组成特征,因此被广泛用来分析SOM化学成分的相对定量。根据其性质和前体物质以及已发表的众多文献信息将SOM化学成分大体归类为木质素、脂质、多糖、蛋白质、含氮化合物等类别(化学组成)。根据测定的化学成分和确定的化学组成,构建高寒草草甸和高寒草原SOM的“指纹图谱”。
1.3 数据处理
土壤CO2的累积排放量(cumulative emissions)用以下公式计算[20]:

式中:F是指土壤 CO2的释放速率 [mg·(kg·h)-1],i是指第i个土壤样品,ti+1-ti是指前后两次土壤CO2释放测定的时间差,n指总测定次数。
运用 SPSS 20.0(U.S., IBM, 2011)中独立样本 T检验对两种草地类型土壤基本性质及化学组成进行差异性比较;利用双变量相关分析法分析SOM化学组成相对含量与微生物数量及CO2累积排放量之间的相关性。使用 Sigmaplot 10.0(Germany, Systat Software, Inc., 2006)进行作图。
2 结果
2.1 藏北高寒草地土壤基本性质以及CO2排放特征
高寒草甸土壤SOM、NH4+-N和NO3--N含量显著(P< 0.05)高于高寒草原土壤(表1)。高寒草原土壤容重 (1.44 g·cm-3)与高寒草甸土壤容重 (1.31 g·cm-3)间差异性未达到显著水平 (P> 0.05)。
经过210 d培养后,高寒草甸土壤CO2累积排放量 (1 246.67 mg·kg-1)显著高于高寒草原土壤(643.15 mg·kg-1) (P<0.05)。培养期间两种土壤的 CO2排放通量均未出现明显波动。高寒草甸土壤在培养过程中的平均 CO2排放通量为 0.23 mg· (kg·h)-1,高寒草原土壤为 0.11 mg·(kg·h)-1(图 1)。
2.2 藏北高寒草地土壤有机质化学组成
对藏北高寒草甸和高寒草原SOM的Py-GC/MS图谱和Nist 2014数据库质谱图进行比对,并去除无法识别的和仅有一个样品中出现的化学成分,最终筛选出化学成分(表2)。所有土壤样品可解析出的化学成分中,含氮化合物种类最多,为23种;其次是脂肪类,为12种;萜烯类和杂环类较少,分别为1和2种。在SOM化学组成中,D-丙氨酸(D-alanine)是主要含氮化合物,其次是吡啶(Pyridine);芳香类化物的主要裂解产物是甲苯(占SOM化学组成的2.12%~5.38%);酚(Phenol)(1.20%~4.41%)和2/3-甲基酚(2/3-Methylphenol)是主要的酚类化合物;糖醛(Furfural)是主要多糖类化合物,其中高寒草甸SOM中糖醛所占比例较高,其值大于3%;萘(Naphthalene)是主要的多杂环类(Polyaromatics);木质素化合物主要为2-甲氧基-4-乙烯基酚(2-Methoxy-4-vinylphenol) (表 2)。
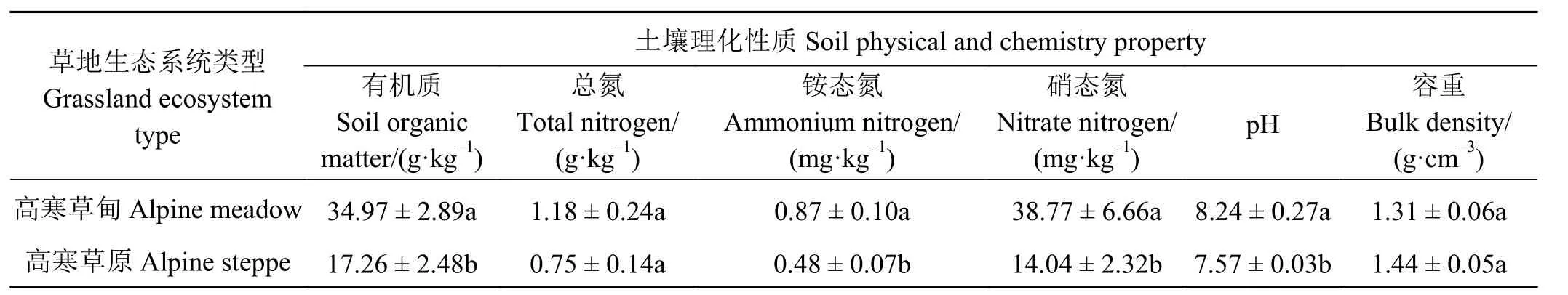
表1 高寒草地生态系统土壤理化性质Table 1 Soil physical and chemistry properties of different ecosystems
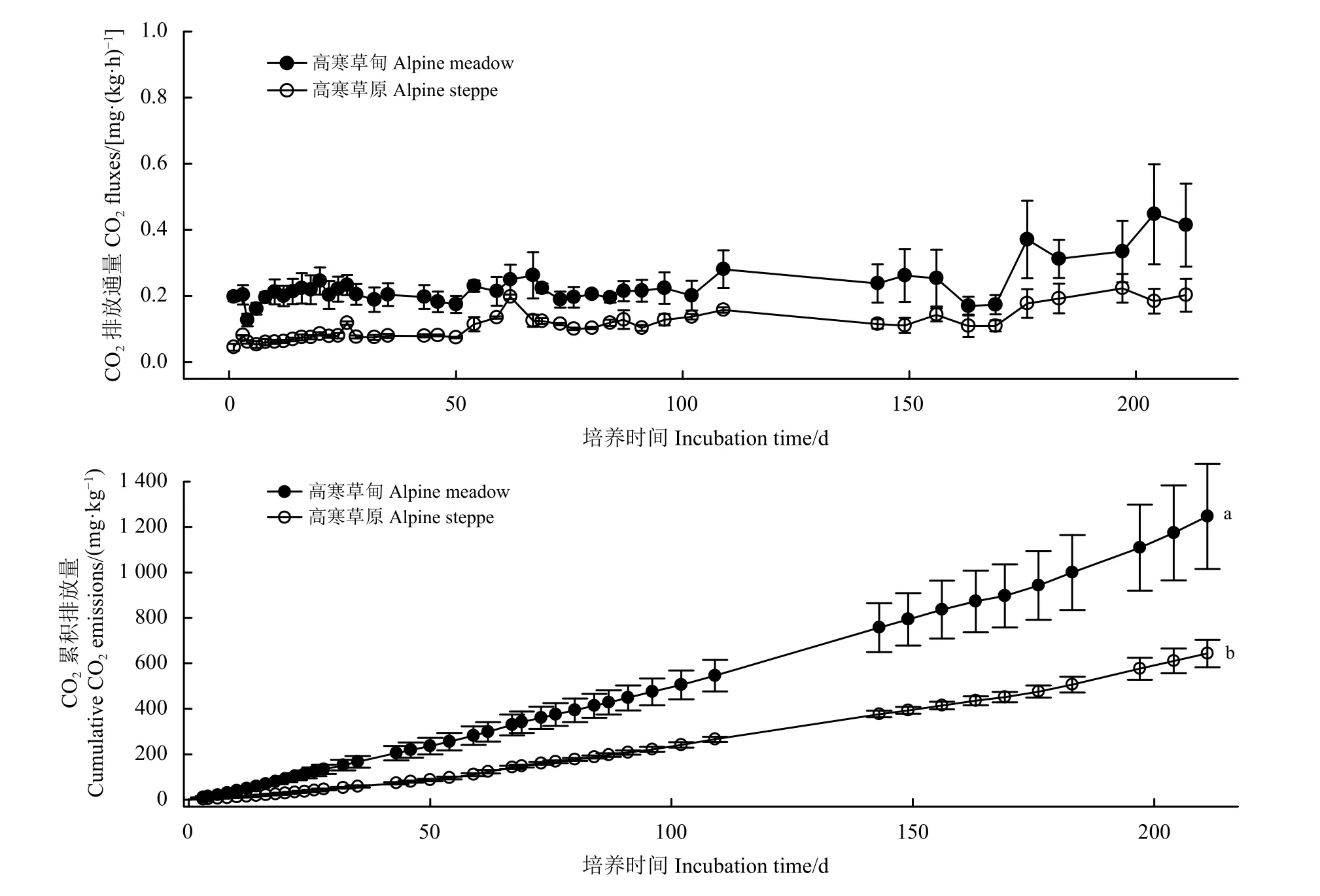
图1 高寒草地土壤培养过程CO2排放通量和累积排放量Figure 1 Soil CO2 fluxes and cumulative emissions during the incubation period

表2 藏北高寒草地土壤有机质Py-GC/MS裂解产物Table 2 List of Py-GC/MS products in the alpine meadow and alpine steppe soil samples
Py-GC/MS图谱解析结果显示,高寒草甸和高寒草原SOM中含氮化合物相对丰度高于其他有机成分,占全部化合物的38.0%~52.5%。不过,两种类型高寒草地土壤含氮化合物的相对含量无显著差异(P> 0.05);烷烯烃类、多糖类和芳香烃类则表现为高寒草甸土壤显著(P< 0.05)高于高寒草原土壤;脂肪酸类、木质素、多环芳烃类和酚类在两种类型土壤间无显著差异 (P> 0.05) (图 2)。

图2 藏北高寒草甸和高寒草原土壤有机质化学组成相对含量Figure 2 Relative abundance of soil organic matter chemical composition in the alpine meadow and alpine steppe soils
2.3 藏北高寒草地土壤有机质化学组成与CO2排放的关系
相关分析发现(表3),土壤CO2累积排放量与土壤中含氮化合物、烷烯烃类、脂肪类、木质素类、酚类、多杂环芳香烃类不相关(P> 0.05);而与芳香烃和多糖类相对含量显著(P< 0.05)和极显著正相关(P< 0.01),其相关系数r分别为0.670和0.800。基于210 d室内培养试验,建立了关于多糖类与 CO2累积排放量之间关系式,为Y= 86.761X+344.87(R2= 0.632 1,P< 0.05),式中Y为 CO2累积排放量(mg·kg-1),X为SOM中多糖类物质的相对含量(图 3)。
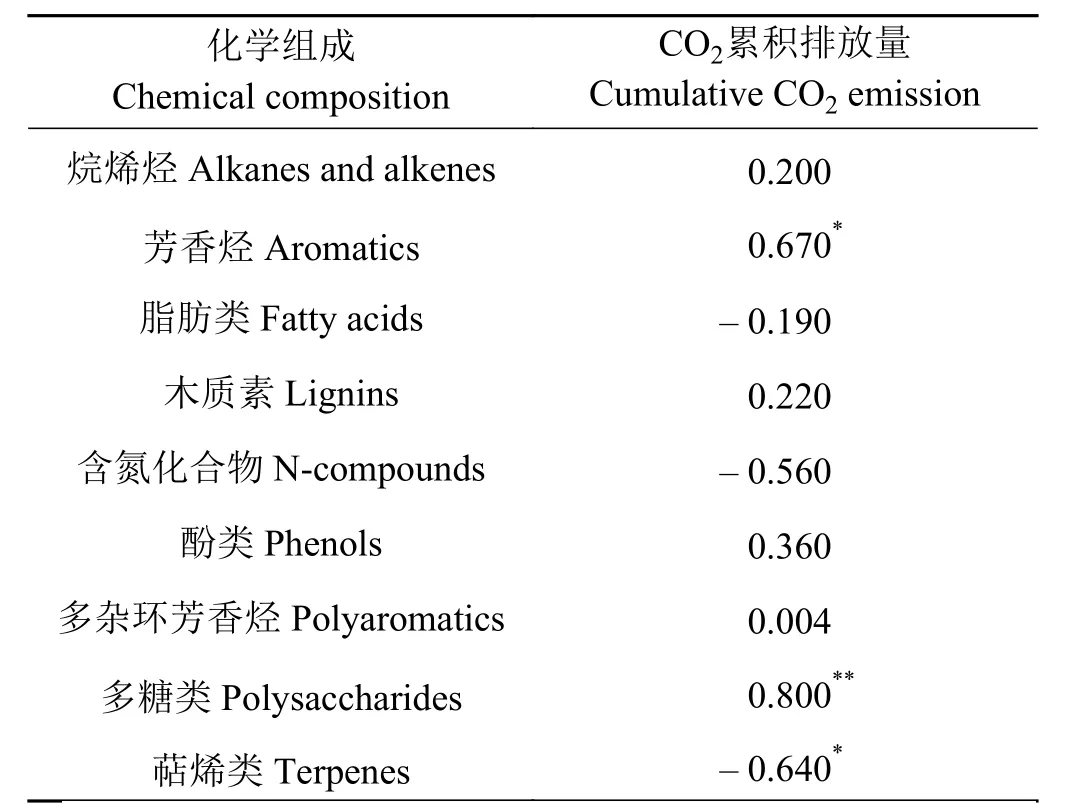
表3 土壤有机质化学组成与土壤CO2累积排放量的相关系数Table 3 Correlation analysis between the soil organic matter chemical composition and cumulative CO2 emission
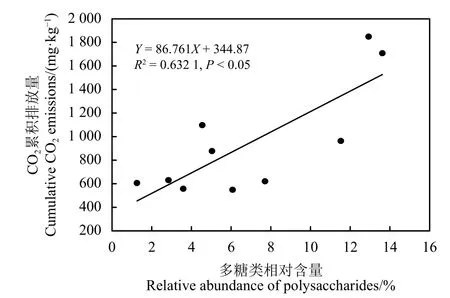
图3 藏北高寒草地土壤有机质化学组成多糖类相对含量与CO2累积排放量的相关关系Figure 3 Correlation analysis between the soil organic matter chemical composition and cumulative CO2 emission
2.4 藏北高寒草地土壤有机质化学组成与微生物之间关系
芳香烃类和多糖类的相对含量与土壤中磷脂脂肪酸生物标记的细菌、真菌、放线菌、革兰氏阴性细菌和革兰氏阳性细菌含量间显著(P< 0.05)或极显著正相关(P< 0.01);含氮化合物的相对含量与微生物数量均显著负相关 (P< 0.05)(表 4)。
3 讨论
3.1 藏北高寒草地土壤有机质化学组成对CO2释放的影响
藏北高寒草地生态系统中,SOM含量明显影响土壤呼吸产生CO2,其中可溶性有机质含量与土壤释放的CO2存在密切联系[5, 28],表明SOM矿化过程中可溶性有机质被优先利用,如可溶性有机氮和可溶性有机碳[18]。Pare和Bedard-haughn[29]研究北极苔原生态系统发现烷类碳和芳香类也显著影响土壤CO2的排放,这与本研究结果相一致,表明SOM作为藏北高寒草地生态系统土壤CO2是主要来源,除了在含量上影响着CO2的排放,其质量上也与CO2排放存在一定联系。
不同类型草地SOM化学组成结构的复杂程度的差异直接决定了微生物的利用效率,从而导致土壤CO2排放过程存在差异性。通常认为,土壤微生物较易分解利用蛋白质和多糖类物质,而对结构相对稳定的芳香类化合物的降解能力较低[30-31]。本研究显示,土壤CO2累积释放量与多糖类显著正相关,与含氮化合物显著负相关,White等[15]和Dai等[32]也得到了类似结果。SOM中多糖的相对含量与CO2排放之间表现为较强相关性可能是由于SOM化学组成中多糖类物质最易降解,其降解速率较快而降解程度较为彻底,为CO2排放提供了主要的碳源物质,进而对预测土壤呼吸具有重要指导作用[15, 33]。
土壤中氮元素含量对CO2动态过程影响的研究大多数集中于无机态氮元素,而土壤中的无机氮素主要来源于微生物对有机氮的矿化作用。因此,土壤中有机氮的含量和质量可能会影响土壤供氮能力进而间接影响土壤CO2的排放。已有研究表明土壤中含氮化合物(有机氮)中不同化学成分错综复杂的连接在一起可能抑制土壤中有机氮的降解过程,使得这部分物质在土壤中相对稳定[34]。本研究结果显示,含氮化合物与CO2排放之间相关性未达到显著水平,这可能是由于本研究培养时间较短,土壤微生物仅利用了土壤中已有的无机氮,而有机态氮未被分解利用,也可能是含氮化合物存在一定抗性,无法被微生物所降解利用,关于这部分研究可以考虑在未来采用同位素标记方法深入分析。
3.2 藏北高寒草地土壤有机质化学组成对微生物影响
土壤微生物作为草地土壤生态系统的重要组成部分,直接参与并调节着土壤物质循环过程[35-36]。同时,土壤微生物对环境变化较为敏感,其数量、活性、分布特征以及分解有机物质的能力与土壤中有机物质含量和质量密切相关[37]。微生物对SOM的分解是土壤CO2的主要来源,SOM化学组成除了与CO2排放量之间存在直接联系,可能还影响着土壤中微生物数量。本研究显示,土壤中细菌、真菌、放线菌、革兰氏阴性细菌和革兰氏阳性细菌数量均与SOM中芳香烃和多糖类物质相对含量密切相关,表明微生物在SOM化学组成中的重要作用。
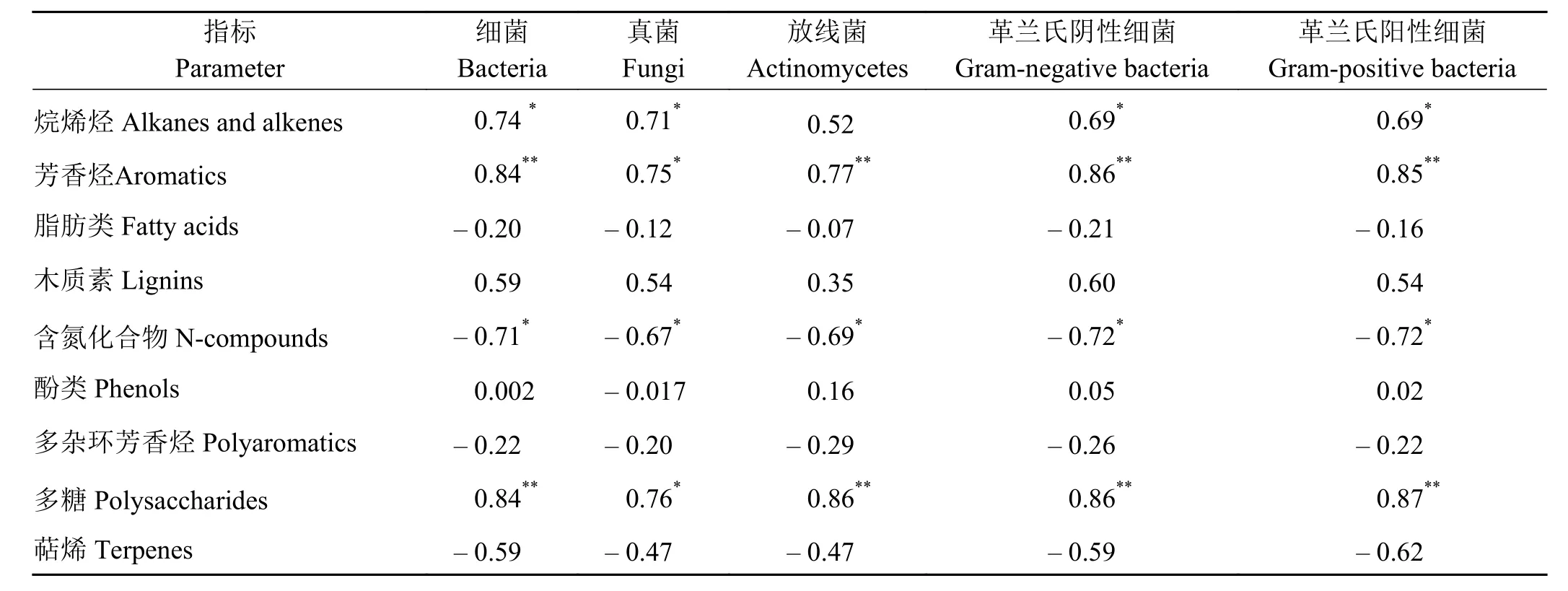
表4 土壤有机质化学组成与土壤微生物数量的相关系数Table 4 Correlation analysis between the soil organic matter chemical composition and microbial quantity
SOM中多糖含量和质量对土壤呼吸以及形成适宜植物生长的土壤结构具有重要作用[38],且该物质是最易被微生物所分解和利用的成分[39]。因此,高寒草甸土壤相比高寒草原中的相对较为丰富的多糖类化学成分可能主要来源于微生物,这部分化合物被整合到微团聚体中,最终通过与有机矿物相互作用稳定的保存下来[40]。藏北高寒草地土壤中细菌、真菌、革兰氏阴性细菌和革兰氏阳性细菌与芳香类化合物呈正相关关系,而与木质素间相关性未达到显著水平。木质素是在真菌、细菌以及相关微生物共同作用下降解的,真菌占据着主要地位[39]。白腐真菌分泌的酚氧化酶可以将木质素初步降解成为芳香烃化合物,特定的细菌进一步将这些成分矿化成低分子量的化合物[41]。细菌由于其来源广泛且繁殖速度快,可以在木质素的降解过程中起到辅助作用,如支链改性、环开裂和解聚等[42]。因此,藏北高寒草地土壤中木质素可能是作为能源和碳源物质被微生物分解,同时这些微生物可以产生相应降解酶从而将木质素转化成芳香烃等低分子片段。藏北高寒草地SOM化学组成中含氮化合物负相关于所测定的微生物数量,说明多数有机氮对微生物生长和发育的贡献要低于其他物质,甚至可能抑制土壤中氮素在各形态之间的相互转变[12]。
4 结论
本研究基于Py-GC/MS方法分析了藏北高寒草甸和高寒草原SOM本质特征,并探讨了不同化学组成对高寒草地土壤微生物数量和土壤CO2排放的影响。研究结果显示高寒草甸和高寒草原两种类型草地的SOM化学组成存在明显差异,而且SOM化学组成中部分化合物的相对含量与土壤呼吸作用存在密切联系。这从新视角和方法上认识了高寒环境下影响土壤CO2排放的决定性因素,也为研究不同环境条件土壤CO2排放特征提供新的理论依据。

