miR-33a对胃癌细胞生物学功能的影响
谭瓛,刘云杰
胃癌是临床常见的消化道恶性肿瘤之一,我国胃癌的发病率及病死率均居世界前列,在各类恶性肿瘤的死因中位列第二,严重影响国人的生命健康[1]。近年来,随着医疗技术及医疗手段的不断发展,临床采用内镜下摘除及外科手术等综合治疗措施治疗早期胃癌已取得很好的疗效,早期胃癌患者治疗后5年生存率可高达90%以上[2]。但是,胃癌早期不易发现,患者在确诊时大多已出现转移或浸润,错过最佳治疗时机,手术治疗已很难根治,疗效不佳[3]。因此,如果能从分子学角度,分析胃癌的发生机制,将有助于胃癌的早期诊断及治疗,改善预后[4]。微小RNAs(microRNAs,miRNAs)是一类非编码小分子RNA,长度约为19~23个核苷酸,广泛存在于真核生物中[5]。miRNAs可调控人体超过30%的基因,与生物体内各项生物学性能密切相关,参与肿瘤细胞增殖、分化、迁移、侵袭及周期调控等生物学过程[6]。大量研究显示,多种肿瘤细胞中可检测到miRNAs的异常表达,其能发挥抑制或促进肿瘤细胞发生及发展的作用[7]。miR-33a为位于Srebp基因的内含子上的一个高度保守的miRNA,被证实在多种肿瘤组织中异常表达,近年来其与肿瘤之间的关系逐渐受到研究人员的关注与重视[8]。本研究采用实时定量PCR技术分析miR-33a在胃癌组织中的表达,并通过细胞实验探究miR-33a对胃癌细胞生物学功能的影响,旨在为临床诊断及治疗胃癌提供理论参考。
1 材料与方法
1.1 胃癌组织标本及胃癌细胞
收集2016年3月至2017年12月在我院外科住院患者的胃癌标本40例,标本来源患者中女18例,男22例;年龄35~78岁,平均(52.33±6.89)岁。纳入标准:经病理检测证实为胃癌,术前未接受任何放疗及化疗,临床病理资料完整。排除标准:术前接受化疗或放疗,临床病理资料不完整。本研究经本院医学伦理委员会批准实施,所有患者均知情并签署知情同意书。每例标本分别取癌组织及癌旁正常组织放入冻存管,置于液氮罐中保存备用。人胃癌细胞株SGC-7907购于上海生科院细胞研究所。
1.2 实验试剂及仪器
细胞培养基(美国Science公司),胰酶(美国Life Technology公司),Trizol与转染脂质体(美国invitrogen公司),胎牛血清(美国Life Technology公司);miR-33a引物及miR-33a模拟物(上海生工生物有限公司);显微镜(日本Olympus公司);PCR扩增仪(美国PE公司);恒温细胞培养箱(美国Thermo公司)。
1.3 实验方法
1.3.1 细胞培养与转染
将人胃癌细胞株SGC-7907分散于含10%胎牛血清的细胞培养基中,置于细胞培养箱中培养(35 ℃,5%CO2)培养。参照转染试剂盒说明书,以脂质体为载体将miR-NC(阴性对照)和miR-33a模拟物(miR-33a mimics)分别转染至SGC-7907细胞,随后将细胞置于细胞培养箱中培养。
1.3.2 实时定量PCR(RT-PCR)检测
分别取200 mg胃癌组织及癌旁正常组织,于研钵中研碎后采用Trizol试剂提取总RNA,逆转录成cDNA,选择待检测基因的合适上下游引物,以cDNA为模板,采用PCR方法扩增待检测基因,基因产物通过2%琼脂糖凝胶检测。引物设计:miR-33a上游:5′-GGTGCATTGTAGTTGCATTGC-3′,下游:5′-GTGCAGGGTCCGAGGTATTC-3′。以GAPDH为内参蛋白。采用2-ΔΔCt法计算CDKN2B-AS1及miR-411-3p的相对表达量,每组设3个复孔,实验重复3次。
1.3.3 CCK-8法检测细胞增殖
分别取对数期生长的SGC-7907细胞、转染miR-NC和miR-33a minmics的SGC-7907细胞,经胰酶消化后分散于细胞培养基中制成单细胞悬浮液,以1×104个/孔的密度将细胞接种于96孔板,每组设置3个复孔,置于细胞培养箱(35 ℃,5%CO2)中孵育。分别于孵育后12 h、24 h、36 h、48 h、60 h按照CCK-8检测试剂盒说明书加入CCK-8试剂,采用酶标仪检测各孔在450 nm波长处的吸光度值(OD450),绘制细胞生长曲线。
1.3.4 Transwell小室实验检测细胞迁移
细胞转染24 h后,胰酶消化,于不含胎牛血清的细胞培养基中饥饿培养24 h,经胰酶消化后分散于不含胎牛血清的细胞培养基中制成单细胞悬浮液,调整细胞浓度为1×105个/mL,取300 μL加入Transwell小室的上室,下室加入500 μL含10%胎牛血清的细胞培养基,置于细胞培养箱中培养。24 h后取出小室,除去上室内液体,用棉签擦净膜上未迁移的细胞,采用0.1%结晶紫染色10 min,于100倍光镜下随机选取5个视野拍照并计数浸润至膜背面的细胞数,取平均值为各组细胞迁移数。
1.3.5 Transwell小室实验检测细胞侵袭
将人工合成的基底膜材料Matrigel胶用7倍体积的无血清培养基稀释,取60 μL加于小室的各孔中,摇晃均匀后静置过夜。细胞转染24 h后,胰酶消化,于不含胎牛血清的细胞培养基中饥饿培养24 h,经胰酶消化后分散于不含胎牛血清的细胞培养基中制成单细胞悬浮液,调整细胞浓度为1×105个/mL,取300 μL加入Transwell小室的上室,下室加入500 μL含10%胎牛血清的细胞培养基,置于细胞培养箱中培养。24 h后取出小室,用棉签擦净Matrigel胶后采用0.1%结晶紫染色10 min,于100倍光镜下随机选取5个视野拍照并计数浸润至膜背面的细胞数,取平均值为各组细胞侵袭数。
1.3.6 细胞粘附实验
向24孔板中加入Matrigel原胶溶液,0.2 mL/孔,风干过夜(37 ℃),PBS清洗两次,每孔加入0.2 mL 3%牛血清蛋白,孵育2 h,PBS清洗两遍。将各组细胞按1×103个/孔的密度接种于上述预处理的24孔板,于37 ℃保温20、40、60、后,轻轻拭去未粘着的细胞,PBS清洗两遍,于100倍光镜下随机选取5个视野拍照并计数粘附细胞数,取平均值为各组粘附细胞数。
1.4 统计学方法
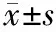
2 结果
2.1 miR-33a在胃癌组织及癌旁正常组织中的表达
40例患者胃癌组织中miR-33a相对表达量为0.73±0.15,低于癌旁正常组织的1.29±0.26,差异具有统计学意义(t=11.799,P<0.001),见图1。
2.2 miR-33a对胃癌细胞增殖的影响
随着培养时间延长,Control、miR-NC及miR-33a mimics组细胞OD450逐渐升高(P均<0.01)。培养12 h及24 h时,各组细胞OD450无明显差异(P>0.05)。培养36 h、48 h及60 h后,Control组与miR-CN组细胞OD450无明显差异(P>0.05),均高于miR-33a mimics组(P<0.05),见表1。
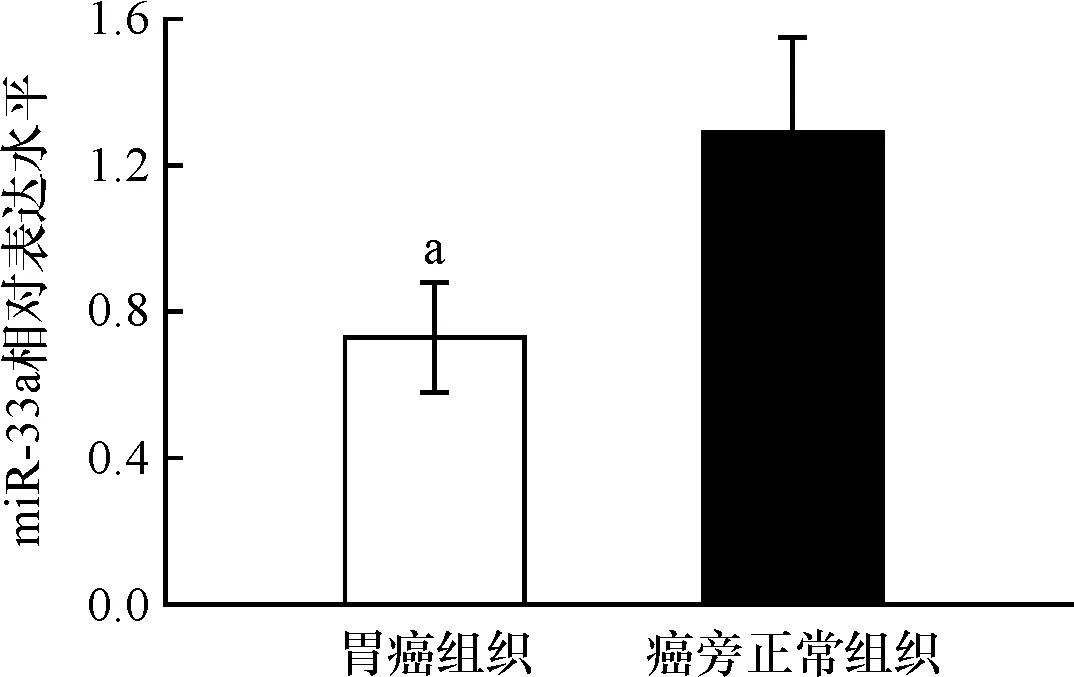
图1胃癌组织及癌旁正常组织中miR-33a相对表达量比较与癌旁正常组织比较,aP<0.001
2.3 miR-33a对胃癌细胞迁移的影响
miR-33a mimics组迁移细胞数为(32.65±3.48)个,低于Control组(62.33±5.23)个的及miR-NC组的(59.65±4.78)个,差异均具有统计学意义(P<0.05),见图2。
2.4 miR-33a对胃癌细胞侵袭的影响
miR-33a mimics组侵袭细胞数为(22.13±2.03)个,低于Control组的(54.36±4.12)个(P<0.01)及miR-NC组的(52.25±3.98)个(P<0.01),见表2。
2.5 miR-33a对胃癌细胞粘附的影响
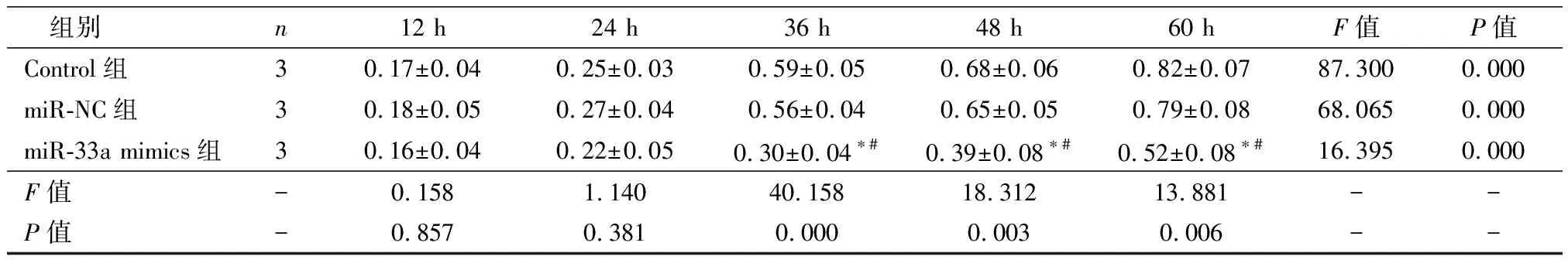
表1 孵育不同时间后三组细胞OD450比较
注:与Control组比较,*P<0.05;与miR-NC组比较,#P<0.05
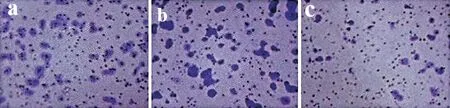
图2miR-33a对胃癌细胞迁移的影响(×200) (a)Control组;(b)miR-NC组;(c)miR-33a mimics组
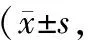
表2 不同组细胞侵袭数比较个)
注:与Control组比较,*P<0.01;与miR-NC组比较,#P<0.01
随着孵育时间延长,miR-33a mimics组及miR-NC组细胞粘附数均明显增加(F=126.749、22.033,P<0.05),20、40及60 min后miR-33a mimics组细胞粘附数分别为均低于miR-NC组[(194.65±22.31)个vs(256.33±26.32)个、(278.64±22.36)个vs(415.25±34.57)个、(303.25±34.78)个vs(657.45±54.23)个,P均<0.05]。见图3。
3 讨论
胃癌是世界范围内常见的消化道恶性肿瘤之一,是由多种因素共同影响及作用而诱导产生的高异质性和复杂性肿瘤疾病[9]。近年来,随着临床综合治疗方案的不断发展,胃癌的病死率明显降低,但是胃癌晚期患者的预后依然较差,其术后5年生存率仅为20%,严重威胁患者的生命健康[10]。

图3 miR-33a对胃癌细胞粘附的影响(×100)
肿瘤细胞的增殖、迁徙、侵袭及凋亡等多种生物学行为是导致胃癌患者病死率居高不下的关键因素,因此研究胃癌发生发展过程中各项生物学功能对于胃癌的防治具有重要的意义[11]。
研究证实,miRNA在转录后水平调节机体基因的表达,参与肿瘤发生与发展过程中的生命活动,包含肿瘤细胞增殖、侵袭、转移及凋亡等[12]。miR-33a为miR-33两种亚型中的一种,被证实在结肠癌、胰腺癌、肝癌、宫颈癌等各类肿瘤细胞中异常表达[13]。Karatas等[14]研究显示,在淋巴瘤、肝癌、结肠癌、前列腺癌等肿瘤细胞中miR-33a表达量明显低于癌旁正常组织,miR-33a能发挥抑癌基因的作用,实现对肿瘤细胞的调节作用。在本研究中,通过对比研究发现,胃癌组织中miR-33a表达量明显低于癌旁正常组织,提示miR-33a与胃癌的发生与发展密切相关,与Wang等[15]研究结果相符。
为了进一步研究miR-33a在胃癌细胞生物学功能中的作用,本研究选取人胃癌细胞株SGC-7907为研究对象,以脂质体为载体将人工合成的miR-33a转染至SGC-7907细胞,实现miR-33a在SGC-7907细胞中的过表达。肿瘤细胞的恶性增殖的癌症进一步发展的基础,本研究发现相比较于正常SGC-7907细胞,转染miR-33a可明显抑制细胞增殖能力,提示miR-33a基因在胃癌中能发挥抑癌的作用。Tsai等[16]亦通过体外细胞实验证实miR-33a参与胃癌细胞的增殖过程,上调miR-33a基因表达能显著抑制胃癌细胞的增殖能力,实现抗肿瘤作用。一方面,miR-33a可以靶向细胞周期蛋白依赖性激酶6(CDK6),通过下调CDK6影响细胞周期,抑制细胞胃癌细胞增殖[17]。另一方面,miR-33a还可以通过抑制原癌基因Pim-1表达产物Pim-1蛋白抑制胃癌细胞增殖[18]。
肿瘤细胞的迁移及侵袭是影响胃癌患者预后的关键因素之一,其主要通过多步骤的连续过程得以实现[19]。肿瘤细胞的转移与侵袭过程首先是肿瘤细胞从原发病灶部位脱落,随后进入循环系统,迁移至特定器官或组织上进行粘附,进入血管壁后定居,进一步分化、增殖形成转移灶[20]。Nouraee等[21]将miR-33a基因转染于食管癌细胞中,以未经转染的食管癌细胞作为对照,经对比研究发现miR-33a基因对食管癌细胞的迁移及侵袭能力具有明显的抑制作用,说明miR-33a能抑制肿瘤细胞发生转移及侵袭。本研究发现,向SGC-7907细胞转染miR-33a后,其细胞转移及侵袭能力均明显降低,说明miR-33a能有效抑制胃癌细胞发生转移及侵袭。有学者认为,当肿瘤细胞的粘附能力受到抑制时,脱落的肿瘤细胞因粘附受阻而在循环系统中凋亡,进而抑制肿瘤细胞的迁移及侵袭能力[22]。在本研究中,转染miR-33a的SGC-7907细胞的粘附能力明显下降,而其相应的细胞转移及侵袭能力均明显降低,也就是说抑制miR-33a发挥对SGC-7907细胞转移及侵袭能力的抑制作用是通过降低其粘附能力实现的。提升miR-33a基因表达后,SGC-7907细胞粘附力受到明显抑制,使其无法粘附在特定的器官及组织上,从而无法实现进一步增殖及分化,抑制其转移及侵袭的能力[23]。
综上所述,miR-33a在胃癌组织中低表达,上调miR-33a表达量能明显抑制胃癌细胞增殖、迁移、侵袭及粘附能力,提示miR-33a对胃癌细胞生物学性能产生明显影响,有望成为胃癌治疗的新靶点。

