千草方熏洗对膝骨关节炎大鼠软骨YAP/Smad3表达的影响*
李宏军,施 源,何 敏,李 坚,王君君,邓新超,鲁 密,张 辉,吴 岩,吴红丽,梁 平
(武汉市第八医院,湖北 武汉 430010)
膝骨关节炎(knee osteoarthritis,KOA)作为全球范围内最常见的关节炎之一,伴随有炎症、组织结构病变、疼痛和关节功能丧失等症状,给患者日常生活带来了极大的痛苦[1]。KOA还是一种慢性老年性疾病,女性发病率高于男性,随着全球老年化的加速,KOA成为引起老年人残障的主要疾病之一[2-3]。因此控制和治疗KOA显得尤为重要。
国内外KOA治疗方法包括西药治疗、手术治疗和传统中医药治疗等。西药治疗效果存在局限性,只可在短期内缓解症状。手术治疗主要为膝关节镜下关节清理术及综合治疗和全膝关节置换术,具有良好的治疗效果但均存在着一系列术后并发症[4]。传统的中医治疗方法包括内治法、中药外治法和针灸治疗等,其中中药外治法主要有中药贴敷、中药涂抹、中药热敷、中药熏洗和中药蜡疗等[5]。作者前期研究结果初步表明,中药(千草方)熏洗联合关节内注射透明质酸(hyaluronic acid,HA)能够有效缓解KOA[6],但有关千草方熏洗治疗KOA的机制还鲜少研究。已有的研究结果表明,Yes相关蛋白(Yes-associated protein,YAP)对软骨细胞具有抗凋亡和促增殖的作用[7],而且YAP还能够作用于TGF-β/Smad信号通路[8]。Smad3也被证明与软骨细胞肥大等相关[9]。因此,本研究旨在探讨千草方熏洗对KOA软骨中YAP/Smad3信号通路的影响。
材 料 和 方 法
1 材料
II型胶原C端肽(C-telopeptide of type II collagen,CTX-II)和软骨寡聚基质蛋白(cartilage oligomeric matrix protein,COMP)ELISA试剂盒购自Bio-Swamp;TUNEL细胞凋亡原位检测试剂盒购自Roche;抗YAP(ab205270)、高迁移率族蛋白B2(high mobility group protein B2,HMGB2)(ab11973)、Smad3(ab40854)、骨成型蛋白2(bone morphogenetic protein 2,BMP2)(ab14933)、Bax(ab32503)、Bcl-2(ab59348)和β-actin(ab8226)抗体购自Abcam;透明质酸钠(国药准字H10960136)购自山东正大福瑞达制药有限公司;千草方由武汉市中医医院中药药房提供。
2 动物分组及处理
10周龄SPF级雄性SD大鼠32只,体重(300~350)g,购自北京华阜康生物科技股份有限公司,动物合格证编号为11401300043471。动物实验方案通过武汉市第八医院动物伦理委员会批准。大鼠饲养于无菌环境中,分笼饲养,自由获得干净饮用水和商业饲料,温度(23~25) ℃,相对湿度50%左右,12 h光照。饲养1周后,随机分为对照(control)组、造模(model)组、中药(Chinese medicine)组和HA组,每组8只。采用改良Hulth法建立大鼠膝骨关节炎模型,腹腔注射3%戊巴比妥钠(2 mL/kg)麻醉大鼠,无菌条件下切除大鼠右膝内侧半月板及内侧副韧带,术后3 d每日大鼠肌内注射青霉素20 U/d预防感染。
3 主要方法
3.1HA注射 于动物模型制备后的第1周开始关节腔内注射透明质酸钠(0.4 mL/kg),其后每周重复注射1次,共5次(严格无菌操作)。
3.2中药熏洗 于动物模型制备后的第1天开始进行中药熏洗,具体方法为千草方置于蒸发器内,加水至2~2.5 L,加米醋50 mL,药液浓度为10%,接通电源加热,产生蒸汽,温度为40 ℃~45 ℃,将患膝(熏洗部位以膝关节髌骨为中心,上、下各约3 cm)置蒸汽上,每次30 min,每天1次,30 d为一疗程。
3.3取材 所有动物于治疗完成1周后,断颈处死,在无菌条件下立即打开膝关节,以锐利刀片矢状位切取股骨内侧髁及胫骨平台约3 mm厚关节软骨标本,保存于10%多聚甲醛中待测。
3.4HE染色 膝关节标本置于10%多聚甲醛4 ℃固定48 h后,放入20% EDTA液,于4 ℃冰箱内脱钙4周,每3 d换脱钙液1次。然后进行常规石蜡包埋和切片。切片脱蜡脱水后进行常规HE染色。HE染色过程如下,苏木素染核15 min,流水冲洗1 min,静水放置5 min,0.5%伊红染液3 min,流水冲洗。HE切片在光学显微镜下使用双盲法按Mankin’s法对关节软骨评分[10]。
3.5血清指标的检测 所有的动物均于治疗完成1周后,于腹主动脉穿刺取血10 mL,4 ℃密封保存8 h,6 000 r/min 离心15 min,收集血清于EP管,保存于-20 ℃的低温冰箱待测。采用ELISA法测定血清中CTX-II和COMP的水平。
3.6TUNEL染色 膝关节标本置于10%多聚甲醛,4 ℃固定48 h后,放入20% EDTA液于4 ℃冰箱内脱钙4周,每3 d换脱钙液1次。然后进行常规石蜡包埋和切片。切片脱蜡脱水后进行TUNEL染色。TUNEL染色过程如下,蛋白酶K室温处理30 min,0.01 mol/L 柠檬酸缓冲液(pH 6.0)微波炉修复抗原。切片用TUNEL反应混合液处理后,加入DAB溶液显色,最后用苏木精复染核,光学显微镜下观察细胞的凋亡情况。
3.7免疫组化染色 膝关节标本置于10%多聚甲醛, 4 ℃固定48 h后,放入20% EDTA液于4 ℃冰箱内脱钙4周,每3 d换脱钙液1次。然后进行常规石蜡包埋和切片。切片脱蜡脱水后进行免疫组化染色,具体方法为切片脱蜡脱水后烤片3 min,滴加3% H2O2抗原修复,滴加BSA,滴加抗YAP(1∶2 000)和HMGB2(1∶500)的I抗孵育过夜,滴加对应的II抗,加2滴新鲜配制的DAB溶液,苏木素复染,常规脱水,透明,干燥,封片,光学显微镜下观察。
3.8Western blot实验 RIPA裂解液提取膝骨关节软骨总蛋白。NanoDrop 2000测定蛋白含量。以50 μg蛋白上样,电泳后转移至PVDF膜。室温下用含2.5%脱脂奶粉的PBST封闭,加入抗YAP(1∶1 000)、Smad3(1∶3 000)、BMP2(1∶1 000)、Bax(1∶3 000)、Bcl-2(1∶1 000)和β-actin抗体(1∶2 500),4 ℃孵育过夜。加入对应的II抗,室温孵育2 h,ECL法显色。
4 统计学处理
采用统计软件为SPSS 19.0,作图采用GraphPad Prism 5。所有数据均采用均数±标准差(mean±SD)表示,3组及3组以上样本之间采用多因素方差分析进行组间比较,进行SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 组织形态学观察
各组大鼠软骨组织HE染色结果显示,对照组软骨表面光滑,软骨基质着色均匀,为粉色,软骨细胞核为蓝色;各层细胞排列整齐,结构清晰,潮线完整。模型组软骨表面粗糙破损,表层软骨糜烂、剥落;软骨基质着色不均匀,各层细胞排列紊乱,4层结构不清晰。与模型组相比,中药组软骨表面更加光滑,虽然软骨细胞减少,但结构较清晰,软骨基质着色较均匀。HA组软骨细胞亦减少,但结构较为完整和清晰,见图1。
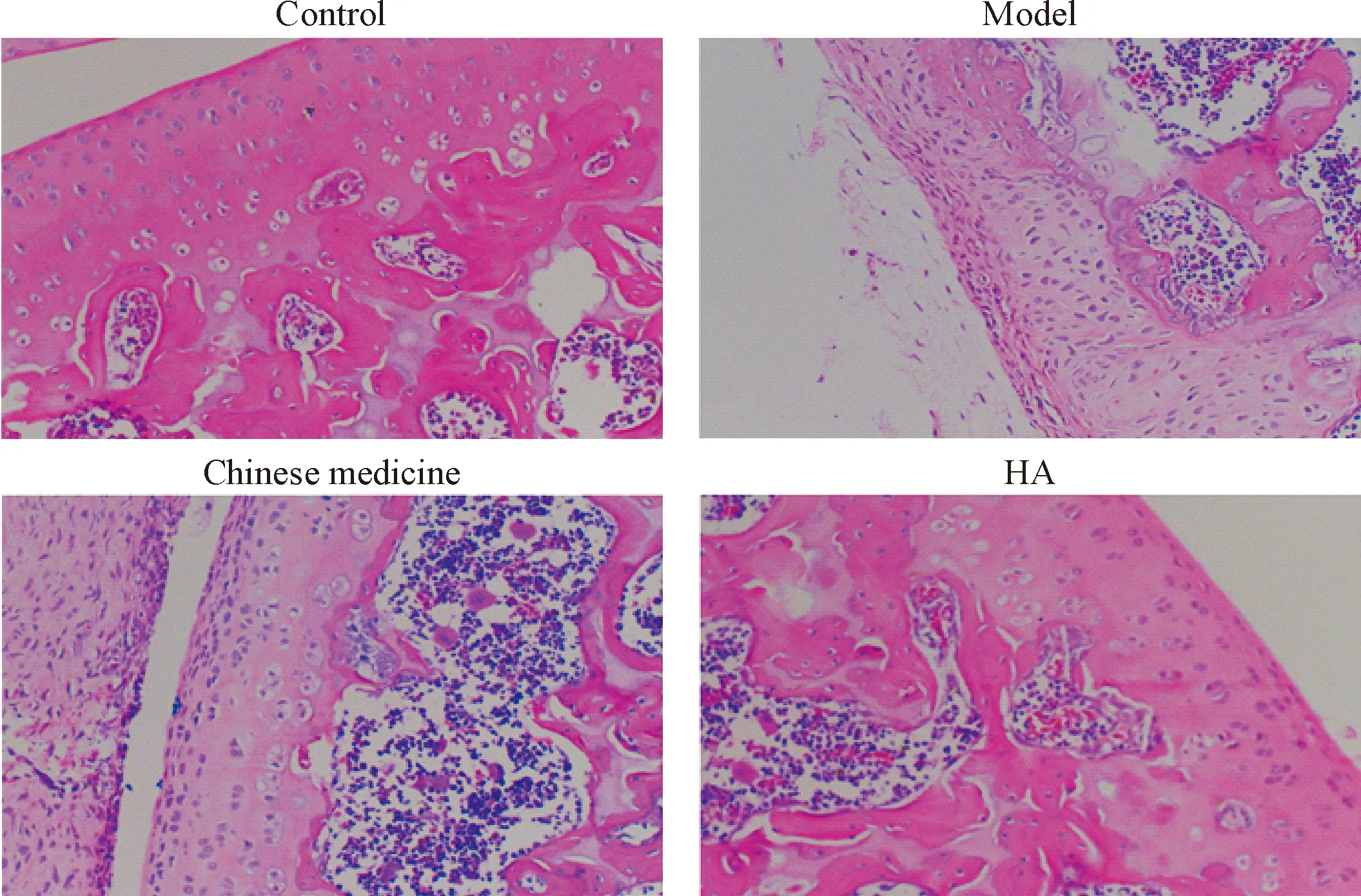
Figure 1.The result of HE staining in cartilage tissues (×200).
图1 软骨组织HE染色结果
2 膝关节软骨组织损伤Mankin’s评分结果
与对照组比较,模型组Mankin’s评分值显著升高(P<0.05);与模型组相比,中药组和HA组Mankin’s评分值显著降低(P<0.05),见图2。
3 中药熏洗对血清指标的影响
ELISA实验结果表明,与对照组相比,模型组血清COMP的表达量显著增加,CTX-II的表达量显著降低(P<0.05);与模型组相比,中药组和HA组血清COMP的表达量显著降低,CTX-II的表达量显著增加(P<0.05),见图3。
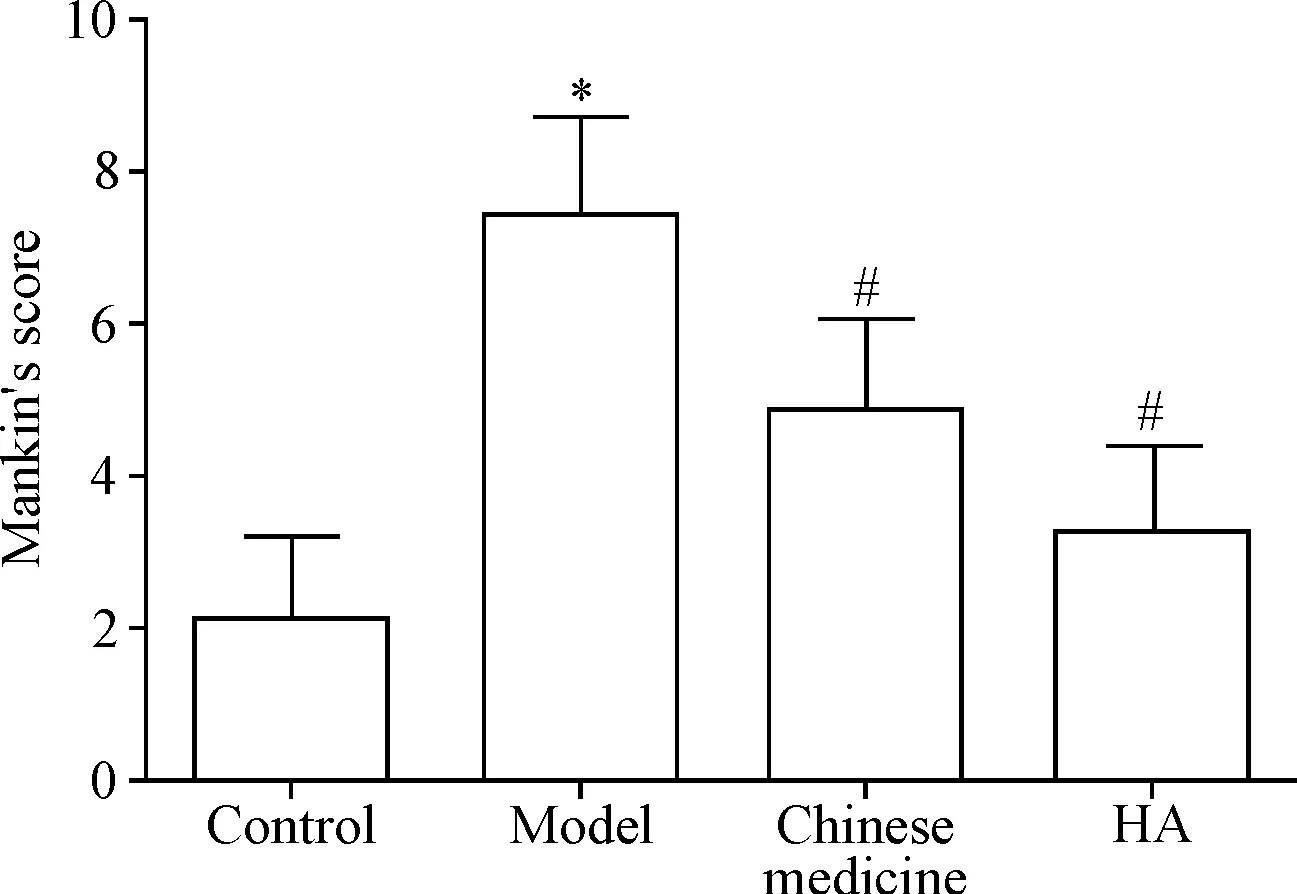
Figure 2.The result of Mankin’s score. Mean±SD.n=8.*P<0.05vscontrol group;#P<0.05vsmodel group.
图2 Mankin’s评分结果
4 中药熏洗对软骨细胞凋亡的影响
TUNEL染色结果显示,对照组软骨细胞无明显凋亡,凋亡率为5.63%±1.16%;与对照组相比,模型组软骨细胞出现大面积的凋亡,凋亡率显著升高至61.35%±3.05%(P<0.01);与模型组相比,中药组(21.74%±1.88%)和HA组(28.13%±2.03%)软骨细胞的凋亡率明显下降(P<0.05),见图4。
5 中药熏洗对YAP和HMGB2表达的影响
软骨组织免疫组化的结果表明,模型组软骨组织YAP表达量低于对照组,采用中药熏洗和HA注射治疗后,YAP的表达量增加(P<0.05),见图5。模型组软骨组织HMGB2表达量低于对照组,采用中药熏洗和HA注射治疗后,HMGB2的表达量升高(P<0.05),见图6。
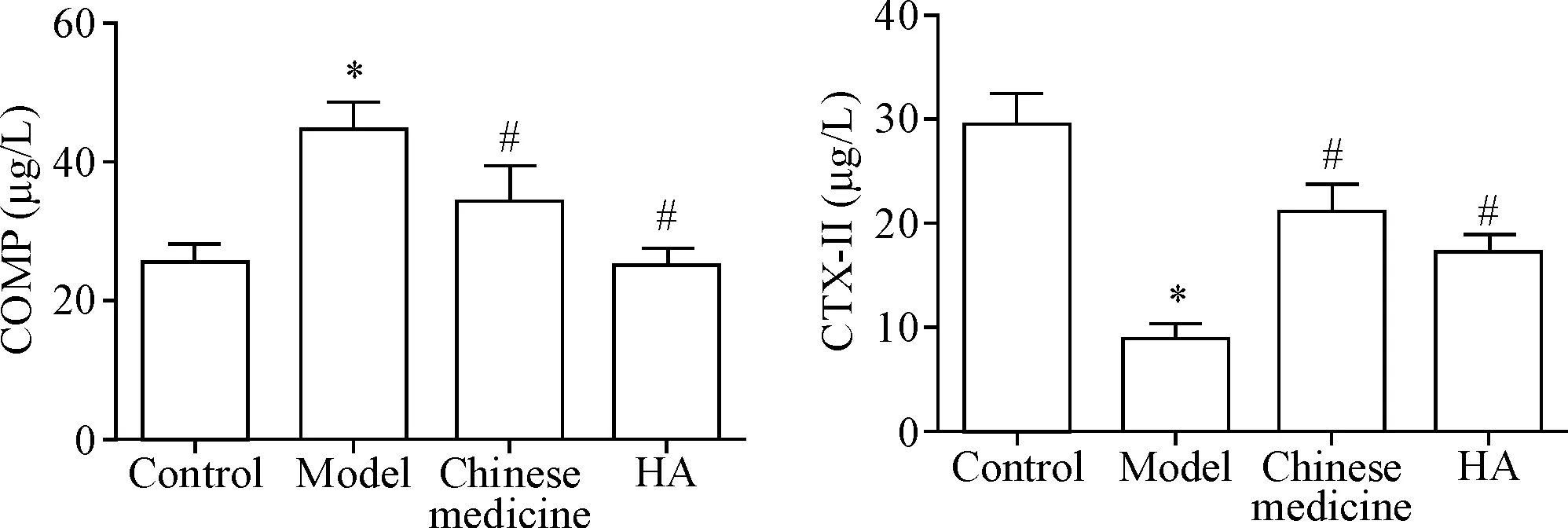
Figure 3.The effect of herbal fumigation on the serum levels of COMP and CTX-II. Mean±SD.n=8.*P<0.05vscontrol group;#P<0.05vsmodel group.
图3 中药熏洗对血清COMP和CTX-II含量的影响
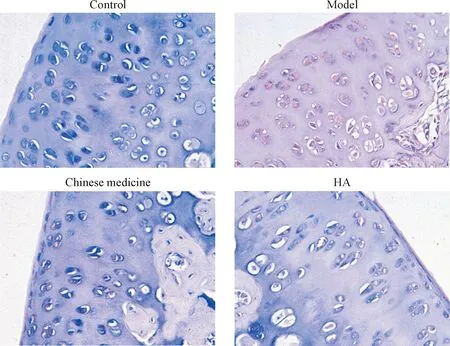
Figure 4.The result of TUNEL staining in cartilage tissues (×200).
图4 软骨组织TUNEL染色结果
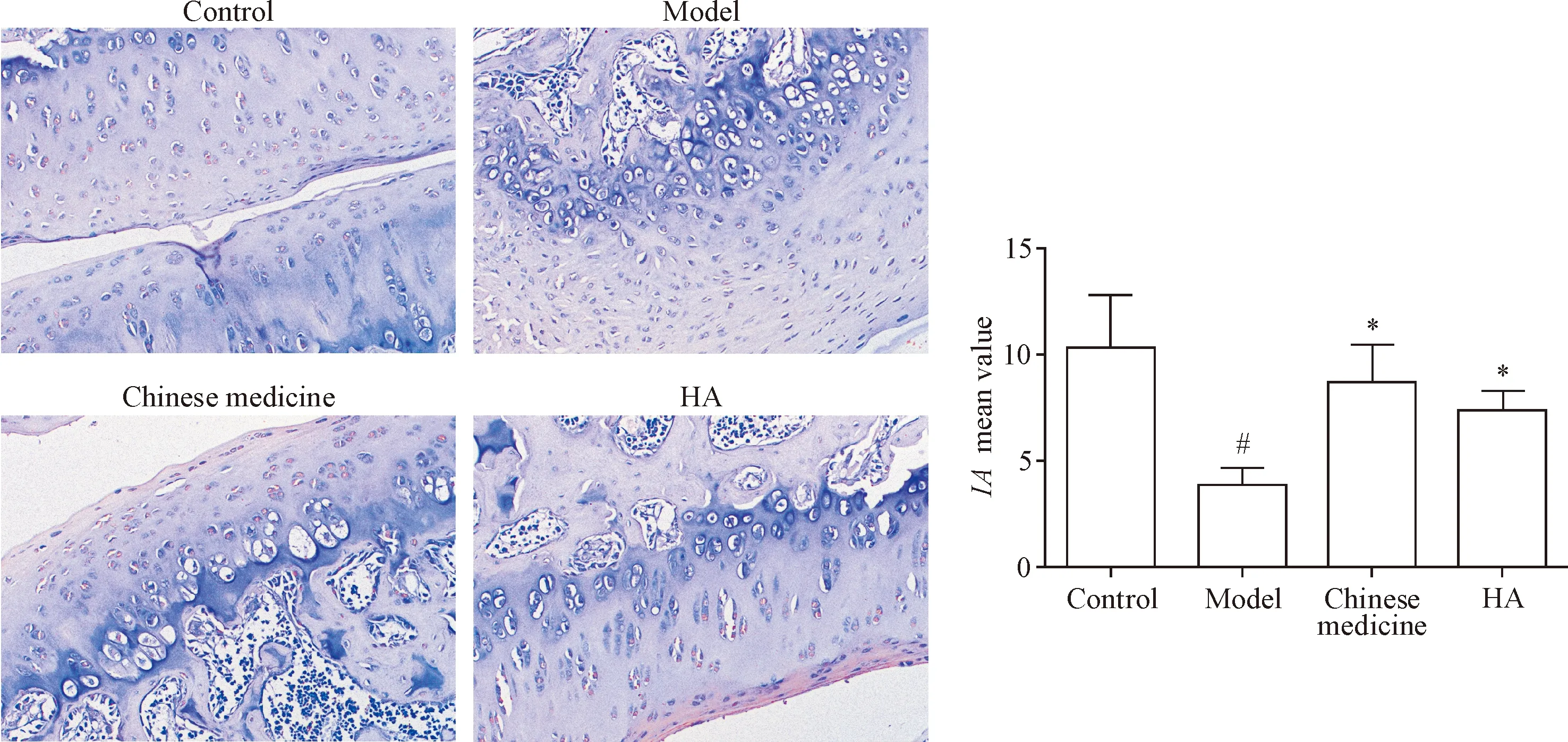
Figure 5.The immunohistochemical results of YAP (×200). Mean±SD.n=3.#P<0.05vscontrol group;*P<0.05vsmodel group.
图5 YAP免疫组化染色结果
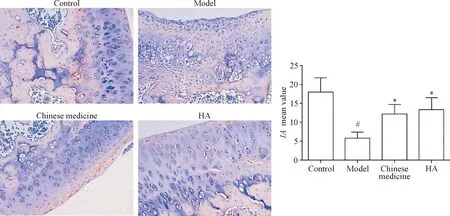
Figure 6.The immunohistochemical result of HMGB2 (×200). Mean±SD.n=3.#P<0.05vscontrol group;*P<0.05vsmodel group.
图6 HMGB2免疫组化染色结果
6 中药熏洗对YAP、Smad3和BMP2蛋白表达量的影响
与对照组相比,模型组BMP2的表达量显著升高(P<0.05);与模型组相比,中药组和HA组BMP2的表达量显著下降(P<0.05)。与对照组相比,模型组YAP和Smad3的表达量显著降低(P<0.05),中药组和HA组YAP和Smad3的表达量显著增加(P<0.05),见图7。
7 中药熏洗对凋亡信号通路的影响
与对照组相比,模型组Bax的表达量显著增加,Bcl-2的表达量显著减少(P<0.05);与模型组相比,中药组和HA组Bax的表达量显著下降,Bcl-2的表达量显著增加(P<0.05),见图7。
讨 论
“痹者,闭也”、“不通则痛”,根据我们在临床的多年观察,我们认为KOA属本虚标实之症,正如《济生方·痹》所云:“皆因体虚,腆理空虚,感受风寒湿气而成痹也”,《素问·痹证论》曰:“风寒湿三气杂至,合而为痹也,其风气胜者为行痹,寒气胜者为痛痹,湿气胜者为着痹”。根据临床症状我们认为其标实为主要症状,根据“急则治其标,缓则治其本”应首先解除患者标实之病因——风寒湿邪。临床中的辨证分型主要集中在风寒湿阻、气滞血淤、痰淤互结、痰湿阻络和肝肾亏虚等证型,根据《景岳全书·本草篇》“除风湿,行血脉,壮筋骨……治骨节四肢拘挛,两脚痹痛”,在治疗上采用散寒去湿、发汗解表、疏通膜理、调和气血、舒经活络的“千草方”局部薰洗,达到缓解膝部疼痛、恢复膝关节的活动功能,抑制退行性病变进一步发展的目的。我们的前期研究结果表明,关节内注射透明质酸联合千草方熏洗能够缓解关节软骨的破坏并降低炎症[6],但千草方熏洗缓解KOA的相关分子机制还不甚了解。因此,本研究构建了SD大鼠KOA模型,并用关节腔内注射HA和千草方熏洗分别对KOA大鼠进行了治疗,旨在研究千草方熏洗对YAP/Smad3通路的影响。
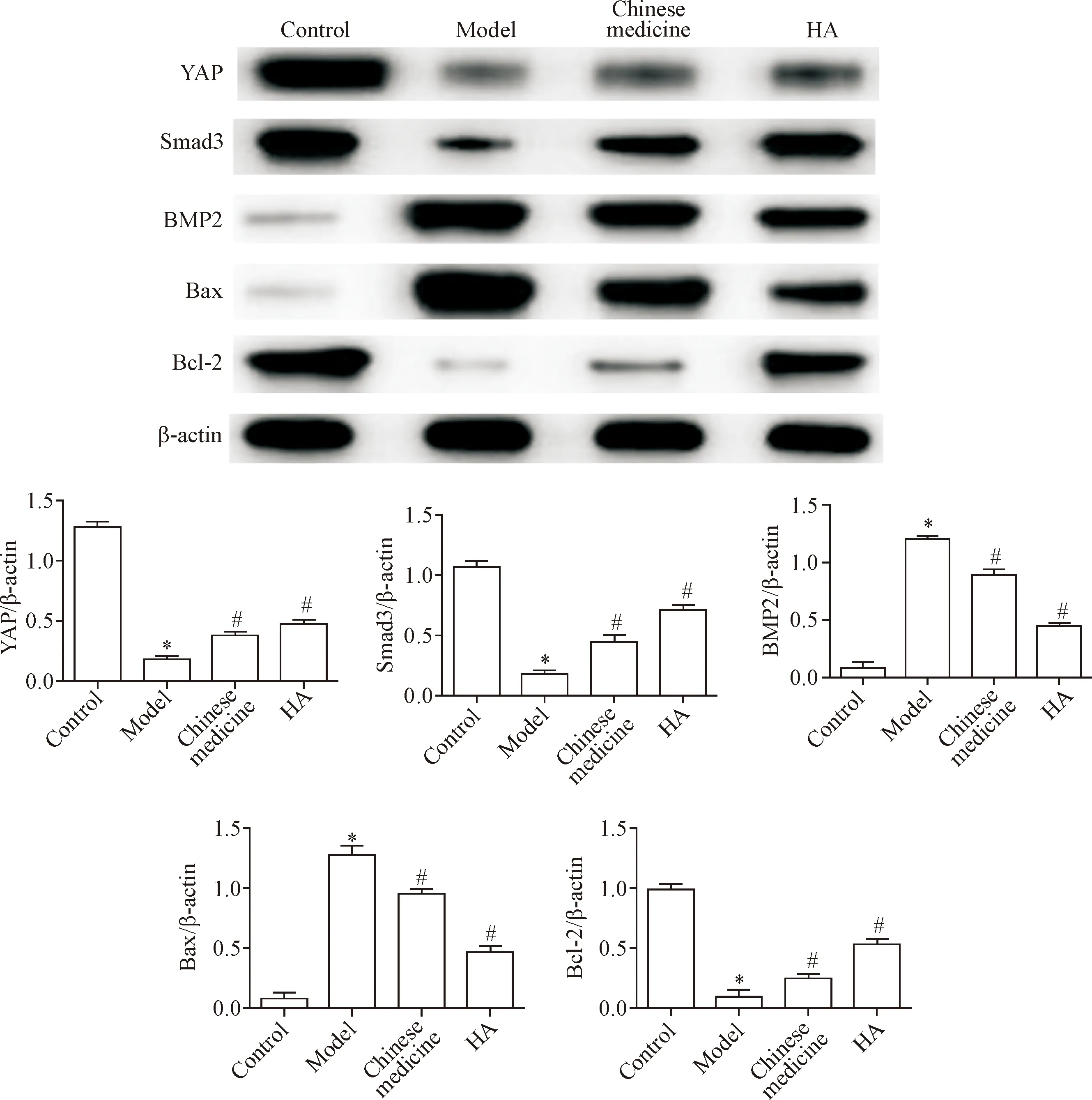
Figure 7.Relative protein expression of YAP, Smad3, BMP2, Bax and Bcl-2 in each group was detected by Western blot. Mean±SD.n=8.*P<0.05vscontrol group;#P<0.05vsmodel group.
图7 Western blot检测各组软骨组织中YAP、Smad3、BMP2、Bax和Bcl-2蛋白的表达
KOA的主要病理表现为关节软骨变性、脱落和炎症因子沉积等诸多改变[11]。尿液和血液中CTX-II和COMP浓度是反映骨关节炎软骨损伤的有效标志物[12-13]。本研究中,HE染色和Markin’s评分及血清中CTX-II和COMP含量的结果表明,本研究成功构建了KOA模型。通过关节腔内注射HA或千草方熏洗治疗后,能够缓解软骨组织结构的破坏和炎症浸润等。为了进一步研究千草方熏洗治疗KOA的分子机制,我们测定了各组软骨细胞的凋亡情况,检测了软骨组织中HMGB2、YAP、Smad3、BMP2、Bax和Bcl-2的表达。在正常关节软骨中细胞程序性死亡的发生率很低,而在KOA关节软骨中细胞程序性死亡的发生明显增高[14]。在本研究中,KOA模型组软骨细胞呈现出严重的凋亡,而HA组和中药组的软骨细胞凋亡率与模型组比较显著降低。同时,Westem blot结果表明,与模型组比较,促凋亡蛋白Bax的表达量在HA组和中药组中显著下调,抗凋亡蛋白Bcl-2的表达量在HA组和中药组中显著上调,说明进行千草方熏洗能有效抑制KOA软骨细胞的凋亡。HMGB2属于HMGB家族,研究发现HMGB2在骨性关节炎软骨中处于低表达的状态[15],而且HMGB2作为核心因子对维持软骨细胞分泌表征和内环境的稳定性起着积极作用[16]。本研究结果与上述研究发现一致,模型组HMGB2的表达量下降,而HA组和中药组HMGB2的表达量增加,说明千草方能够通过促进HMGB2高表达从而发挥维持软骨稳定性的作用。BMP2属于BMP家族,具有多向分化的潜能,其促进软骨向成骨分化的能力尤其强大[17]。本研究中,模型组BMP2表达量增加而HA组和中药组HMGB2的表达量下降,说明千草方能够通过抑制BMP2发挥维持软骨稳定性的作用。本研究中,模型组YAP和Smad3的表达量下降而HA组和中药组YAP和Smad3的表达量增加,说明千草方能够通过促进YAP/Smad3高表达促进软骨细胞的增殖,并抑制了软骨细胞凋亡和发生肥大。大量研究表明,关节腔内注射HA具有抗炎、保护软骨和改善关节功能等作用[18]。本次研究的结果显示千草方熏洗和关节腔内注射HA,都抑制了软骨细胞的凋亡,维持软骨稳定性。由此推测,千草方熏洗对膝骨关节炎的治疗具有与关节腔内注射HA相似的效果。
综上所述,千草方熏洗能够通过YAP/Smad3信号通路缓解KOA,抑制软骨细胞的凋亡和软骨组织结构的破坏,为千草方治疗KOA提供分子基础。

