BLP耐受通过上调MARCO增强巨噬细胞的吞噬能力*
习大林,项 静,蔡军伟,赵舒祺,吉晶晶,李 月,苏 婷,姜 勇,刘靖华
(南方医科大学基础医学院,广东省蛋白质组学重点实验室,广东 广州 510515)
细菌脂蛋白(bacterial lipoprotein,BLP)是广泛存在于革兰氏阴性和阳性细菌外膜的脂蛋白,可由生长或裂解的细菌释放。既往研究发现,给予动物小剂量BLP后,再给予大剂量或者致死剂量的BLP时,能大大降低动物的死亡率,这种现象被称为BLP耐受[1]。研究发现,BLP耐受不仅能减少致死剂量的BLP引起的动物死亡,而且能防御大剂量的细菌脂多糖(lipopolysaccharide,LPS)引起的内毒素休克,即所谓的交叉耐受。更重要的是,BLP耐受还能降低动物感染细菌或者盲肠结扎穿刺所引起的死亡率[1]。BLP耐受是生物在长期进化过程中形成的一种保护性调节机制,目的是避免机体对BLP或者内毒素再次刺激过度反应而造成损伤,是机体防御机制的重要组成部分。因此,探讨BLP耐受保护作用的机制不仅有助于了解机体在抗感染过程中的适应性应答机制,加深我们对脓毒性休克发生机制的认识,而且还有可能为脓毒性休克的防治提供新的思路。
目前,有关BLP耐受的机制尚不完全清楚。研究发现,在机体(细胞)对BLP的耐受过程中,其突出表现之一为BLP耐受机体(细胞)对病原菌的吞噬和清除能力显著增强[2]。吞噬细胞(例如巨噬细胞)对细菌的清除包括吞噬体形成、吞噬溶酶体内的酶对细菌的杀灭和消化等一系列过程,其中吞噬相关受体介导的对病原微生物的吞噬是关键环节。细胞表面吞噬相关受体主要包括调理素依赖性受体(如Fc受体和补体受体)以及调理素非依赖受体(如清道夫家族受体)[3-4]。Fc受体和补体受体在BLP耐受巨噬细胞中吞噬作用增强已得到证明[1],但是胶原样结构巨噬细胞受体(macrophage receptor with collagenous structure,MARCO)是否也参与了BLP耐受的过程尚不清楚。本研究利用骨髓来源的巨噬细胞(bone marrow derive macrophages,BMDMs)为细胞模型,探讨了MARCO在BLP耐受巨噬细胞吞噬能力增强过程中的作用。
材 料 和 方 法
1 主要试剂
TRIzol总RNA提取试剂和LipofectamineTM3000转染试剂购自Thermo Fisher;荧光定量PCR逆转录试剂盒(FSQ-101)及SYBR Green(QPK-201)购自TOYOBO;荧光定量PCR引物由华大基因设计合成;小干扰RNA由吉玛基因公司(中国)合成; 小鼠MARCO-APC抗体购自R&D;MARCO(IBL-12)和抗β-actin抗体购自Santa Cruz;DMEM培养基、胎牛血清(fetal bovine serum,FBS)和OPTI-MEM培养基购自Gibco。
2 动物、细胞与细菌
SPF级C57BL/6小鼠,8~10周龄,18~20 g,由南方医科大学实验动物中心提供,许可证号为SCXK(粤)2016-0041。大肠杆菌(E.coli,K12)菌株和转染了 pET-14b-GFP质粒的大肠杆菌(GFP-E.coli)由本室保存。L929细胞购自中国科学院细胞研究所(上海)。
3 主要方法
3.1BMDMs的分化及培养 BMDMs的分化及培养参考文献[5]方法进行。将L929细胞用含10% FBS的DMEM培养基培养5~7 d,收集细胞培养上清,用0.22 μm滤器过滤后与含有20% FBS的DMEM按体积比1 ∶4比例混匀,配制成BMDMs完全培养基,备用。取C57BL/6小鼠处死,暴露并分离股骨和胫骨,用DMEM冲洗骨髓腔,300×g离心10 min后收集骨髓沉淀;用完全培养基充分吹打骨髓沉淀使其分散成单细胞悬液,平铺至培养瓶中,放于37 ℃、 5% CO2培养箱中培养7 d,获得分化成熟的BMDMs。取1×105个BMDMs加入巨噬细胞分子标志F4/80抗体(1 ∶10)并在室温下标记30 min,再与FITC荧光标记Ⅱ抗避光孵育30 min,流式细胞仪检测F4/80抗体标记的阳性细胞比例大于96%。
3.2BLP耐受BMDMs的制备 取成熟的BMDMs细胞,给予0.1 μg/L的BLP处理24 h,该部分细胞为 BLP耐受的 BMDMs;未经 BLP预处理的即为非耐受BMDMs(naive BMDMs)。
3.3吞菌实验 取naive或BLP耐受BMDMs,按细胞与细菌1 ∶ 50的比例加入GFP标记的大肠杆菌,感染30 min后,DPBS洗3次,洗去细胞外细菌,收集细胞用荧光显微镜直接观察并拍照,或者用流式细胞仪检测细胞吞菌情况。
3.4qPCR TRIzol法提取总RNA后,逆转录成为cDNA,分别加入MARCO及β-actin引物进行扩增,使用荧光定量PCR仪记录扩增循环数,通过2-ΔΔCt法进行相对定量分析。目的基因的引物序列见表1。
表1 qPCR引物序列
3.5流式细胞术 BMDMs感染细菌30 min后,用0.25 %胰酶消化细胞,800×g离心5 min收集细胞。加入MARCO-APC荧光抗体,避光孵育15 min后,离心弃上清,DPBS重悬,用流式细胞术进行检测。GFP的激发波长为488 nm,发射波长为507 nm;APC荧光的激发波长为630 nm,发射波长为660 nm。
3.6MARCO小干扰RNA(small interfering RNA,siRNA)实验 本实验参照Lipofectamine 3000转染试剂说明书进行。取1×106BMDMs与2 μg 靶向MARCO的siRNA(siMARCO)或对照RNA(scramble siRNA,Scr RNA)混合,加入6 μL lipofectamine 3000,干扰24 h后用荧光定量PCR检测干扰效率。siMARCO的序列如下:sense: 5’-GCAUGGCAUGCAUGGC-CAUTT-3’,antisense: 5’-CTTCTTGGGCACTGGAT-CAT-3’;ScrRNA: sence: 5’-GCGAGCACAGCTTCTTT-GC-3’,antisense: 5’-GCGCAGCGATATCGTCATC-3’。MARCO的干扰效率分别用qPCR(mRNA表达水平)及流式细胞术(蛋白表达水平)检测,具体方法同前。
3.7细胞免疫荧光 BMDM与细菌共孵育30 min后,用DPBS洗3次,4%多聚甲醛固定10 min,之后用0.1 % Triton X-100处理10 min,并用封闭液封闭1 h;然后加入MARCO抗体室温孵育2 h;用PBS 洗3遍后,用IF555标记的山羊抗大鼠IgG(1 ∶500)在室温下进行染色,DAPI复染细胞核,最后在共聚焦显微镜下观察并拍照。GFP的激发波长为488 nm,发射波长为507 nm;IF555 荧光激发波长为550 nm,发射波长为570 nm。
4 统计学处理
采用SPSS 20.0软件进行分析。计量数据以均数±标准差(mean±SD)表示,在满足方差齐性的条件下,2组间比较使用非配对t检验,以P<0.05为差异有统计学意义。
结 果
1 BLP 耐受 BMDMs 吞噬细菌的能力较naive细胞明显增强
图1A是实验流程及干预示意图,BLP耐受(BLP-tolerized)组给予BMDMs细胞0.1 μg/L BLP预处理24 h,再给予GFP标记的大肠杆菌感染;naive组的BMDMs未经BLP预处理。无论是BLP 耐受组BMDMs还是naive 细胞,给予细菌感染30 min后,共聚焦显微镜下可见细胞胞浆内均有绿色荧光,且BLP 耐受组BMDMs的绿色荧光明显多于naive 组细胞,见图1B;流式细胞术检测细胞吞菌结果显示,BLP耐受组较naive组峰值右移,中位荧光强度(median fluorescence intensity,MFI)明显升高(P<0.05),见图1C,提示与naive组相比,BLP耐受组BMDMs吞噬细菌能力明显增强。
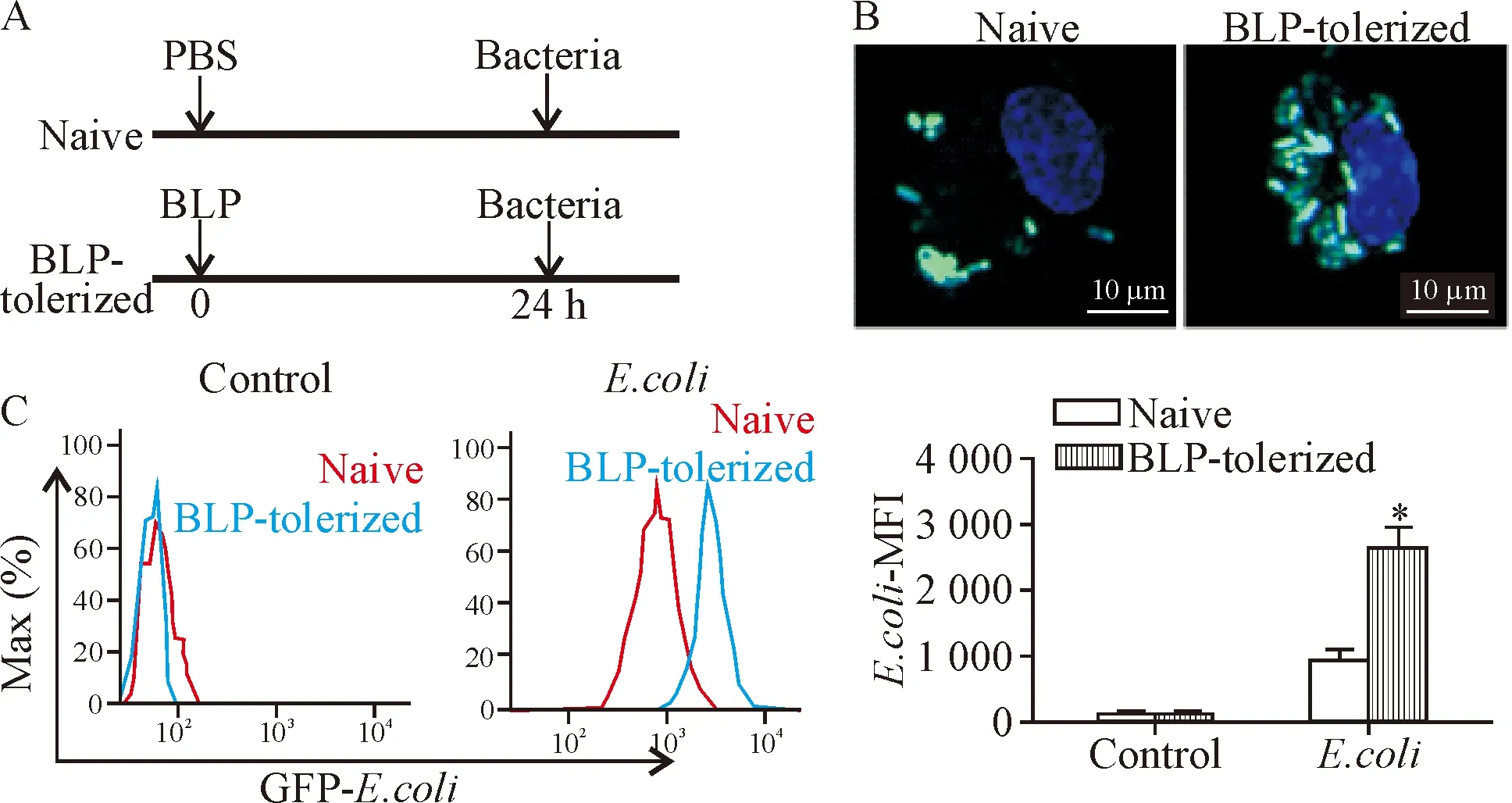
Figure 1.The effect of BLP tolerance on phagocytosis of macrophage. Mean±SD.n=3.*P<0.05vsnaive BMDMs.
图1 BLP耐受对巨噬细胞吞噬能力的影响
2 BLP耐受上调巨噬细胞MARCO的表达
qPCR结果显示,在静息状态时naive组BMDMs中MARCO的mRNA转录水平很低,3次定量PCR的Ct值均值为29.37; BLP耐受组BMDMs的MARCO mRNA转录增加,在加入BLP 24 h时是naive细胞的890倍;与naive组相比,BLP耐受巨噬细胞MARCO的mRNA水平显著升高(P<0.05); 给予大肠杆菌刺激30 min后,2组巨噬细胞中MARCO mRNA的表达均较未刺激时进一步升高,BLP耐受组仍显著高于naive组(P<0.05),见图2A。流式细胞术检测结果显示,BLP耐受能显著上调巨噬细胞膜表面MARCO的蛋白表达水平(P<0.05),且在大肠杆菌刺激后仍维持高表达并显著高于naive组(P<0.05),见图2B。提示BLP耐受在mRNA和蛋白表达水平均能明显上调MARCO分子的表达。
3 流式细胞术检测下调MARCO的表达对 BLP耐受巨噬细胞吞噬能力的影响
qPCR检测显示,siMARCO组BMDMs的 mRNA干扰效率超过70%(P<0.05),见图3A;流式细胞术结果显示,siMARCO组BMDMs的MARCO蛋白表达水平较scrRNA组明显降低(P<0.05),见图3B,提示RNAi效果理想。流式结果进一步显示,干扰MARCO表达后,无论是naive还是BLP耐受组BMDMs吞噬细菌的量都有减少,其中对BLP耐受组的吞菌影响比较显著(P<0.05),见图3C。
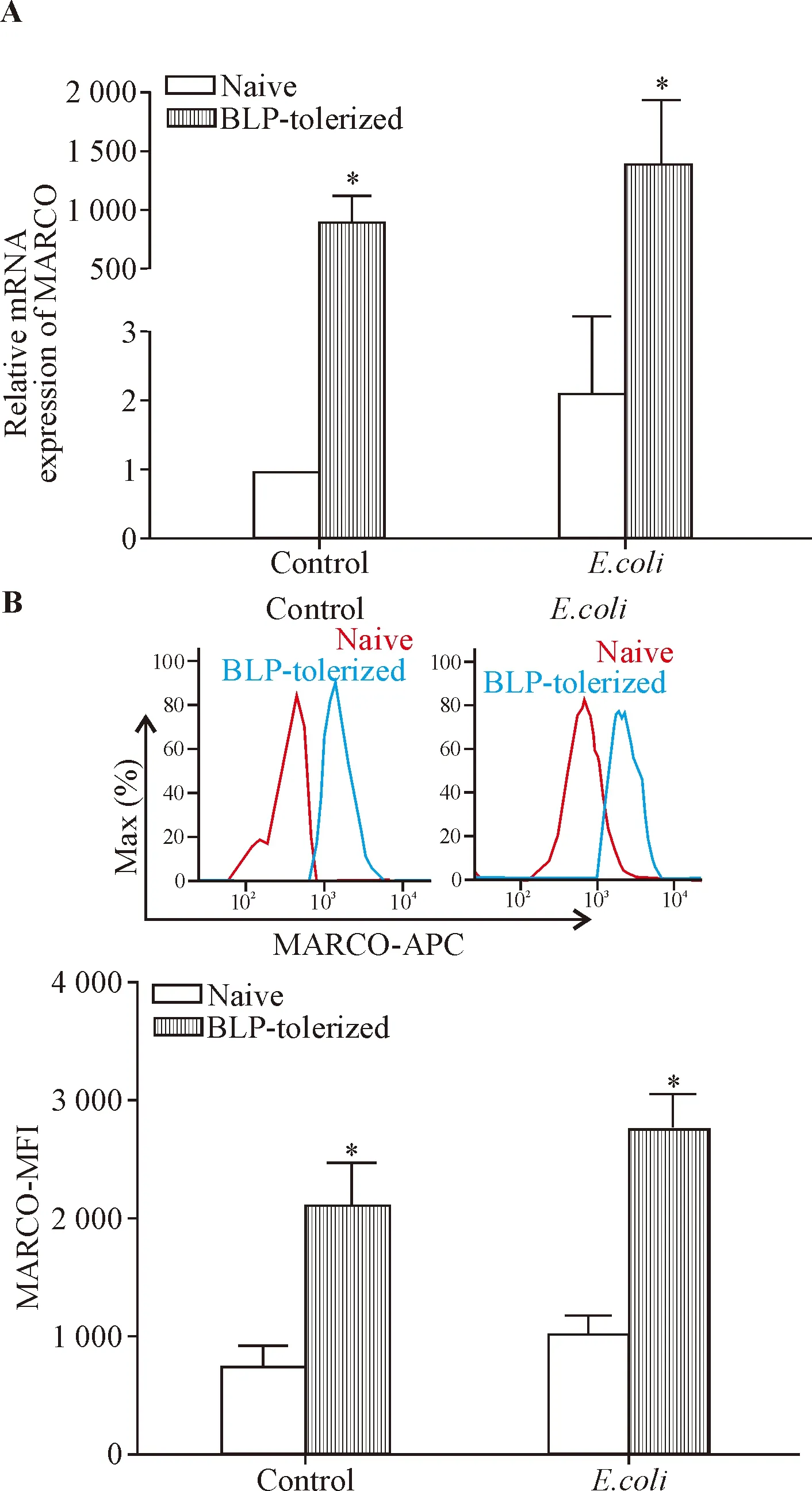
Figure 2.The effect of BLP tolerance on MARCO expression in the BMDMs. Mean±SD.n=3.*P<0.05vsnaive BMDMs.
图2 BLP耐受对巨噬细胞MARCO表达的影响
4 荧光显微镜观察下调MARCO的表达对 BLP耐受巨噬细胞吞噬能力的影响
共聚焦显微镜观察结果显示,静息状态的naive细胞胞浆中有微弱的红色荧光,表明MARCO的表达量很低;细菌刺激30 min后代表MARCO的红色荧光增强不明显;BLP耐受BMDMs在未受细菌刺激时,胞浆及胞膜位置有较强的红色荧光,表明MARCO在BLP耐受BMDMs的表达较naive显著增强;细菌刺激后BLP耐受BMDMs的红色荧光仍然较naive组明显增强。干扰MARCO表达后,无论是naive还是BLP耐受BMDMs细胞的绿色荧光均明显减弱,以BLP耐受细胞绿色荧光降低较为显著,见图4,提示下调MARCO表达减弱BLP耐受细胞的吞菌能力。
讨 论
清道夫受体是一类表达于巨噬细胞、树突状细胞和内皮细胞等细胞表面的跨膜糖蛋白分子[6]。近年来发现,清道夫受体除了吞噬脂蛋白参与脂质调节外,还作为一种模式识别受体,通过识别多种微生物结构,即病原相关分子模式,包括LPS、磷壁酸(lipoteichoic acid,LTA)及细菌CpG DNA等,在固有免疫中发挥重要作用[7-9]。目前已鉴定的清道夫受体有8类,分别用A类~I类表示(C类除外)。MARCO也被称作SCARA2或SR-A2,是A类清道夫受体的一种,在巨噬细胞的吞噬中发挥重要作用。与该家族大多数成员不同,MARCO在静息状态下仅表达于脾脏和淋巴结等组织的巨噬细胞,但多种病原体可通过TLR信号通路迅速上调MARCO水平,诱导大多数组织巨噬细胞MARCO表达增加,例如肝脏枯否细胞等[10-12]。我们发现,静息状态的BMDMs中MARCO的mRNA水平很低;当受到BLP刺激后,MARCO的mRNA水平增加,在BLP刺激24 h时是naive细胞的890倍;与此同时细胞膜表面的MARCO表达也明显增加,与以往的报道一致。关于BLP上调MARCO的具体机制目前尚不清楚。以往的研究表明,在感染状态下,MARCO的上调主要是通过MyD88信号通路介导的[13];在树突状细胞中,这个过程还可能与p38丝裂原激活的蛋白激酶相关[14]。研究发现LPS或LTA耐受的巨噬细胞中MARCO的上调依赖于组蛋白第四位赖氨酸的三甲基化修饰,即H3K4me3参与了固有免疫耐受中MARCO蛋白增加的调控过程[15]。此外,研究发现疟原虫感染可通过TLR2信号通路,增加H3K4me3,出现类似于固有免疫耐受的表现[16]。BLP作为一种病原体相关分子模式,主要通过TLR2启动内源性免疫应答,因而推测BLP耐受上调MARCO可能是与TLR2信号通路活化、组蛋白修饰增加相关。
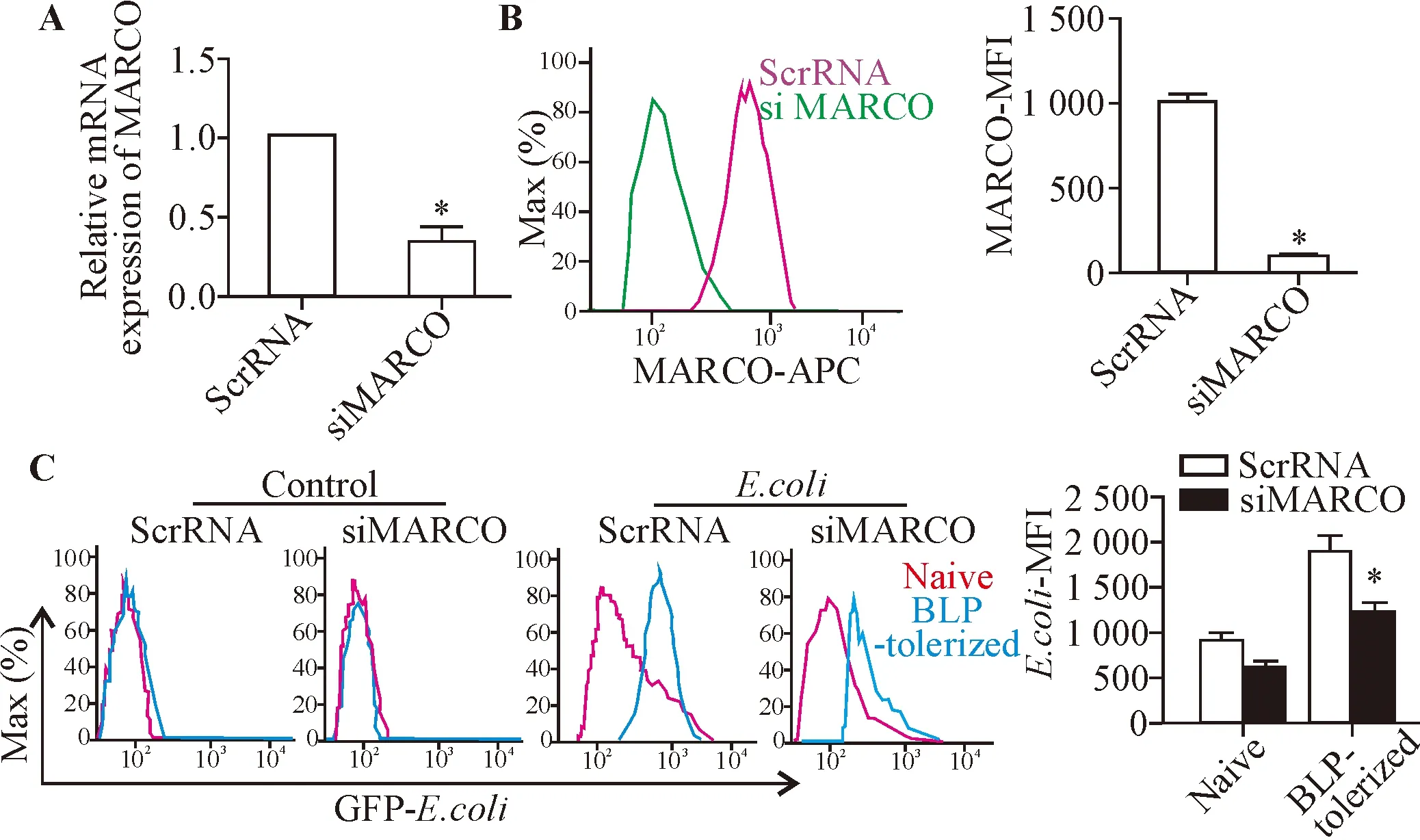
Figure 3.The effect of silencing MARCO on phagocytosis of BLP tolerized BMDMs.Mean±SD.n=3.*P<0.05vsscrRNA group.
图3 干扰MARCO表达对 BLP耐受巨噬细胞吞噬能力的影响

Figure 4.The effect of MARCO doion-regulation on the phagocytosis of BMDMs exhibited by fluorescence microscopy. Red: MARCO; green: GFP-E.coli; blue: DAPI.
图4 荧光显微镜检测下调MARCO表达对巨噬细胞吞菌能力的影响
以往的研究表明,MARCO参与了机体对抗细菌感染的过程。例如,MARCO基因敲除小鼠较野生型小鼠对肺炎链球菌感染抵抗力明显下降[17];在斑马鱼的研究中发现,MARCO可显著促进巨噬细胞对细菌的内吞和清除[18];本研究用原代的巨噬细胞BMDMs证明,MARCO与巨噬细胞吞噬细菌的能力有关,因为BLP耐受时MARCO表达水平上调,同时对大肠杆菌的吞噬能力增强,而敲减MARCO表达后,这种增强的吞噬作用减弱,提示BLP耐受增强巨噬细胞吞噬能力依赖于MARCO的表达水平。MARCO表达后如何促进巨噬细胞的吞噬,其机制尚不完全清楚。
吞噬作用涉及复杂的过程,包括细菌的识别和黏着、吞噬杯形成和吞噬体的闭合,这些都涉及细胞骨架的重构。有研究发现,肺泡巨噬细胞通过其表面的MARCO识别并结合细菌,启动细胞骨架重构,进而上调细胞表面MARCO蛋白的表达和细菌吞噬能力[19]。进一步研究证实Rac1-GTP参与调控了MARCO的信号转导并激活肌动蛋白相关蛋白2/3复合体,从而诱导一系列吞噬细菌所必需的行为,包括纤维状肌动蛋白(F-actin)的聚合、丝状伪足的形成以及细胞表面MARCO蛋白表达的增加[19]。然而,从老年鼠体内分离出的肺泡巨噬细胞表现出Rac1 mRNA和蛋白低表达,导致Rac1-GTP水平、肌动蛋白相关蛋白2/3复合体水平的降低以及随之而来的纤维状肌动蛋白的聚合、丝状伪足的形成以及细胞表面MARCO蛋白表达减弱,老年肺泡巨噬细胞的细菌吞噬能力也因此下降。值得注意的是,该研究认为MARCO在巨噬细胞表达与F-actin聚合诱导的细胞骨架重排有关,后者促进MARCO的表达,反过来增强肺巨噬细胞吞噬大肠杆菌的能力;而在我们的研究中,BLP预处理24 h就能大大增加BMDMs细胞表面MARCO的表达,细菌刺激后MARCO进一步增加并不明显;MARCO蛋白表达变化与其mRNA转录变化一致,提示BLP耐受巨噬细胞MARCO在细胞表面的表达可能与转录增强有关。但是细菌感染后MARCO在细胞膜表面的表达是否与F-actin聚合及丝状伪足的形成有关,需要进一步实验探讨。

