白藜芦醇对慢性脑缺血大鼠认知损伤和海马MMP-9和TIMP-1表达的影响研究
张跃奇,王 媛,张志强,胡 敏,张桂青△
(1.新疆医科大学第五附属医院临床心理科,乌鲁木齐,830011;2.乌鲁木齐市第四人民医院精神一科,乌鲁木齐,830002;3.石河子大学医学院第一附属医院康复心理科,新疆石河子,832000)
慢性脑缺血是指各种原因导致的慢性脑供血不足、低灌注现象,临床上主要症状为慢性进展性的认知功能障碍[1]。慢性脑缺血参与了临床多发脑血管病(如血管性痴呆、阿尔兹海默病等)的炎性改变、氧化应激、细胞毒性反应等共同病理过程[2-3]。近年来,白藜芦醇(resveratrol,RES)的神经药理作用研究成为热点。既往研究发现,RES在慢性脑缺血的神经保护、抗神经细胞凋亡方面具有一定的积极作用[4-6]。LIU等[7]研究发现,RES预防性给药能改善抑郁障碍大鼠的学习记忆能力,但并未阐明其病理机制。目前研究已经证明,基质金属蛋白酶(matrix metalloproteinases,MMPs)参与降解细胞外基质等病理生理过程,其活性主要由酶原活化过程和基质金属蛋白酶抑制剂(tissue inhibitors of metalloproteinases,TIMPs)调节[8-9]。本研究将采用双侧颈动脉闭塞(bilateral common carotid artery occlusion,BCCA)法建立慢性脑缺血大鼠模型,研究给予不同剂量RES对其认知功能损伤和海马区基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)及基质金属蛋白酶抑制剂-1(tissue inhibitors of metalloproteinase-1,TIMP-1)表达的影响,探讨RES保护认知功能的可能机制。
1 材料与方法
1.1材料来源 32只雄性SPF级6周龄Wistar大鼠,体质量(210±20)g,新疆医科大学医学实验动物中心[许可证号:SCXK(新)2003-0001]提供,经糖水喜好实验筛查及一般体检无异常发现。分为4组:假手术组(Sham组,8只)、模型组[双侧颈动脉闭塞(BCCA)组,8只]、20 mg·kg-1·d-1RES组(RES-L组,8只)和40 mg·kg-1·d-1RES组(RES-H组,8只)。分组后精心饲养于恒温恒湿的标准化动物房内。在实验过程中严格遵守新疆医科大学实验动物管理条例及管理方法,本实验经过学院动物伦理委员会审批通过。
1.2慢性脑缺血大鼠模型制备 大鼠适应环境1周后进行实验。在实验第1天采用国际惯用的BCCA法建立慢性脑缺血大鼠模型。大鼠建模前8~10 h禁食不禁水。用10%水合氯醛(3 mL/kg)腹腔麻醉后,将大鼠仰卧位固定于恒温实验台,暴露颈部皮肤后行正中纵向切口,钝性分离组织,充分暴露双侧颈总动脉,采用双重结扎法结扎其远心端和近心端以阻断血流。后用青霉素进行局部冲洗,逐层缝合皮肤。操作全程无菌操作。Sham组操作基本相同,只是不进行双侧颈总动脉双重结扎。待大鼠苏醒后放回原笼饲养。
1.3RES给药方法 将RES(美国Sigma公司)溶解于无水乙醇,并用0.5%羟甲基纤维素钠(CMC)溶液稀释。RES-L组给予20 mg·kg-1·d-1腹腔注射,RES-H组给予40 mg·kg-1·d-1腹腔注射。Sham组和BCCA组注射0.5%CMC溶液。实验第1~42天均不间断给药。
1.4认知功能评估
1.4.1旷场实验(open field,OF) 于实验第35天行旷场实验。旷场实验箱置于光线舒适的安静实验室内,大鼠逐一放入箱内适应环境30 s,然后通过正上方红外摄像头记录10 min穿格轨迹和站立行为。为避免上只大鼠气味产生干扰,每只大鼠实验前需用医用乙醇彻底清洁并干燥实验箱。
1.4.2Morris水迷宫实验 于实验第36~41天行Morris水迷宫实验。水迷宫置于光线舒适的安静实验室内,水温(22±2)℃。通过正上方红外摄像头记录大鼠运动轨迹、上台潜伏期和穿格次数等指标。其中前5 d评估定位航行能力,第6天评估空间探索能力。
1.5RT-PCR反应检测海马MMP-9 mRNA和TIMP-1 mRNA表达
1.5.1海马组织总RNA提取 于实验第42天对4组大鼠行心脏灌注取脑,用预冷的PBS溶液冲洗后于冰上快速分离海马组织,之后用超声粉碎机将组织粉碎,称取0.04 g加入预冷的Trizol试剂冰浴研磨,收集裂解液加入200 μL氯仿振荡混匀,静置10 min后高速低温离心10 min,取上清液提取总RNA。用紫外分光光度计测总RNA浓度。

图1 旷场实验各组大鼠运动轨迹
1.5.2RT-PCR扩增 将提取的总RNA使用TaKaRa反转录试剂盒合成cDNA,稀释后于-20 ℃保存备用。PCR引物序列见表1。PCR引物由上海生工生物工程技术服务有限公司提供,按标准操作配成浓度5 μmol/L,4 ℃保存备用。建立25 μL反应体系(冰上操作)进行RT-PCR扩增:95 ℃预变性10 min后,按顺序95 ℃变性15 s,60 ℃退火和延伸1 min,共扩增40个循环。反应结束后确认熔解曲线。每个样品均做3个平行样并取均值作为该样本的Ct值,每一轮反应均做阴性对照。mRNA表达量为2-ΔΔCT,其中ΔΔCT=ΔCT实验组-ΔCT对照组,ΔCT=CT目的基因-CT内参基因。

表1 实验引物序列组成

2 结 果
2.1旷场实验结果 穿格次数方面,BCCA组穿格次数显著高于Sham组、RES-L组和RES-H组(P<0.05),RES-L组显著高于RES-H组和Sham组(P<0.05),RES-H组显著高于Sham组(P<0.05),见表2,图1、2。站立次数方面,BCCA组站立次数显著高于Sham组、RES-L组和RES-H组(P<0.05),RES-L组显著高于RES-H组(P<0.05),但RES-H组和Sham组比较差异均无统计学意义(P>0.05),见表2、图3。
2.2Morris水迷宫实验结果 前5 d定位航行能力结果显示,第3天Sham组上台潜伏期较BCCA组、RES-L组和RES-H组显著缩短(P<0.05),第4天和第5天BCCA组和RES-L组上台潜伏期缩短不显著,而RES-H组上台潜伏期缩短与前两组比较差异有统计学意义(P<0.05)。第6天空间探索能力结果显示,Sham组和RES-H组均显著高于BCCA组和RES-L组(P<0.05),而Sham组和RES-H组之间及BCCA组和RES-L组之间差异无统计学意义(P>0.05),见表3,图4~6。

表2 旷场实验结果
a:P<0.05,与Sham组、RES-L组和RES-H组比较;b:P<0.05,与RES-H组比较

图2 旷场实验各组大鼠穿格次数结果
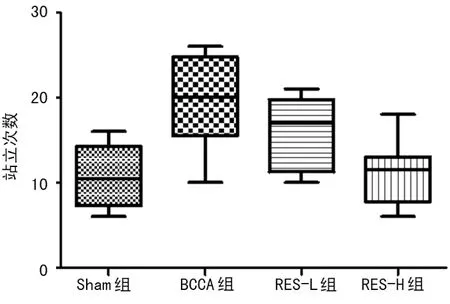
图3 旷场实验各组大鼠站立次数结果

表3 Morris水迷宫实验结果
a:P<0.05,与BCCA组、RES-L组和RES-H组比较;b:P<0.05,与同组前4 d比较;c:P<0.05,与BCCA组和RES-L组比较

图4 Morris水迷宫各组大鼠运动轨迹
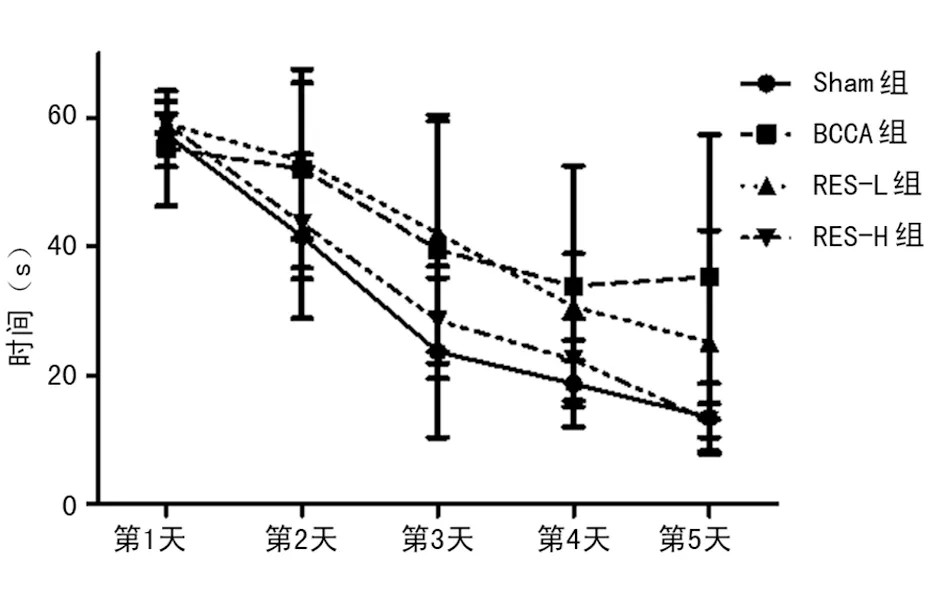
图5 Morris水迷宫各组大鼠定位航行能力结果
2.3海马MMP-9 mRNA和TIMP-1 mRNA相对表达量 MMP-9 mRNA和TIMP-1 mRNA相对表达结果如表4所示,MMP-9 mRNA方面,Sham组表达量最低,BCCA组、RES-L和RES-H组均有不同程度表达升高(P<0.05),但RES-H组表达量升高程度低于BCCA组和RES-L组(P<0.05),而BCCA组和RES-L组差异无统计学意义(P>0.05)。TIMP-1 mRNA方面,Sham组表达量最低,BCCA组、RES-L和RES-H组均有不同程度表达升高(P<0.05),但RES-H组表达量升高程度高于BCCA组和RES-L组(P<0.05),而BCCA组和RES-L组差异无统计学意义(P>0.05)。

图6 Morris水迷宫各组大鼠空间探索能力结果

表4 海马MMP-9 mRNA和TIMP-1 mRNA相对表达量 (n=8)
3 讨 论
慢性脑血管病发病年龄有年轻化的趋势,对患者的生存质量产生严重影响。慢性脑缺血状态与脑血管病的病理过程密切相关[10],可导致进展性的学习记忆等认知功能衰退和情绪障碍[11]。本研究建立BCCA慢性脑缺血大鼠模型,待疾病进入慢性期(实验第35~41天)后,通过旷场实验和Morris水迷宫实验评估其焦虑状态和学习记忆能力。本研究发现,BCCA组大鼠穿格次数及站立行为次数均多于Sham组,表明BCCA组大鼠焦虑水平升高,这与既往研究结果类似[12]。学习记忆方面表现出能力下降,即BCCA组大鼠上台潜伏期明显高于Sham组,穿格次数明显低于Sham组,这与既往研究结果相同[13]。以上结果均表明BCCA慢性脑缺血大鼠模型成功复制了慢性脑缺血患者的临床表现。
研究发现,RES具有广泛生物活性,在抗炎、抗氧化、神经细胞保护及抗凋亡方面均表现出有益作用[14-19]。研究表明,大脑海马区是学习记忆等认知相关功能的重要脑区,且海马神经细胞对缺血缺氧十分敏感[3]。有研究发现,RES能明显减轻因缺氧导致的体外培养海马细胞的损伤[20]。也有研究显示,RES预处理能改善脑卒中大鼠模型的脑梗死面积及脑积水程度[21]。本研究采用两种浓度的RES对慢性脑缺血大鼠进行干预,结果显示在BCCA组、RES-L组和RES-H组均表现出不同程度的焦虑样行为增多、水迷宫上台潜伏期延长和穿格次数减少,然而RES-H组以上症状程度较与BCCA组和RES-L组明显改善,但BCCA组和RES-L组差异无统计学意义(P>0.05)。这表明40 mg·kg-1·d-1RES干预可在一定程度上改善慢性脑缺血大鼠的学习记忆能力及焦虑水平,这支持既往研究结果[22-23]。
为进一步探讨RES对慢性脑缺血的神经保护作用的病理机制,本研究通过RT-PCR技术测定了海马区MMP-9 mRNA和TIMP-1 mRNA的相对表达量。大量研究表明,MMP-9具有强大的细胞外基质降解能力,同时又可激活TNF-α及IL-1等炎症因子,因此MMP-9表达异常升高成为反映脑神经细胞外基质降解的重要标志之一[24-26]。本研究发现,海马区MMP-9 mRNA在Sham组表达最低,BCCA组表达明显增加,RES-H组表达少量增加。这提示慢性脑缺血后持续40 mg·kg-1·d-1RES干预可在一定程度上抑制破坏性MMP-9 mRNA表达升高。据报道,MMP-9基因敲除小鼠模型能减轻其因缺血缺氧导致的脑神经损伤[27]。TIMP-1是MMP-9的特异性抑制剂,参与阻断其细胞外基质降解[28]。本研究发现,海马区TIMP-1 mRNA在Sham组表达最低,BCCA组表达少量增加,RES-H组表达明显增加,这提示慢性脑缺血后持续40 mg·kg-1·d-1RES干预可在一定程度上促进保护性TIMP-1 mRNA表达升高。本研究还发现,RES-L组两种mRNA表达情况与BCCA组均无明显差异,提示RES对缺血性脑损害的神经保护有剂量依赖性。
综上所述,本研究认为持续给予慢性脑缺血大鼠40 mg·kg-1·d-1RES腹腔注射,能延缓慢性脑缺血引起的认知功能减退和焦虑状态,其病理生理机制可能与RES参与海马区MMP-9表达抑制和TIMP-1表达促进有关,这为今后临床治疗慢性脑缺血患者提供了新思路,但RES调控海马区MMP-9和TIMP-1表达的确切机制还有待进一步研究。

