盲肠结扎穿孔术致脓毒症的代谢网络基础研究
周凤高,徐 冕,颜悦新,刘桠名,许 成,蒋国云,赵 琨,武 彧,刘 荣△
(1.昆明医科大学第一附属医院EICU,昆明 650032;2.云南省阜外心血管病医院SICU,昆明 650032;3.南方医科大学附属深圳宝安医院ICU,广东深圳 518100)
脓毒症是由严重创伤、烧伤、休克、大手术后、感染等因素引起的全身炎性反应,被定义为威胁生命的严重宿主炎性反应,严重时可导致多器官功能障碍,也是导致重症患者死亡的主要原因之一[1]。目前临床上仍未发现一种或者几种特异性的生物标记物用于脓毒症早期诊断,而诊断及治疗越晚的患者病死率越高,相反,尽早的诊断并及时干预可以明显提高患者的治愈率[2]。因此,寻找脓毒症的特异性标记物以帮助早期诊断至关重要。代谢组学由OLIVER等[3]在1998年最先提出,并于1999年由NICHOLSON等[4]命名为“代谢组学”,该学科是对生物体因受外界刺激所产生的代谢产物进行分析,并试图阐述其代谢规律[5-6]。在最近的研究中,IZQUIERDO-GARCIA等[7]用定量核磁共振(NMR)代谢组学发现脓毒症大鼠的肺组织、肺泡液中的代谢产物发生了显著变化,并认为代谢组学分析方法是诊断脓毒症的潜在有用技术。而脓毒症患者的全身炎性反应失控是炎症因子和炎症因子构成的网络综合结果所致[8]。因此本研究通过代谢组学的方法,试图寻找脓毒症的特异性标志物及其代谢网络的变化规律。
1 材料与方法
1.1动物及实验材料 雄性SD大鼠50只,6~8周龄,体质量250~300 g,由昆明医科大学动物实验中心提供。氯化钠注射液(0.9%),水合氯醛(10%),碘伏消毒液,无菌剪刀、手术刀、镊子、纱布,21G针头,无菌5-0丝线和圆针。
1.2仪器 高速低温离心机(法国Oouan公司),超低温保温箱(中国Forma Scientific公司),液相色谱277C UPLC System (美国Waters公司),质谱SYNAPT G2 XS QTOF(美国Waters公司)等。
1.3脓毒症模型 SD大鼠术前1 d禁食,可饮水,大鼠分组做好标记。根据大鼠标记,依次行盲肠结扎穿孔(CLP);首先腹腔注射水合氯醛(10%),注射剂量约为0.4 mg /kg(根据大鼠麻醉效果可适当增减),麻醉成功后,将大鼠固定于夹板上,腹部备皮,消毒;用手术刀逐层切开腹部,切口为腹部中下部位,长约1.5 cm;用无菌镊逐层分开并固定皮肤、肌肉,用湿纱布分开并保护腹腔肠管,寻找到盲肠并置于湿纱布上。用镊子钝性分离盲肠肠系膜末端1 cm处,用5-0丝线结扎分离部位,结扎盲肠远端长度均为1 cm,约为盲肠的1/2,并用21G针头穿刺肠壁2 次,针孔间距约3 mm,挤出适量肠内容物,然后将盲肠按原位放回腹腔,并逐层缝合腹壁肌肉、皮肤,关腹后皮下注射氯化钠注射液(3 mL/100 g),补充手术过程中体液的丢失,术后置于相同环境中。根据大鼠标记分为A组、B组、C组、D组、E组,分别对应在术前(0 h),CLP模型建立后6、12、24、48 h采集大鼠股动脉动脉血2 mL,3 000 r/min 离心3 min,收集上清液用于大鼠代谢组学的检测,-80 ℃保存备用。采完血后将其脱臼处死,剪开腹部观察其腹腔脏器变化情况。一般情况观察发现:大鼠的麻醉苏醒时间基本相同,为(60±30)min;各组大鼠术后均出现饮食、饮水明显减少,精神萎靡,蜷缩少动,皮发无光泽等。按预设的时间点采血后,剪刀剪开大鼠腹部,观察大鼠的腹部变化情况。可以发现实验时间越长,腹部缺血、感染情况越明显(图1)。根据大鼠的一般情况变化,以及大鼠腹部情况的变化,可判定大鼠脓毒症模型复制成功。
1.4代谢组学分析
1.4.1实验流程 为了获得可靠的数据,本项目加入质控(QC)样本来对整个实验进行监控,QC样本为取等量制备好的实验样本混合而成。首先用有机试剂沉淀蛋白法分别对3组样本进行代谢物提取,其次用液相色谱-质谱检测对代谢物提取液依次进行分析,见图2。
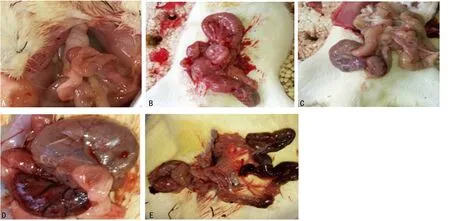
A:术前;B:CLP模型建立后6 h;C:CLP模型建立后12 h;D:CLP模型建立后24 h;E:CLP模型建立后48 h
图1 不同时点腹部变化情况

图2 实验流程
1.4.1.1代谢物提取方法 取-80 ℃低温保存的血清样品(含样本制备QC),先置于-20 ℃放置30 min,再放置于4 ℃冰箱使之融化,直至样品内看不见冰;用可调节间距的排枪,将每个样品(含QC)各取40 μL(可根据实际检测样品的情况调整),加入相应96孔板中,剩余样品冻存;在已加入40 μL样品(含QC)的新EP管中加入甲醇120 μL,封膜后振荡1 min,置于-20 ℃冰箱30 min;4 000 r/min 4 ℃离心20 min;将96孔板从离心机中取出,每个孔取20 μL置于新的96孔板中,加入180 μL 50%甲醇进行稀释,每个孔取出20 μL置于样品槽中混合为上机QC样本,每个孔取80 μL置于新的96孔板中;用热封仪对96孔板加盖铝膜封口,在膜上用笔注明项目编号及正负离子,板编号,有蛋白沉淀的板同时封膜后置于-80 ℃保存。
1.4.1.2液相参数描述 采用液相色谱277C UPLC System (100 mm×2.1 mm,1.7 μm, Waters,USA)进行色谱分离,色谱柱柱温为50 ℃,流速为0.4 mL/min,其中A流动相为水和0.1%甲酸,B流动相为甲醇和0.1%甲酸。对代谢物采用以下梯度进行洗脱:0~2 min,100%流动相A;2~11 min,0~100%流动相B;11~13 min,100%流动相B;13~15 min则为100%流动相A。每个样本的上样体积为10 μL。
1.4.1.3质谱参数描述 对从色谱柱上洗脱下来的小分子,利用高分辨串联质谱SYNAPT G2-XS QTOF (美国Waters公司),分别进行正负离子模式采集。正离子模式下,毛细管电压和锥孔电压分别为2 kV和40 V。负离子模式下,毛细管电压及锥孔电压分别为2 kV和40 V。采用MSE模式进行Centroid数据采集,一级扫描为50~1 200 Da,扫描时间为0.2 s,对所有母离子按照20~40 eV的能量进行碎裂,采集所有的碎片信息,扫描时间为0.2 s。在数据采集过程中,对LE信号每3 s进行实时质量校正。同时,每隔10个样本进行一次混合后QC样本的采集,用于评估在样本采集过程中仪器状态的稳定性。
1.4.2信息分析流程

图3 信息分析流程
在获得下机数据(原始数据rawdata)后,依次根据信息分析流程步骤对下机数据进行处理。首先对质谱下的机原始数据进行数据前处理;其次用统计分析方法筛选出差异离子;最后对代谢物及差异代谢物进行鉴定,并分析其代谢通路。质谱下机原始数据导入商业软件 Progenesis QI (version 2.2) 进行峰提取,获得代谢物相关的质荷比、保留时间和离子面积等信息。随后对提取出来的数据去低质量离子,采用基于质控样本信息对真实样本信号进行局部多项式回归拟合信号[9]方法校正。对校正后的数据进行过滤,即将所有QC样品中相对标准偏差(RSD)>30%的离子过滤掉(RSD>30%的离子在实验过程中波动较大,不纳入下游统计学分析)。
1.5统计学处理 由于代谢组学数据具有“高维、海量”的特点,因此需要用单维和多维的方法根据数据特性从不同角度进行分析。本研究采用华大代谢组学研究团队自主开发的代谢组学数据分析流程,进行单变量和多变量分析,从而获得组间差异代谢物;其方法包括参数检验和非参数检验、差异表达倍数分析、主成分分析PCA、偏最小二乘法判别分析PLS-DA[10-11]等。
2 结 果
2.1差异离子筛选及鉴定 根据信息分析流程,该项目采用多变量分析PLS-DA模型第二主成分的VIP值,结合单变量分析差异倍数(fold-change)和q-value值来筛选差异表达的代谢物。筛选条件:(1)VIP≥1;(2)fold change≥1.2(≤0.833 3);(3)q<0.05。三者取交集,得到共有的离子即差异离子。差异离子结果发现,各组与对照组之间正(pos)、负(neg)离子模式均出现差异离子,且在24 h即D~A组间差异离子数最多,此结果发现脓毒症模型下动物体内早期6 h即B~A组(甚至更早)就开始出现代谢物的变化,而且在24 h即D~A组左右出现最大变化,见表1。

表1 差异离子鉴定表
一级鉴定数:通过一级数据搜索数据库后被鉴定的离子数目;二级鉴定数:通过数据库的理论二级碎片搜索后被鉴定的数目
2.3差异代谢物通路分析 根据筛选出的差异离子,基于KEGG数据库进行代谢物代谢通路查找,通过代谢通路分析能够帮助了解代谢物所参与的主要生化代谢途径和信号转导通路。最终根据neg离子模式确定了75条代谢通路,根据pos离子模式确定了158条代谢通路,其通路主要包含了碳水化合物、蛋白质、氨基酸、脂类、类固醇类、嘌呤、胆汁酸等代谢通路,且各通路之间相互联系。
2.2根据筛选出来的差异离子做聚类分析 从聚类图中能更直观地发现6 h即B~A组就开始出现差异(甚至更早),到24 h即D~A组对比差异最明显,强度最大,见图4。图中每一行代表一个差异离子,每一列代表一个样本,不同颜色代表不同强度,颜色从绿色到红色表示强调从低到高。
3 讨 论
众所周知,全身炎性反应综合征、脓毒症、脓毒性休克和多器官功能障碍综合征是同一病理过程的不同阶段,终末阶段表现为多器官功能障碍综合征。多器官功能障碍综合征病死率为50%~60%,它是当今危重症医学研究的重点和难点,早期诊断、治疗,患者的生存率会大大提高[12-13]。脓毒症动物模型的制作方法众多,但越来越多的学者认为CLP建型更符合临床,有学者把CLP作为脓毒症模型的金标准等[14]。
代谢组学主要是通过高通量的实验和大规模的计算,研究分析机体内小分子代谢物的变化规律,目的是从检测到的大量代谢物中筛选出具有统计学和生物学意义的代谢物,并根据相应的数据库对代谢物的代谢过程进行分析。
脓毒症发病机制复杂、病死率高,学者们一直在尝试寻找诊断脓毒症的特异性标记物,以期早期诊断、治疗,降低其病死率。早期的研究发现:检测脓毒症患者血浆中异常表达的蛋白,可用于脓毒症的诊断及其预后的预测[15]。而有研究则利用代谢组学分析方法发现脓毒症大鼠的心脏、肝脏及大脑中均有多种异常蛋白的表达[16-18];IZQUIERDO-GARCIA等[7]同样利用代谢组学方法发现脓毒症大鼠的肺组织、肺泡液中的代谢产物发生了显著变化,并认为代谢组学分析方法可用于诊断脓毒症;近年来,XU等[19]利用代谢组学方法确定了6种脂肪酸用于评估脓毒症的预后。然而,由于脓毒症发生机制复杂,参与代谢的代谢物及代谢途径也非常复杂,因此脓毒症不可能只用1个或2个生物标志物可以诊断的。所以,笔者尝试一种基于整体代谢谱的预测方法来识别脓毒症早期特异性代谢物,并阐明其在脓毒症中的病理生理过程及代谢途径。
本研究中发现不同时间组之间neg、pos离子模式均出现差异离子,在CLP模型建立后6 h即B-A组(甚至更早)就开始出现明显差异,且在24 h即D-A组差异离子数最多。脓毒症时机体发生一系列复杂的病理生理反应,主要包括内皮细胞损伤、细胞因子及炎症因子释放、线粒体功能障碍、脂质过氧化、DNA的损伤、自由基失衡、氧化抗氧化失衡等[20]。当机体受到各种病理或生理刺激时机体处于应激状态,机体主要表现为“高代谢”,因此分泌大量应激激素,如儿茶酚胺、胰高血糖素、甲状腺素等,此时机体能量需求明显增加,促使大量能源物质消耗、肌肉蛋白分解,故能量代谢出现紊乱;脓毒症时机体逐渐出现缺血缺氧[21],线粒体氧化功能出现障碍,机体“氧债”增加,乳酸、酮体产生增加;当出现脓毒血症时机体全身炎性反应、血液中炎性介质及激素水平等升高,从而导致胰岛素抵抗,进一步引起碳水化合物、蛋白质、氨基酸、脂肪酸和核酸等代谢物变化的紊乱[22-24]。因此脓毒症时机体可出现一系列差异性代谢物。本研究中发现neg离子模式差异离子共4 324个,pos离子模式共4 053个,并通过KEGG数据库,其根据neg离子模式确定了75条代谢通路,根据pos离子模式确定了158条代谢通路,其代谢通路主要包括碳水化合物、蛋白质、氨基酸、脂类、类固醇类、嘌呤、胆汁酸等,说明脓毒症是一个极其复杂的病理生理反应,涵盖了机体各个系统的生理反应,并相互影响。
本研究尚有以下方面需进一步探讨:(1)仍需较大样本量进一步验证其共同代谢物及其代谢通路;(2)可进一步研究分析各个时间段代谢物及其代谢通路,并分析其病理生理过程;(3)因脓毒症病理生理极其复杂,因此脓毒症发生时的代谢物及其代谢通路众多,如需找到特异性标记物,还需要大量的研究对比分析。
总之,代谢组学对脓毒症的研究分析及诊断有重要意义。本研究利用代谢组学方法研究了脓毒症的不同阶段,发现的一些潜在的分子代谢产物及其相关的代谢途径可能成为今后脓毒症代谢途径研究的重要线索。

