原发性颅内Rosia-Dorfman 病3例并文献复习
丁江伟,周 刚,丁大领,陈 晨,孙剑瑞,王树凯△
(郑州大学第一附属医院:1.神经外科;2.磁共振室,郑州 450052)
Rosia-Dorfman病又称窦组织细胞增生伴巨淋巴结病(sinus histocytosis with massive lymphadenopathy,SHML),是一种罕见、特发的良性组织增生症,约25%~40%的患者发生于节外,原发于颅内者较为罕见。中枢神经系统RDD因部位多变、影像学与组织学特征不明显,易被误诊、漏诊,为提高对本病的认识,笔者就郑州大学第一附属医院2015年9月至2017年9月收治的3例原发性颅内RDD病例并文献复习,现报道如下。
1 资料与方法
1.1一般资料 病例1:患者男,36岁,以“头晕9 d”为主诉入院,查体无明显异常,MRI平扫左侧颞叶可见团片状稍短T1、T2信号,周围可见斑片状长T1、T2信号,磁共振液体衰减反转恢复序列(FLAIR)像呈高信号,磁共振弥散加强成像(DWI)轻度弥散受限呈稍高信号。增强后呈均匀强化,病变大小32 mm×20 mm×21 mm,临近脑膜可见线样强化影,初步诊断为脑膜瘤(图1~3),免疫组化染色结果见表1。
病例2:患者女,61岁,以“突发晕厥9 d、恶心呕吐6 d“为主诉入院,入院查体:欠配合,神志模糊,表情痛苦呈急性面容,双眼视物障碍,四肢肌力约Ⅳ级,肌张力正常,双侧瞳孔对光反射正常,直径约3.0 mm,四肢病理反射正常。头颅MRI回示左侧小脑半球及小脑蚓部可见团块状混杂(长短T1混杂、稍长T2信号),黑水像高信号,DWI高B值部分扩散受限呈高信号,病变周围可见片状水肿信号影、中脑、桥脑及四脑室可见明显受压,病变累及部分右侧小脑半球。增强:左侧小脑半球及小脑蚓部病变呈不均匀高低信号,大小约35 mm×46 mm×30 mm。免疫组化染色结果见表1。术后组织病理提示小脑占位部分脑组织伴出血、坏死,并见较多组织细胞、淋巴细胞浸润。初步诊断肿瘤伴出血(图4~6)。

A:T1加权轴位增强扫描;B:T1加冠状位增强扫描;C:T1加权矢状位增强扫描;D:FLAIR像呈高信号
图1 病例1术前MRI(左侧颞叶占位)

图2 病例1术后组织病理结果

A:T1加权轴位增强扫描;B:T1加冠状位增强扫描;C:T1加权矢状位增强扫描
图3 病例1术后8 d复查MRI
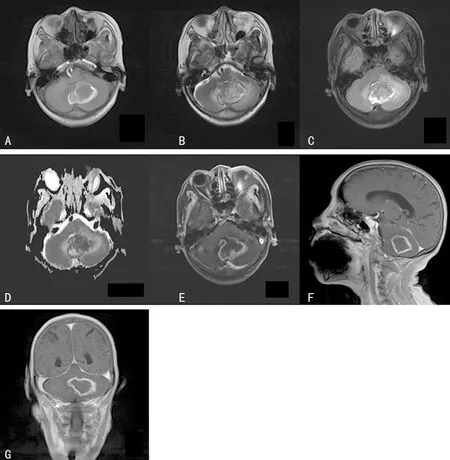
A:T1加权轴位平扫;B:T2加权轴位平扫;C:FLAIR像呈高信号;D:DWI轻度弥散受限呈稍高信号;E:T1加权轴位增强扫描;F:T1加冠状位增强扫描;G:T1加权矢状位增强扫描
图4 病例2术前MRI(左侧小脑半球及蚓部病变)
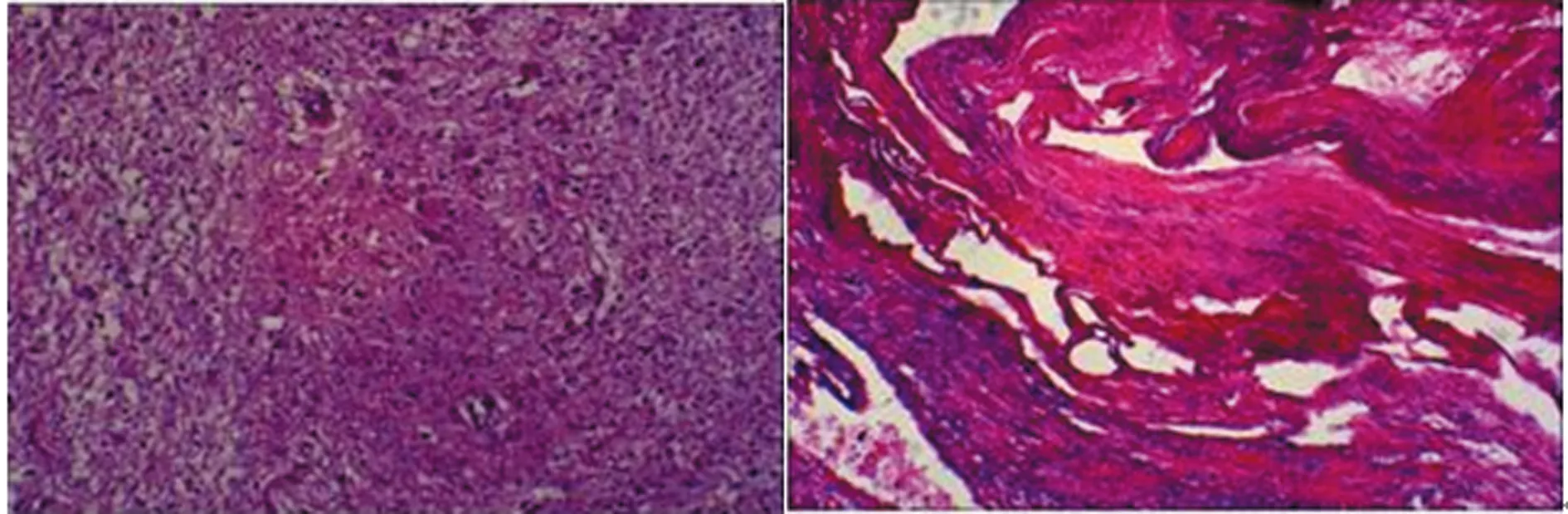
图5 病例2术后组织病理结果

A:T1加权轴位增强扫描;B:T1加冠状位增强扫描;C:T1加权矢状位增强扫描
图6 病例2术后15个月复查MRI
病例3:患者男,53岁, 以“枕部疼痛6个月”为主诉入院,诊断高血压1年,规律口服吲达帕胺,血压控制良好,查体未见明显神经系统异常,头颅MRI及磁共振血管成像(MRA):右侧枕部实性占位,考虑脑膜瘤(图7~9);MRA提示右侧枕部病变与右侧横窦与窦汇交界区关系密切,增强后呈均匀强化。术后组织病理提示部分区域纤维组织增生,伴较多淋巴细胞、泡沫细胞浸润及血管增生。免疫组化染色结果见表1。

A:T1加权轴位平扫;B:T2加权轴位平扫;C、D:轴位及冠状位增强扫描可见病变明显均匀强化
图7 病例3术前MRI示(右侧枕部病变)
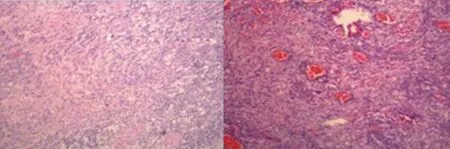
图8 病例3术后组织病理结果
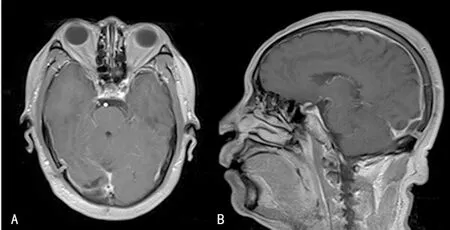
A:T1加权轴位增强扫描,B:T1加冠状位增强扫描
图9 病例3术后2个月复查MRI
1.2方法 3例患者均开颅显微镜下全切病变,术后病变常规送检病理。
2 结 果
3例患者仅行显微外科手术治疗,术后未应用任何激素或化疗药物辅助治疗。术后病理检查为RDD(图2、5、8),术后免疫组化S-100蛋白和CD68阳性(表1),术后复查头颅MRI检查其中2例病灶完全消失(图6、9),其中1例术后8 d复查MRI显示环形病灶(图3),因未进行长期影像学随访无法判断其病灶有无复发。

表1 3例原发性颅内Rosia-Dorfman 病免疫组化染色结果
3 讨 论
RDD是一种窦组织细胞增生伴巨淋巴结病,由ROSAI和DORFMAN于1969年根据其报到病例病理将其命名,其发病原因不明,可能与病毒感染和免疫缺陷有关,如EB病毒、人类免疫缺陷病毒等,多以无痛性淋巴结肿大为首发特征,同时可伴有发热、白细胞升高、红细胞沉降率(ESR)加快及多克隆高丙球蛋白症[1]。RDD好发于女性且儿童、青年人,常累及淋巴结,中枢神经系统受累者少见(小于5%)[2],目前国内外报道约222例[3-4]。
原发性中枢神经系统RDD好发于大脑凸面、矢状窦、岩斜区,罕见于鞍上[5],症状常与病变压迫临近组织或颅内压增高等有关,如头晕、头痛、肢体无力、癫痫发作、视力丧失、下丘脑-垂体轴功能障碍(如尿崩)等[3]。尽管有90%的RDD患者存在无痛双侧颈部淋巴结肿大,但对于原发性颅内RDD者该表现并不常见[4]。本组病例以头晕、头痛为主要症状,无明显特异性。
影像学检查多表现为颅内脑实质外的单发肿块,亦可多发,与硬脑膜及大脑镰、小脑幕等结构关系密切,好发于幕上,易被误诊、漏诊。本组病例2例位于幕上(1例位于左侧颞极,另1例位于右侧枕部病变,术前均误诊为脑膜瘤),1例位于幕下小脑半球,术前诊断肿瘤伴卒中。RDD影像学上常侵袭硬脑膜、血管窦和骨[6], CT显示均匀的高密度影,增强明显强化,这可能与周围的血管源性水肿有关,典型的RDD没有相关钙化[7]。MRI表现为T1WI等信号,T2WI低信号,增强后均匀强化,可见脑膜尾征,部分可见边缘呈“伪足样”。病变外周T2WI等-低信号,中心T2WI呈更低信号,部分可见病变沿中线对称分布,这可能是本病的特征性表现[8]。T2WI低信号强度是鉴别RDD与脑膜瘤的关键特征,T2WI低信号强度可能与巨噬细胞在活动吞噬过程中产生的自由基有关[7]。该组误诊为脑膜瘤的病例中T1WI长信号,T2WI长信号增强后明显均匀强化,临近脑膜可见线样强化影,不具有明显特征性表现。值得注意的是该组病例中其中1例位于幕下小脑半球脑实质性的病变伴发出血,临床上极为罕见。影像学上RDD易被误诊为脑膜瘤,故应将其相鉴别:脑膜瘤好发于中年女性,一般表现为等T1T2信号,注入增强剂后均匀明显强化,DWI上呈等信号。
RDD确诊最终依赖病理结果,组织学特点是不同形态的组织细胞、大量成熟的浆细胞、淋巴细胞组成的“明暗相间”结构。文献报道免疫组化:S-100(+),CD68(+),CD1a(-),Vimentin0(+)、CD1a(-)、SMA(-)、CD34(-),其中CD1a(-)是朗格汉斯细胞组织细胞增多症的标志,本组患者免疫组化显示:S-100(+),CD68(灶+),CD1a(-)与文献[9]报道基本一致。组织病理学鉴别诊断包括淋巴瘤、浆细胞肉芽肿、血浆细胞丰富的脑膜瘤和朗格汉斯细胞组织增生症。
RDD常见的治疗方法是手术、类固醇、放疗和化疗。外科手术是原发性RDD首选,手术肿瘤全切是最佳治疗方法[6],但当病灶临近重要功能区或与周围组织粘连时很难全部切除,应行次全切或部分全切。PETZOLD等[10]报道有14%的患者术后肿瘤复发或再生长,对于术后肿瘤残余患者激素是目前首选治疗措施。CAMP等[11]收治1例31岁颅内多发RDD青年女性患者,行手术治疗,除了术后5 d的地塞米松外,未接受进一步的积极治疗。术后10周和12个月的影像学检查显示所有3个病灶消失,MCPHERSON等[12]治疗1例术后残余病灶患者,给予激素后复查病变消失、症状缓解,皮质类固醇药物应被认为是治疗中枢性RDD的有效选择。部分文献[13]报道放疗也是有效的治疗策略。PULSONI等[14]对12例无颅内侵犯系统性RDD患者的治疗结果进行了回顾性分析,其中2例经MTX和6-MP治疗患者均有效。SANDOVAL-SUS等[5]对1例RDD患者给予MTX和6-MP治疗,并取得了部分缓解,MTX与6-MP可能在中枢神经系统疾病患者中是有效的。本组3例患者仅行手术切除处理,术后未给予激素或化疗药物处理,术后恢复良好,该组3例病例中2例术后分别2个月、15个月复查MRI未见病变复发,另1例患者随访仅术后8 d复查MRI显示环形病灶,电话随访未诉不适,但因未长期影像学随访无法判断其病灶有无复发。
总之,颅内原发性RDD罕见,根据术前MRI增强部分可见边缘呈“伪足样”,病变外周T2WI等-低信号,中心呈更低信号,部分可见病变沿中线对称分布,可考虑该病诊断,组织病理提示淡染的组织细胞、浆细胞和淋巴细胞组成的背景伴纤维化,同时组织细胞内有多量吞噬的淋巴细胞,免疫标记显示组织细胞表达S-100蛋白和CD68可助诊断该病,治疗以手术为主,可以辅助激素治疗,预后较好,放化疗效果有待进一步考证。

