鸡营养应激中SIRT1 基因对肝脏脂类代谢的影响
郁建锋,王中亮,张燕萍,胡 悦,徐 璐,龚道清,顾志良*
(1.扬州大学动物科学与技术学院,江苏扬州 225009;2.常熟理工学院生物与食品工程学院,江苏常熟 215500)
SIRT1 是Sirtuins 家族的成员之一,其通过对蛋白质的去乙酰化作用参与蛋白质功能的调控[1-2],如通过调节组蛋白和非组蛋白的活性进而调控基因转录,影响机体众多生物学过程[3-4],如细胞的增殖凋亡、应激反应和能量代谢等[5-7]。小鼠SIRT1 通过对甾醇调节元件结合蛋白1 c(Sterol Regulatory Element Binding Protein 1c,SREBP-1c)的去乙酰化作用抑制肝脏脂类合成基因的表达,如脂肪酸合成酶(Fatty Acid Synthase,FASN)等,避免肝性脂肪变性[8-10]。禁食或胰高血糖素增加可以上调SIRT1 基因的表达[11],促进过氧化物酶体增殖活化的受体γ 协同激活因子1α(Peroxisome Proliferator Activated Receptor Gamma Coactivator 1α,PGC-Lα)的去乙酰化,调控与糖代谢相关酶类的表达[12-14],还可以提高过氧化物酶体增殖活化的受体α(Peroxisome Proliferator-Activated Receptor α,PPAR α)的转录,增加小鼠肝脏的脂肪酸的β-氧化[15-16],说明SIRT1 在脂肪酸氧化及脂类代谢过程起着重要作用。肝脏是鸡的主要能量代谢器官之一,在鸡的糖脂代谢方面具有重要作用,脂肪组织中80%以上的脂肪酸由肝脏的从头合成途径产生[17]。本研究将以广西三黄鸡为研究对象,研究营养应激、高糖高脂对肝脏中SIRT1 及相关基因表达的影响,探讨SIRT1 基因在鸡肝脏中脂类代谢中的重要作用及机理,从而为解决在饲养过程中鸡的脂类沉积问题提供新的、重要的依据。
1 材料与方法
1.1 试验药品和试剂 RNA 提取试剂RNAsio、反转录试剂 盒PrimeScript ™ RT Reagent Kit (Perfect Real Time)、荧 光 定 量PCR 试 剂 盒SYBR®Premix Ex TaqTM(Tli RNaseH Plus)、DL2000 购自宝生生物工程(大连)有限公司,棕榈酸( Palmitic acid, PA)购自Sigma,山羊抗SIRT1 多抗(sc-19857)和小鼠抗β-actin 单抗(sc-47778)购自圣克鲁斯生物技术有限公司,辣根过氧化物酶标记的驴抗山羊IgG(D110115)购自生工生物工程(上海)股份有限公司,辣根过氧化物酶标记的兔抗鼠IgG(ab97046)购自Abcam,Western/IP 裂解液和BeyoECL Plus A 液和B 液购自碧云天生物技术有限公司。
1.2 引物设计和合成 根据NCBI GenBank(http://www.ncbi.nlm.nih.gov/gene/)数据库中公布的鸡SIRT1(NC_00 6093.4)、β-actin(NC_006101.4)、PGC-Lα(NC_006091.4)、PPAR α(NC_006088.4)、三酰甘油脂肪酶(Adipose Triglyceride Lipase,ATGL)(NC_006092.4)、FASN(NC_006105.4)的基因序列设计定量引物(表1),并由生工生物工程(上海)股份有限公司合成。

表1 荧光定量PCR 引物序列
1.3 禁食实验 选用30 只同批次的30 日龄雄性广西三黄鸡,随机分成A、B 和C 3 组,每组10 只。每组正常饲喂和饮水,温度维持在26~28℃,饲养4 d 后,A组(对照组)维持原有的进食、饮水,B 组和C 组进行禁食处理(饮水正常)24 h 后,将A 组和B 组的鸡称重后屠宰采样,颈动脉采血,并采集各组织,液氮速冻后,存放于-80℃冰箱。C 组恢复进食2 h 后,按上述方法进行屠宰采样,用全自动血液分析仪测定血清中的葡萄糖、甘油三酯(TG),每组分别测定10 个样本。
1.4 高糖、高脂对LMH- gSmiR30 细胞的作用 为进一步探究SIRT1 基因对鸡肝内脂代谢的作用,选用本实验室所构建的SIRT1 基因低表达的鸡肝癌细胞系LMH- gSmiR30,联合用葡萄糖和PA 处理该细胞系,以3×105/mL 的细胞将LMH-pmirG 细胞(对照组)和LMH-gSmiR30 细胞铺板于24 孔培养板内,每孔0.5 mL Waymouth′s 完全培养基(含10%胎牛血清,100 ng/mL的G418),37℃、5% CO2培养24 h,PBS 洗涤1 遍后,换成含10% 胎牛血清的MEM 完全培养基,在实验组中添加终浓度为50 mmol/L 葡萄糖和0.2 mmol/L PA,培养48 h 后,收集细胞,提取总RNA,每次设3 个重复,重复3 次实验。其余的细胞进行油红染色:弃培养基,PBS 洗涤1 次后,加入100% 的丙二醇作用2 min,去除丙二醇,加入0.5 mL 0.5%的油红(丙二醇配置的油红),60℃处理60 min;去除油红染料,加入85% 的丙二醇作用2 min,弃液后用流水洗3~5 min,晾干,甘油明胶封合,镜下检测。
1.5 总RNA 的提取及荧光定量分析 挑取适量的肝脏组织块和培养细胞,按RNAsio 试剂说明提取总RNA,用NanoDrop ND2000 进行定量后,用反转录试剂盒Prime Script ™ RT Reagent Kit(Perfect Real Time) 对RNA样品进行RT 反应合成cDNA;然后以β-actin 为内参,用荧光定量PCR 试剂盒SYBR®Premix Ex TaqTM(Tli RNaseH Plus)对目标基因进行定量检测,体系:10 μL 2×SYBR Green Premix Ex Taq(Tli RNaseH Plus),0.4 μL Forward primer (10 μmol/L),0.4 μL Reverse primer(10 μmol/L),0.4 μL ROX Reference Dye II(50×),2.0 μL 上述RT 产物稀释液,H2O 补足至20 μL;反应条件:95℃ 30 s,(95℃ 5 s,60℃ 34 s)40 个循环,PCR 反应结束后进行熔解曲线分析,收集数据进行统计分析。
1.6 SIRT1 基因的蛋白质表达水平的检测 挑取适量的肝脏组织块,用液氮碾磨后,用含1 mmol/L 苯甲基磺酰氟(Phenylmethanesulfonyl Fluoride,PMSF)的Western/IP裂解液裂解组织和细胞,提取总蛋白,并用BCA(Bicinchoninic Acid)法测定总蛋白浓度。取35 μg总蛋白,以10% 的SDS-PAGE 进行蛋白质电泳分离,然后通过湿转法将蛋白转印至聚偏氟乙烯膜(Polyvinylidene Fluoride,PVDF),用含5% 脱脂奶粉的TBST(Tris Buffered Saline With 0.1% Tween-20,pH 7.4,TBST)缓冲液将PVDF 膜封闭过夜后,用TBST 充分漂洗(3次,每次10 min),然后在4℃条件下分别用山羊抗SIRT1 多抗TBST 以1∶250 稀释)和小鼠抗β-actin 单抗(TBST 以1∶250 稀释)孵育过夜;再次用TBST 充分洗涤PVDF 膜后,分别用辣根过氧化物酶标记的驴抗山羊IgG(TBST 按1∶20 000 稀释)和辣根过氧化物酶标记的兔抗鼠IgG(TBST 按1∶20 000 稀释),室温(21~25℃)孵育2 h;在TBST 充分洗涤PVDF 膜后,用等体积混合的BeyoECL Plus A 液和B 液混合液处理PVDF 膜进行曝光。
1.7 统 计分析 采 用2-ΔCt法对荧光 定 量PCR 结 果 进行分析,获得相关基因的表达结果,采用ImageJ 软件对Western blot 结果进行灰度分析,获得目标基因的蛋白表达水平,然后分别用t 检验和ANOVA 方差分析法对以上获得的数据分别进行组内、组间的统计分析。
2 结果与分析
2.1 禁食对鸡血清葡萄糖糖、血脂变化的影响 由表2可知,与A 组相比,B 组在禁食24 h 后的血清葡萄糖约为A 组的90%;C 组在禁食24 h 后恢复采食2 h,血清葡萄糖糖浓度迅速恢复至17.565 mmol/L,较A 组和B 组分别增加了14.3%和27.5%,3 组间的血清葡萄糖糖变化存在差异显著(P<0.01)。B 组鸡在禁食24 h后血液中TG 显著下降至A 组的20% 左右,C 组恢复2 h 采食后TG 迅速升至A 组的50%左右(P<0.01)。上述结果表明,在鸡禁食过程中,血液中的TG 变化程度比葡萄糖变化程度更明显。
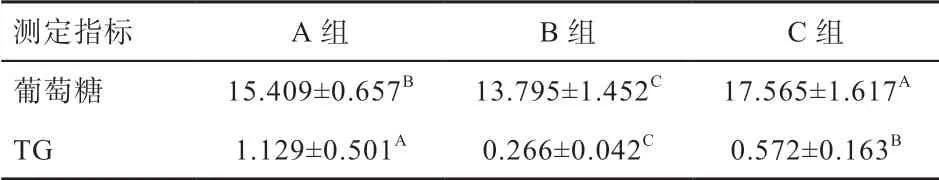
表2 禁食对鸡血糖和TG 浓度的影响(n=10) mmol/L
2.2 饥饿对鸡肝脏SIRT1 及糖脂代谢相关基因的表达影响 表3 和图1 显示,与A 组相比,B 组中SIRT1基因的mRNA 水平增加了1.27 倍(P<0.01),SIRT1蛋白水平增加了87.4%(P<0.05),C 组中SIRT1 的mRNA 和蛋白质水平均显著下降,甚至低于A 组。进一步分析发现(表4),PGC-Lα、PPAR α 和ATGL 的mRNA 转录水平的变化趋势与SIRT1 基因基本一致,禁食后,分别增加了7.77、1.46、2.26 倍(P<0.01),恢复采食2 h 后,PGC-Lα、PPAR α、ATGL 基因的mRNA水平也迅速降至A 组水平。而FASN 基因mRNA 水平的变化与SIRT1 基因相反,禁食后显著降低至A 组的1/13 左右(P<0.01),恢复采食后回升至A 组的1/4(P<0.01)。以上基因的表达变化与血液中葡萄糖和TG 浓度的变化相对应,这暗示SIRT1 及其他基因在鸡禁食过程中对肝脏的糖脂代谢反应起着重要作用。
2.3 高糖、高脂对肝细胞内SIRT1 及其下游基因表达的影响 油红染色结果显示,与LMH-pmirG 细胞相比,LMH- gSmiR30 细胞经50 mmol/L 葡萄糖和0.2 mmol/L PA 处理48 h 后,其胞内的脂滴形成更为明显(图2)。荧光定量结果显示,SIRT1、PPAR α 和FASN 基因的mRNA 表达水平在LMH-pmirG 和LMH-gSmiR30 细胞中均受到不同程度抑制(表5),但在2 种细胞间差异不显著。高浓度的葡萄糖和PA 抑制了ATGL 在LMH- gSmiR30 中mRNA 表达水平,但在LMH-pmirG 中未受到明显影响,说明SIRT1 基因的低表达抑制了LMH细胞中ATGL 对高糖高脂的应答表达,致使细胞内脂解反应减少。因此,LMH- gSmiR30 细胞在高糖高脂的培养条件下更易在细胞内形成脂滴。

表3 禁食后鸡肝脏中SIRT1 基因的表达
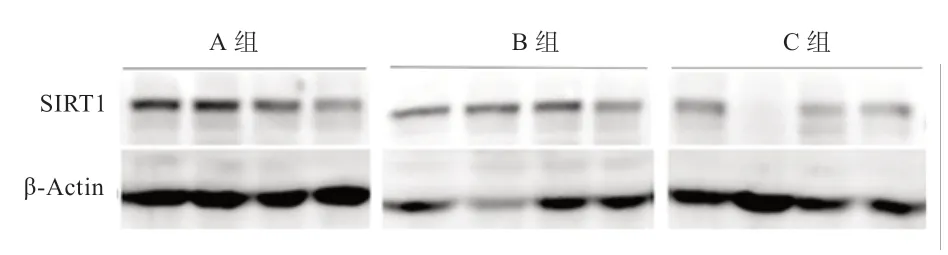
图1 禁食后鸡肝脏中SIRT1 蛋白的Western blot 检测结果
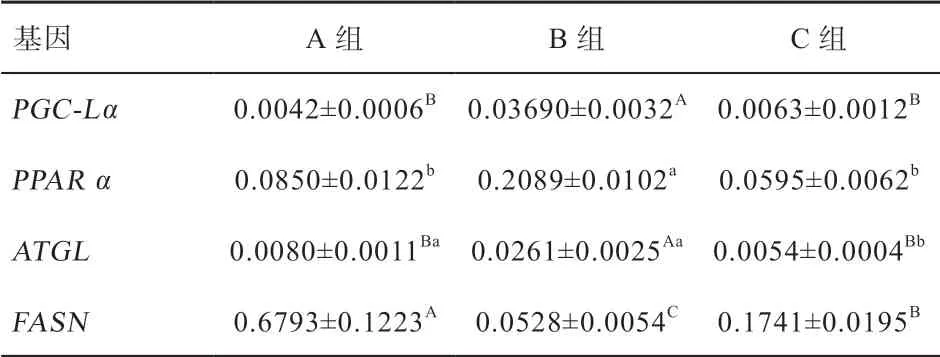
表4 禁食后鸡肝脏内糖脂代谢相关基因mRNA 表达水平(n=8)

图2 细胞内脂滴的油红染色结果
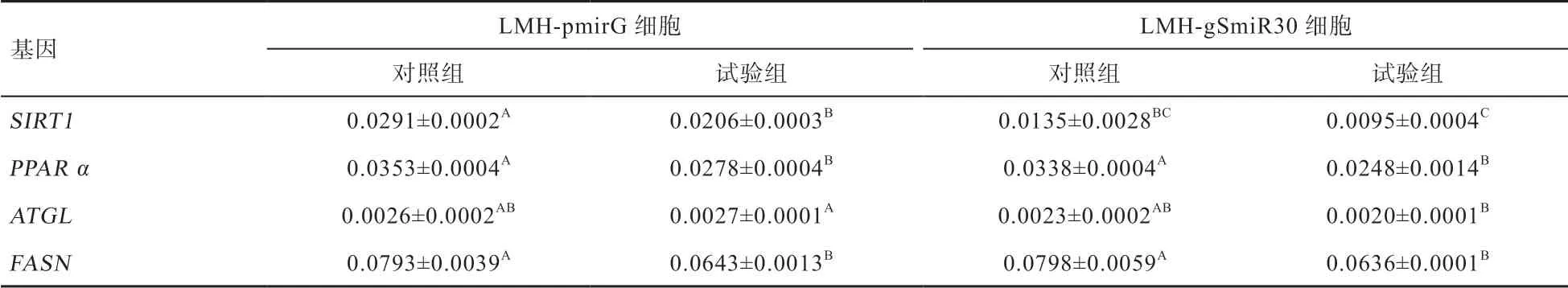
表5 高糖、高脂对LMH-gSmiR30 细胞系中SIRT1 及糖脂代谢相关基因mRNA 表达水平的影响(n=3)
3 讨 论
肝脏是动物体最主要的代谢器官之一,在营养、能量平衡调节中起着最为重要的作用[15,18]。研究发现,尽管鸡的血糖值在禁食24 h 后有所下降,且恢复饲喂后快速回升,但血糖浓度在一个相对小的范围内上下波动,而TG 的变化非常明显,禁食24 h 后血脂的浓度明显低于正常饲喂组,恢复采食后血脂浓度虽然也低于正常组,但比禁食组回升明显,这些指标的变化与肝脏在禁食过程中发挥的作用密不可分,肝脏在机体禁食阶段可以通过肝糖原的动员产生葡萄糖,补充降低的血糖浓度,增加脂类的分解和促进脂肪酸的氧化代谢,满足机体对能量的需求[19]。
肝脏中的糖脂代谢相关基因的表达在禁食24 h 后都发生了不同程度的变化,这也印证了以上推断,如SIRT1、PGC-Lα、PPAR α 和ATGL 等 基 因 的mRNA 水平表达显著增加,恢复饲喂2 h 后又快速下降,且这4 个基因的变化趋势相一致。研究报道,在肝脏的糖异生中,SIRT1、Pgc1α 有着重要作用[20-21],SIRT1 在表达水平和蛋白修饰水平参与PGC-Lα 基因功能的调节。在小鼠中,特异性敲低SIRT1 基因的表达后,PGC-Lα的表达显著减少,其调控的磷酸烯醇丙酮酸羧化酶激酶的表达也明显减少,如果小鼠PGC-Lα 中的第13 位上的赖氨酸突变为精氨酸,可以抑制其被乙酰化,而血糖则将会大幅升高,特别是在短期禁食期间,这种效应更为明显[15]。因此,禁食24 h 后SIRT1、PGC-Lα 基因的表达升高可能促进了鸡肝糖原的分解产生葡萄糖,补充血循环中的葡萄糖,缓解短期禁食造成的血糖变化。
而禁食24 h 后TG 大幅减少,这可能与机体通过增加脂肪酸的氧化和抑制脂类合成有关。SIRT1-PGCLα- PPAR α 与脂肪酸的氧化代谢密切相关,在脂类代谢中也发挥着重要作用[15-16],SIRT1、PGC-Lα 和 PPAR α 基因在鸡禁食后的表达迅速升高可能是造成其血液中TG 大幅减少的原因之一。同时,ATGL 基因在禁食后的表达也显著升高。有研究发现,ATGL 可以对肝脏脂滴进行脂降解,产生脂肪酸,促进PGC-Lα/PPAR α 的信号通路,增加脂肪酸的氧化和线粒体生物反应[22],ATGL 还可以通过SIRT1 引起肝脏脂滴的自噬和脂解,小鼠肝脏特异性敲除ATGL 基因可以导致脂肪在肝脏内的堆积,同时下调SIRT1 的活性及PPAR α/PGC-Lα 靶基因的表达和下调线粒体的生物反应及β-氧化[23],这可能也是在禁食后鸡血液中TG 显著降低的原因。本研究还发现,在LMH-gSmiR30 中,SIRT1 基因的低表达导致ATGL 基因的表达有所下调,而且高浓度的葡萄糖和PA 可以加重这一反应,说明SIRT1 基因表达的减少抑制了ATGL 基因对高糖、高脂的应答性表达,减弱了肝细胞对脂肪的脂解作用[24],而FASN 基因在LMH-pmirG 和LMH-gSmiR30 细胞中均受到高糖高脂的抑制,两者之间表达差异不明显,说明在高富营养的培养条件下LMH 细胞中脂滴形成增加,而LMHgSmiR30 胞内的脂滴形成更多的原因是由于SIRT1 基因细胞中的低表达降低胞内脂解代谢水平,而非通过增加脂类的合成造成的。由此可见,SIRT1-ATGL 在鸡肝或肝细胞内脂类的分解中可能发挥着重要作用。
4 结 论
综上所述,鸡SIRT1 基因的表达量与肝内的糖脂、能量代谢密切相关,禁食和能量限制可以增加SIRT1基因的表达;富营养条件下,LMH 细胞中SIRT1 基因的低表达降低了ATGL 基因的表达,影响肝细胞内脂肪的脂解途径,促进胞内脂滴的增加。

