Myf5、Myf6 基因在黔北麻羊与努黔F1 代不同组织表达差异性的研究
王 鑫,苑洪霞,骆金红,许厚强,陈 祥*
(1.贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵州贵阳 550025; 2.贵州省动物遗传育种与繁殖重点实验室,贵州大学动物科学学院,贵州贵阳 550025)
肉品质性状是受遗传和环境因素影响的复杂表型性状。遗传因素主要表现在动物出生前肌肉的形成,出生后则为肌纤维体积的增大。研究表明,肌肉组织的形成和出生后的生长主要由生肌调节因子(Myogenic Regulatory Factors,MRFs)基因家族来调控[1-2]。MRFs家族控制着肌细胞的增殖和分化,与肌纤维的数量和大小密切相关,对肉品质和风味有重要影响[3]。MRFs 大体可分为2 种,一种为在成肌细胞增殖过程中最先表达的初级MRFs,由Myod1 及Myf5 组成,在生肌细胞系的定向完成中起调节作用[1];另一种是由MyoG 及Myf6 组成的次级MRFs,它们进一步完成肌纤维的形成[4]。Klosowska 等[5]研究发现,Myf5 影响肌束中快肌类型的比例和肌纤维的代谢性能从而影响肉质。郭月英等[6]研究发现,Myf6 基因多态性与巴美肉羊、小尾寒羊肉品质存在相关性。赵丹璐等[7]研究发现,Myf5 基因表达量与山猪肉品质相关蛋白质呈显著的正相关。
黔北麻羊属短毛、皮肉兼用品种,具有适应性强、耐粗饲、繁殖率高、产肉性能良好、膻味轻、肉鲜美可口等优点,为贵州三大地方山羊品种之一[8],2009 年12 月被中华人民共和国农村农业部批准为国家新的遗传资源[9]。关于Myf5、Myf6 基因在黔北麻羊不同组织部位表达差异性的研究尚未见报道。本实验利用荧光定量RCR 法对同龄黔北麻羊和努黔F1代不同组织中Myf5 和Myf6 基因表达进行比较分析,为进一步研究Myf5、Myf6 基因对黔北麻羊肌肉生长和肉品质影响的作用机理提供一定的理论依据。
1 材料与方法
1.1 样品采集 随机选取相同饲养条件下(贵州省习水县黔北麻羊中心产区)健康的12 月龄黔北麻羊和努黔F1代公羊各3 只,分别采集心脏、肝脏、脾脏、肺脏、肾脏、背最长肌、股二头肌和臂三头肌8 种组织,液氮短暂保存运回实验室,于-80℃冰箱备用。
1.2 组织RNA 的提取 采用Trizol 法提取各组织总RNA,对提取的总RNA 用1.2% 琼脂糖凝胶电泳检测其纯度和完整性,超微量紫外分光光度计(购自安玛西亚中国有限公司、型号:trospec 2100 pro)测定其浓度。
1.3 引物设计与合成 参照GenBank 提供的山羊Myf5基因(登录号为NC_030812.1)、Myf6 基因(登录号为NC_030812.1)基因序列和内参基因三磷酸甘油醛脱氢酶(GAPDH)的序列(登录号:U390915),利用在线软件Primer-BLAST 设计Myf5 跨外显子1 和2 的荧光引物、Myf6 跨外显子1 和2 的荧光引物。由上海生工生物工程技术服务有限公司对相关引物(表1)进行合成。

表1 荧光定量目的基因引物的相关信息
1.4 实时荧光定量PCR 反应
1.4.1 cDNA 第一链的合成 按照HiFiScript cDNA 第一链合成试剂盒说明书对提取的各组织总RNA 进行逆转录,获得cDNA。逆转录总体积为20 μL:dNTP Mix(2.5 mmol/L Each) 4 μL,Primer Mix 2 μL,RNA Template 4 μL,5×RT Buffer 4 μL,DTT(0.1 mol/L)2 μL,HiFiScript(200 U/μL)1 μL,RNase-Free Water 3 μL。逆转录条件:42℃,60 min;75℃,5 min。将获得的cDNA 瞬时离心后于冰上冷却,-20℃保存备用。
1.4.2 荧光定量PCR 反应体系 荧光定量PCR 反应体系(20 μL):(TransStart Tip Green qPCR SuperMix)SY BRMixture 10 μL,上、下游引物(10 pmol/μL)各 0.5 μL,cDNA(200 ng/μL)1 μL,dd H2O 8 μL。荧光定量PCR扩增程序:95℃预变性30s,95℃变性5 s;57℃退火15 s;72℃延伸10 s,40 个循环,每个组织样品及内参基因各设置3 孔重复。反应结束后,以GAPDH 为内参基因,Ct 值采用2-ΔΔCt法[10]计 算Myf5、Myf6 基因在同龄 黔北麻羊和努黔F1代不同组织的差异表达量。
1.4.3 标准曲线的建立 选取心脏组织的cDNA 为标准样品,按照1×10-2~1×10-6的梯度稀释浓度,每个梯度浓度在荧光定量PCR 仪上进行3 次重复,制作标准曲线。
1.5 统计分析 实验数据利用SPSS 19.0 统计处理软件进行单因素方差分析,用F 检验进行各组间差异检验,显著者再用Duncan´s 法进行多重比较,数据以平均值±标准误(n=3)表示,显著水平均为P<0.05。
2 结 果
2.1 RNA 提取结果检测 超微量分光光度计定量对各组织部位样品的总RNA 浓度和质量进行测定,所有样品总RNA 的OD260/OD280值均在1.8~2.0,说明提取的总RNA 纯度较高。利用琼脂糖凝胶电泳对所提取的总RNA 质量进行检测,发现28S、18S、5S rRNA 条带清晰明亮(图1),无明显降解现象,说明提取的总RNA可以用于后续的反转录及实时荧光定量PCR。
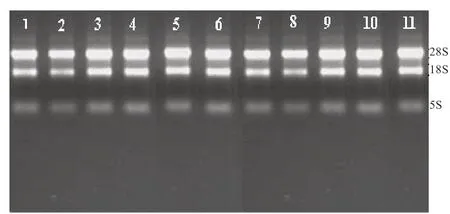
图1 不同组织的总RNA 电泳检测结果
2.2 Myf5 基因、Myf6 基因RT-PCR 扩增产物检测 以黔北麻羊和努黔F1代公羊不同组织c DNA 为模板,用已设计的引物分别对Myf5 基因、Myf6 基因和GAPDH基因进行普通PCR 扩增,扩增产物用1 %的琼脂糖凝胶电泳检测,分别获得大小约140、120、149 bp 的条带,与预期目的片段大小基本相符(图2)。
2.3 Myf5、Myf6 基因在黔北麻羊和努黔F1代不同组织间相对表达分析 由图3 可知, GAPDH、Myf5、Myf6 基因的扩增效率均在1 附近,相关系数R2皆大于0.993(理想扩增效率为0.8~1.2),扩增效率基本一致,可用于后续实时荧光定量分析;三者的熔解曲线均呈现单峰,表明引物特异性良好,没有非特异性扩增产物和引物二聚体污染,可用于后续实验。
由图4 和图5 可知,Myf5、Myf6 基因的表达在不同品种间总体无差异性,而在黔北麻羊和努黔F1代公羊的不同组织部位中均有不同程度的表达。Myf5 基因在黔北麻羊臂三头肌、股二头肌和背最长肌中的相对表达量极显著高于心脏、肾脏、肝脏、脾脏、肺脏(P<0.01),肾脏的相对表达量显著高于肺脏和脾脏(P<0.05);Myf5 基因在黔北麻羊和努黔F1代臂三头肌、股二头肌和背最长肌中的相对表达量极显著高于心脏、肝脏、肾脏、脾脏、肺脏(P<0.01),肝脏的相对表达量显著高于脾脏(P<0.05)。Myf6 基因在黔北麻羊在臂三头肌、股二头肌和背最长肌中的相对表达量极显著高于心脏、肾脏、肝脏、脾脏、肺脏(P<0.01),心脏和肝脏的相对表达量均显著高于脾脏(P<0.05);Myf6 基因在努黔F1代在股二头肌和背最长肌中的相对表达量极显著高于心脏、肝脏、肾脏、脾脏、肺脏(P<0.01),心脏和肝脏的相对表达量显著高于肺脏(P<0.05)。
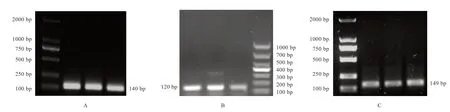
图2 3 种基因PCR 扩增图
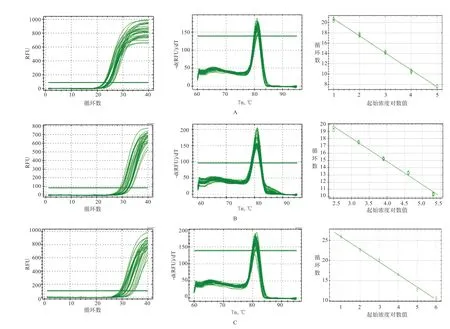
图3 3 种基因的扩增曲线、熔解曲线和标准曲线
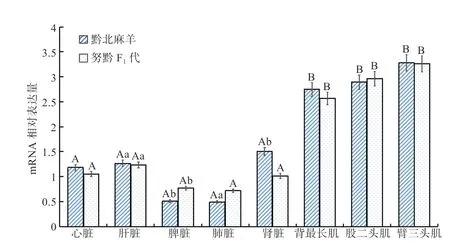
图4 Myf5 基因在黔北麻羊和努黔F1 代各组织mRNA 的相对表达量

图5 Myf6 基因在黔北麻羊和努黔F1 代各组织部位mRNA 的相对表达量
3 讨 论
国内外相关研究表明,Myf5、Myf6 基因表达于多种组织,在肌肉组织中表达量较高。目前,对Myf5、Myf6基因的研究多集中在分子结构、多态性变异、病理、机理或者胚胎阶段的表达以及不同羊品种间的表达研究[11-15]。而在黔北麻羊不同组织间的表达研究较少,尤其在肌肉组织表达尚未有相关研究报道。Zammit 等[16]研究发现,Myf5 在影响肌肉成熟和引导卫星细胞功能再生骨骼肌的过程中起着重要作用,影响肌肉再生肌生成的遗传控制。曹辉龙等[17]研究发现,Myf5 在南江黄羊不同肌肉组织(半腱肌、半膜肌、背最长肌、股四头肌和臀中肌)中均有不同程度的表达。Myf5 基因均在京海黄鸡[18]、鸭[19]胸肌和腿肌组织中高表达。在草鱼红肌、白肌、肝脏、胰脏、肾脏、脑和肠中均检测到Myf5 基因的表达,红肌和白肌组织中Myf5 基因mRNA 的表达量显著高于其他组织[20]。
本研究结果表明,Myf5、Myf6 基因在黔北麻羊和努黔F1代公羊8 种组织中均有表达,这说明Myf5、Myf6 基因在黔北麻羊和努黔F1代中是广谱表达基因,与在五指山猪的心脏、肝脏、肺脏、脾脏、肾脏、胃、小肠和肌肉等组织中均能够检测到该基因表达的[21]结果一致。程海星[22]研究表明,Myf6 基因在羊臂三头肌和股二头肌中不同程度表达,且与羊肉品质有一定关联。本实验证实,Myf5、Myf6 基因在背最长肌和股二头肌中表达量最高,与Myf5、Myf6 基因在巴美肉羊和苏尼特羊的背最长肌、臂三头肌、股二头肌中均有不同程度表达,且不同月龄间各组织间表达量存在差异[23]的结果相近。
4 结 论
本研究表明,Myf5、Myf6 基因在12 月龄的黔北麻羊和努黔F1代公羊两品种间各组织的表达差异不显著;Myf5、Myf6 基因在黔北麻羊和努黔F1代公羊的心脏、肝脏、脾脏、肺脏、肾脏、背最长肌、股二头肌和臂三头肌各组织中均有表达,且不同组织部位中表达存在差异性;在背最长肌、股二头肌和臂三头肌组织中的表达量远高于心脏、肝脏、脾脏、肺脏和肾脏中的表达量。

