超声引导羊膜腔内注射肺表面活性物质联合氨溴索预防早产兔肺损伤
朱思怡,吕国荣,陈秋月
(1.福建医科大学附属第二医院超声科,福建 泉州 362000;2.泉州医学高等专科学校,母婴健康服务应用技术协同创新中心,福建 泉州 362000)
早产儿肺表面活性物质(pulmonary surfactant,PS)缺乏,常发生肺损伤,导致新生儿呼吸窘迫综合征等疾病,是早产儿夭折的首要原因[1]。目前常用的PS气管内给药及产前地塞米松预防早产儿肺损伤的策略均存在各种不良反应,对其安全性存在争议[2-3]。有学者[4-5]尝试使用超声引导羊膜腔内注射PS预防早产儿肺损伤,取得一定效果。本研究探讨超声引导羊膜腔内注射PS联合产前应用氨溴索预防早产兔肺损伤的作用。
1 材料与方法
1.1 实验动物 健康妊娠新西兰兔20只,体质量3.5~5.0 kg,平均(4.29±0.38)kg,购自上海市松江区松联实验动物场,许可证号:SCXK(沪)2012-0011。于新西兰兔妊娠第18~21天转移至泉州医学高等专科学校实验动物中心饲养,实验动物使用许可证号:SYXK(闽)2016-0001。将实验动物随机分为产前应用盐酸氨溴索(ambroxol hydrochloride,AH)组(AH组)、超声引导羊膜腔内注射PS组(PS组)、超声引导羊膜腔内注射PS联合产前应用AH组(PS+AH组)和对照组,每组5只。
1.2 仪器与主要试剂 采用Hitachi Preirus彩色多普勒超声诊断仪;一次性消毒介入穿刺针(22 G,150 mm);猪肺磷脂注射液,主要成分二棕榈酰磷脂酰胆碱(dipalmitoyl phosphatidylcholine,DPPC);AH注射液等。
1.3 方法 AH组和PS+AH组于妊娠第24~26天连续3天每日经孕兔耳缘静脉注射AH注射液75 mg/kg体质量。PS组和PS+AH组于妊娠第27天行超声引导羊膜腔穿刺术:经耳缘静脉注射2%异戊巴比妥钠1.25 ml/kg体质量,确认孕兔角膜反射消失后,以仰卧位保定于动物专用手术板,于腹部备皮、消毒、铺巾;行腹部超声检查确定最佳穿刺部位及进针路线,探头适当加压并固定,以一次性介入穿刺针行羊膜腔穿刺术,分别向每个羊膜囊注射猪肺磷脂注射液0.1 ml(图1);对照组于妊娠第24~26天每日经孕兔耳缘静脉注射生理盐水10 ml/kg体质量,并于妊娠第27天行超声引导羊膜腔穿刺术,手术过程同PS组和PS+AH组,但向羊膜囊内注入生理盐水0.1 ml。对4组均于妊娠第27天羊膜腔穿刺后1 h行剖宫产术,取出早产兔。

图1 超声引导妊娠新西兰兔羊膜腔穿刺术 箭示穿刺针
每窝随机抽选2只早产兔,观察其存活时间。剖出早产兔30 min后,每窝另随机抽取2只行支气管肺泡灌洗,检测灌洗液中白细胞介素6(interleukin-6,IL-6)和DPPC含量。剪取其余早产兔右肺下叶,制备肺组织切片,进行免疫组织化学染色,测定去除背景光密度后阳性细胞的平均光密度(mean optical density,MOD)值,以检测肺表面活性物质相关蛋白A(pulmonary surfactant-associated proteins-A,SP-A)表达水平;进行HE染色观察早产兔肺组织病理损伤程度,并参考Ge等[6]提出的肺损伤病理评分标准,根据肺泡水肿程度、肺泡腔内红细胞漏出程度、肺不张程度和气道黏膜上皮细胞脱落程度对肺组织切片进行评分。
1.4 统计学分析 采用SPSS 19.0统计分析软件。符合正态分布及方差齐性的计量资料以±s表示,4组间比较采用单因素方差分析,两两比较采用LSD法;对不符合正态分布及方差齐性的资料采用中位数(上下四分位数)表示,4组间比较采用Kruskal-WallisH检验,两两比较采用Nemenyi检验。P<0.05为差异有统计学意义。
2 结果
2.1 存活时间 4组早产兔间存活时间总体差异有统计学意义(P<0.001,表1)。PS组、AH组及PS+AH组早产兔存活时间均较对照组延长(P均<0.05),但3组间早产兔存活时间比较差异无统计学意义(P均>0.05)。
2.2 实验室检查 4组早产兔间肺泡灌洗液中IL-6及DPPC含量总体差异均有统计学意义(P均<0.001,表1)。组间两两比较,PS组、AH组、PS+AH组与对照组间差异均有统计学意义(P均<0.05),PS+AH组早产兔肺泡灌洗液中IL-6含量较PS组、AH组减少,DPPC含量较PS组、AH组增加,差异均有统计学意义(P均<0.05),PS组与AH组间差异均无统计学意义(P均>0.05)。
2.3 肺组织SP-A表达水平 4组早产兔间肺组织MOD值总体差异有统计学意义(P<0.001,表1),对照组MOD值最低,与其余3组比较差异均有统计学意义(P均<0.05),PS+AH组肺组织MOD值高于PS组与AH组,差异均有统计学意义(P均<0.05),PS组与AH组间差异无统计学意义(P>0.05)。
2.4 肺损伤病理改变 PS组早产兔肺泡结构完整,充分扩张且扩张均匀;肺泡腔多清晰,其内少见渗出物或漏出的红细胞;气道上皮多完整、连续(图2A)。AH组肺泡结构完整,充分扩张且扩张均匀,扩张程度与PS组基本相同;肺泡腔多清晰,其内渗出物或漏出的红细胞少见;气道上皮多完整、连续(图2B)。PS+AH组肺泡结构完整,充分扩张且扩张均匀,扩张程度较PS组、AH组更大;肺泡腔清晰,其内未见明显渗出物或漏出的红细胞;气道上皮多完整、连续(图2C)。对照组肺泡广泛塌陷,部分表现为充气不均匀,同时局部区域肺泡扩张过度、部分肺泡间隔断裂、相互融合成为更大囊腔;肺泡腔内水肿液、渗出物及红细胞多见;气道上皮断裂、脱落、坏死多见(图2D)。
4组早产兔间肺组织损伤程度病理评分总体差异有统计学意义(P<0.001,表1)。其中,对照组病理评分最高,与其余3组比较差异均有统计学意义(P均<0.05);PS+AH组低于PS组和AH组,差异均有统计学意义(P均<0.05),而PS组与AH组差异无统计学意义(P>0.05)。
3 讨论
早产儿指妊娠满28周至不足37周间分娩出的新生儿,由于其肺发育不成熟,自身合成的PS不足,肺泡表面张力增加,肺顺应性下降,气体交换严重受限,常导致患儿发生代谢性酸中毒及低氧血症,继而肺血管痉挛,血管内皮受损,刺激以IL-6为主的多种促炎细胞因子释放增多,进而导致肺损伤[7]。
PS羊膜腔内给药的理论基础是羊水内物质能够进入胎肺。Galan等[8]将PS与右旋糖酐铁混合后注入孕兔的羊膜腔内,其后于剖宫产取出的早产兔肺内和气道远端发现均匀分布的铁微粒,表明经羊膜腔内注入的PS可进入胎兔肺内,推测其机制可能为胎兔在宫内即具有表浅而规律的呼吸样运动,能够吸入羊水,从而使注入羊膜腔中的PS顺利进入胎兔的呼吸道。
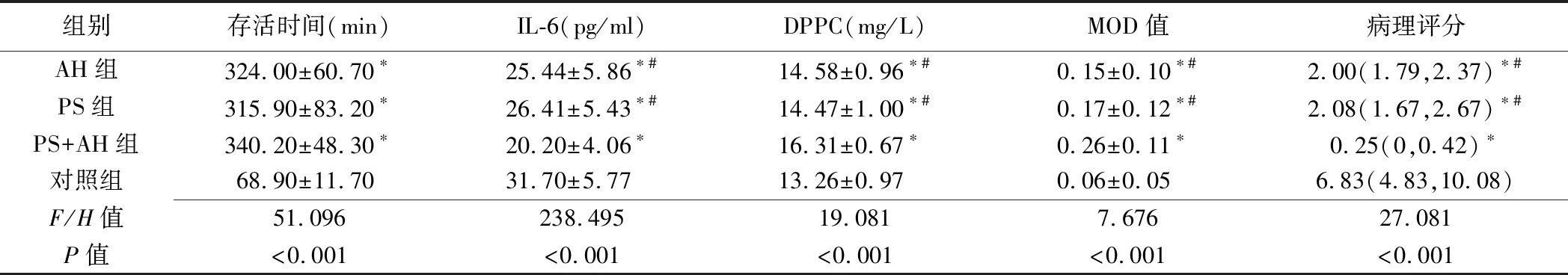
表1 4组早产兔存活时间、实验室检查及病理指标比较
注:*:与对照组比较,P<0.05;#:与PS+AH组比较,P<0.05
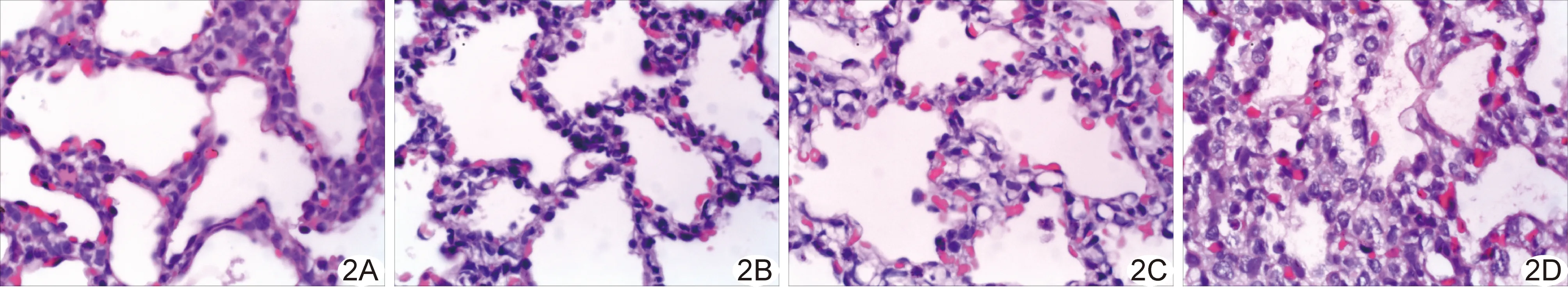
图2 早产兔肺组织病理图(HE,×400) A.PS组肺泡结构完整,扩张充分、均匀,肺泡腔清晰;B.AH组肺泡结构完整,扩张充分、均匀,与PS组扩张程度相仿,肺泡腔清晰;C.PS+AH组肺泡结构完整,扩张充分、均匀,扩张程度较PS组、AH组更大,肺泡腔清晰;D.对照组肺泡萎陷
应用于母体的氨溴索能够通过胎盘屏障,对胎肺组织特异性较高,可上调胎肺内源性PS合成,促进胎肺发育成熟、预防早产儿肺损伤。氨溴索发挥肺保护作用的其他可能机制[9-11]如下:①特异性抑制肺泡巨噬细胞溶酶体内磷脂酶A的活性,减少胎肺内磷脂分解,使PS含量增多;②上调水通道蛋白表达以减轻肺水肿;③发挥抗氧化作用减轻氧化应激反应;④减少促炎细胞因子产生。
本研究中对照组早产兔存活时间短于接受产前干预措施的PS组、AH组和PS+AH组,且其肺泡灌洗液中IL-6含量明显升高,病理学检查显示该组早产兔肺泡萎陷,肺组织形态学上呈损伤改变,肺损伤病理评分亦显著高于其他3组,提示早产肺损伤动物模型建立成功。
PS是由Ⅱ型肺泡上皮细胞合成并分泌的生物活性物质,可降低肺泡表面张力,稳定肺泡内压,避免呼气末肺泡塌陷[12]。PS由脂类和蛋白质组成,脂类中以DPPC含量最多,也是PS发挥功能的主要有效成分;SP-A为Ⅱ型肺泡上皮细胞中含量最多的肺表面活性物质相关蛋白(pulmonary surfactant-associated proteins,SP)亚型,其含量约占SP总量的1/2,具有稳定PS形态、调控炎症反应等多种重要生理功能[13]。因此,本研究检测DPPC和SP-A含量,一方面可验证早产兔PS水平,检测胎肺发育情况,另一方面也可作为判断肺损伤的指标。
本研究中,PS组、AH组及PS+AH组早产兔支气管肺泡灌洗液中的DPPC及SP-A表达水平均较对照组明显增高(P均<0.05),与Liu等[14]的研究结果一致,提示超声引导羊膜腔内注射PS和产前应用氨溴索均可有效增加早产兔肺组织中PS含量;进一步分析发现,在3个产前干预组中,PS+AH组早产兔肺内DPPC及SP-A表达水平均高于PS组和AH组(P均<0.05),推测联合使用超声引导羊膜腔内注射PS和产前应用氨溴索可分别从内源性和外源性两个方面增加PS含量,能更有效地预防早产兔肺损伤。
综上所述,超声引导羊膜腔内注射PS及产前应用氨溴索均能有效发挥预防早产兔肺损伤的作用,联合应用此2种产前干预手段预防早产兔肺损伤的效果优于单独应用。

