Bak、Bim和Mcl-1在中耳胆脂瘤中的表达及意义*
宋少鹏 李文文 李进兴 马秀岚
中耳胆脂瘤是角化的鳞状上皮和上皮下结缔组织以及角蛋白碎片在中耳进行性累积而成,伴或不伴有周围组织的炎性反应[1]。中耳胆脂瘤的发生是一个持续破坏性过程,侵蚀周围骨结构,从而导致听力下降、前庭功能障碍、面神经麻痹等相关并发症,严重影响患者的生活质量,其形成的确切机制尚不清楚;虽然不同的研究已经揭示了中耳胆脂瘤组织的骨质破坏性和过度增殖行为,但关于细胞凋亡如何影响胆脂瘤生长尚未达成一致意见,有学者认为胆脂瘤上皮存在凋亡增强现象[2,3],也有学者认为胆脂瘤上皮的凋亡受到抑制[4,5],因此,有必要对胆脂瘤上皮凋亡现象进行深入研究。细胞凋亡是生理条件下细胞程序性死亡的一种形式,对于保持组织稳态和胚胎发育必不可少。凋亡下调是肿瘤发生的主要原因,而上调也会诱导感染性疾病、自身免疫性疾病和神经退行性疾病[6],控制细胞凋亡是治疗相关疾病的重要治疗靶点[7]。促凋亡蛋白Bak、Bim和抗凋亡蛋白Mcl-1是Bcl-2家族的重要成员,本研究采用免疫组织化学和Tunel法检测Bak、Bim和Mcl-1在中耳胆脂瘤中的表达水平,以探讨其在胆脂瘤发生过程中的作用。
1 材料与方法
1.1中耳胆脂瘤及外耳道正常皮肤标本的获取 中国医科大学附属盛京医院耳科2017年3月~2017年12月通过手术获得的中耳胆脂瘤标本40例(胆脂瘤组),其中男17例,女23例,年龄8~83岁,平均42±20岁,病程6个月~60年;术后均经病理诊断为中耳胆脂瘤。同时,手术中取19例患者外耳道深部正常皮肤作为对照组(术前已告知患者同意并签署知情同意书),其中男11例,女8例;年龄13~83岁,平均45±17岁,病程6个月~50年。依据Hamed最新评分方法[8](表1)将胆脂瘤组分为骨质破坏组21例(得分≥4分)和未破坏组19例(得分0~3分)。

表1 中耳胆脂瘤骨质破坏评分标准
1.2标本染色方法
1.2.1免疫组化染色方法 标本切片脱蜡水化后用3%H2O2在37 ℃温箱条件下孵育30 min;PBS清洗5 min,3次;胰酶修复30 min,PBS浸泡5 min,3次;加山羊血清50 μl在37 ℃温箱条件下孵育20 min;滴加适当浓度的一抗50 μl/片,4 ℃过夜(至少18 h)。PBS冲洗5 min,3次,滴加二抗50 μl/片,37 ℃温箱条件下孵育20 min;PBS洗5 min,3次;滴加链霉菌抗生物素蛋白-过氧化酶,37 ℃20 min;PBS浸泡5 min,3次;DAB着色,镜下控制,蒸馏水中断反应;苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封固。PBS取代一抗作阴性对照,阳性对照用已知的阳性片。
1.2.2Tunel染色方法 石蜡切片脱蜡,水化;胰酶修复20 min,PBS浸泡5 min,3次;3%过氧化氢室温避光静置10 min,PBS洗片5 min,3次,滴加Tunel反应缓冲液,37 ℃,避光孵育80 min,PBS洗片5 min,3次。滴加过氧化物酶转换缓冲液,37 ℃孵育30 min,PBS洗片5 min,3次;DAB显色,苏木素复染,自来水返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片。阳性对照组织滴加50 μl阳性对照缓冲液,阴性对照的组织滴加不含10×酶试剂 的Tunel反应缓冲液(45 μl 1×底物标记试剂与5 μl去离子水混合)。
1.3结果判定 镜下观察Bak、Bim和Mcl-1蛋白着色情况,以细胞质着棕黄色者为阳性细胞。每张切片在400倍物镜下选取互不重叠的5个视野,使用Image Pro Plus6.0软件,测量每张切片的积分光密度和测量区域面积,平均光密度=积分光密度/测量区域面积(反映免疫反应物的表达强度)。Tunel染色阳性结果表现为核呈棕黄色、核固缩,形状不规则,细胞凋亡程度以凋亡指数(100个细胞中阳性细胞比例)表示。
1.4统计学方法 使用SPSS 20.0统计分析软件进行数据处理,计量资料比较采用两独立样本t检验,两两比较采用Pearson相关分析,P<0.05有统计学意义。
2 结果
Bak在胆脂瘤和外耳道皮肤中均有表达,主要定位于细胞质,在胆脂瘤全层表达(图1),而在外耳道皮肤中主要表达于颗粒层和角质层(图2),在胆脂瘤中的表达强度高于外耳道皮肤。Bim在胆脂瘤和外耳道皮肤中均有表达,主要定位于细胞质,在胆脂瘤全层弥漫性表达(图3),而在外耳道皮肤中散在表达于颗粒层和角质层(图4)。Mcl-1在胆脂瘤和外耳道皮肤中均有表达,主要定位于细胞质,在胆脂瘤中从基底层到角质层表达逐渐增强(图5),而在外耳道皮肤中散在表达(图6),在胆脂瘤中的表达强度高于外耳道皮肤。
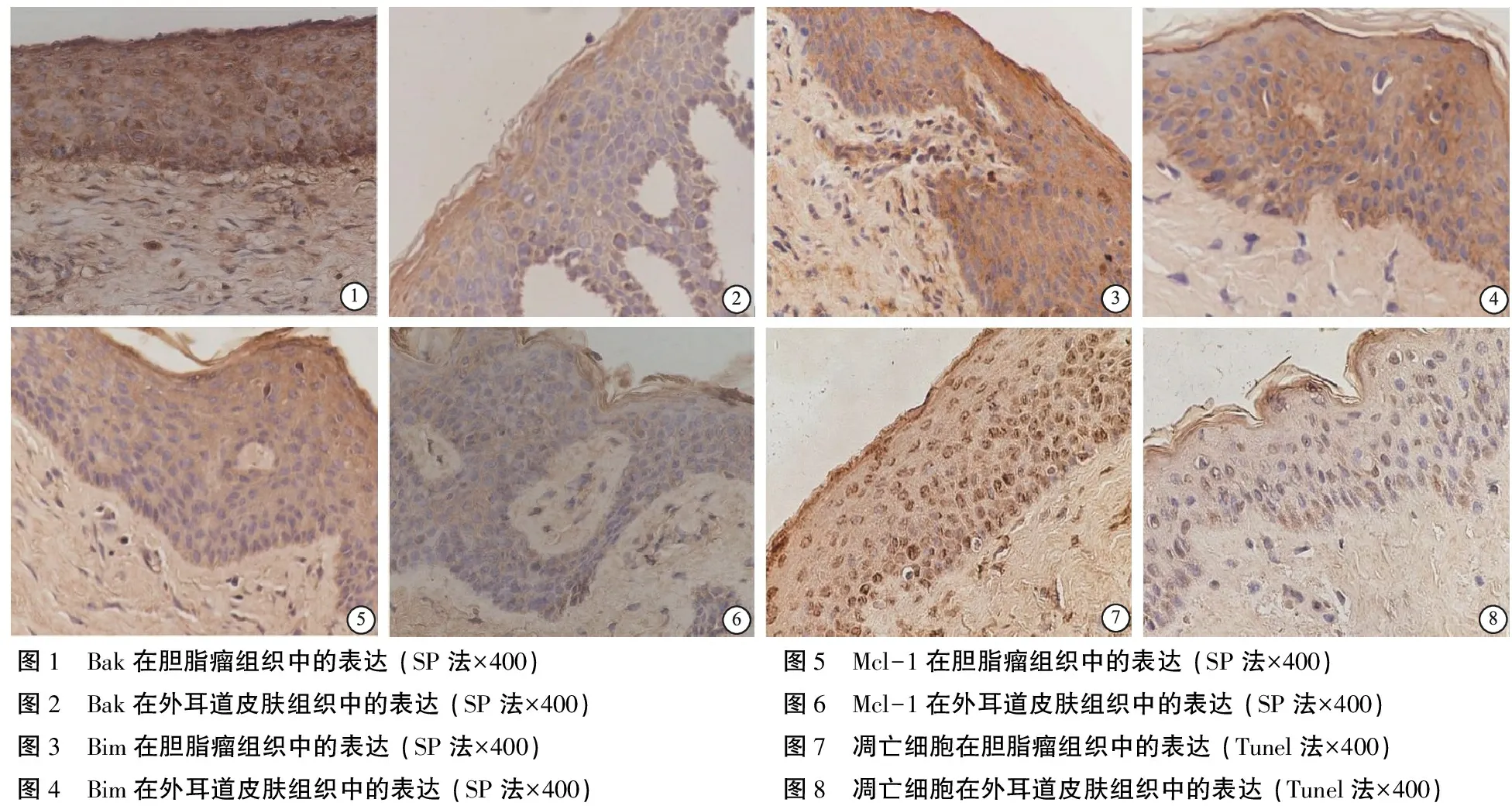
图1 Bak在胆脂瘤组织中的表达 (SP法×400)图2 Bak在外耳道皮肤组织中的表达 (SP法×400)图3 Bim在胆脂瘤组织中的表达 (SP法×400)图4 Bim在外耳道皮肤组织中的表达 (SP法×400)图5 Mcl-1在胆脂瘤组织中的表达 (SP法×400)图6 Mcl-1在外耳道皮肤组织中的表达 (SP法×400)图7 凋亡细胞在胆脂瘤组织中的表达 (Tunel法×400)图8 凋亡细胞在外耳道皮肤组织中的表达 (Tunel法×400)
胆脂瘤组和对照组Bak、Bim和Mcl-1表达的平均光密度值见表2,可见, 胆脂瘤组的Bak、Bim和Mcl-1的平均光密度值明显高于对照组(P<0.05)。
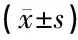
表2 胆脂瘤组和对照组Bak、Bim和Mcl-1的表达
骨质破坏组和未破坏组Bak、Bim和Mcl-1表达的平均光密度值见表3,可见,Mcl-1在骨质破坏组的蛋白表达量低于未破坏组(P<0.05),而Bak和Bim在两组间的表达差异无统计学意义(P>0.05)。
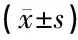
表3 骨质破坏组和未破坏组的Bak、Bim和Mcl-1表达
经Pearson相关分析,中耳胆脂瘤组织中Bak和Mcl-1的表达呈正相关(r=0.484,P<0.01),在中耳胆脂瘤组织中Bim和Mcl-1的表达呈正相关(r=0.466,P<0.01),中耳胆脂瘤组织中Bim和Bak的表达呈正相关(r=0.995,P<0.01)。
Tunel染色显示在胆脂瘤组和对照组均有细胞凋亡,在正常外耳道皮肤中,凋亡细胞较稀疏,主要位于颗粒层;在胆脂瘤上皮中,在上皮全层均有大量凋亡细胞,凋亡指数明显升高,两组差异有显著统计学意义(P<0.01)(表4),骨质破坏组和未破坏组的凋亡指数差异无统计学意义(P>0.05)(表5)。
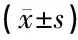
表4 胆脂瘤组和对照组Tunel凋亡指数比较
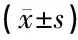
表5 骨质破坏组和未破坏组Tunel凋亡指数比较
3 讨论
Bcl-2家族成员的特点是至少含有1个Bcl-2同源结构域(Bcl-2 homology domain ,BH),根据它们在细胞凋亡中的功能和拥有BH结构域的数量分为三组:①抗凋亡Bcl-2蛋白(Bcl-2,Bcl-xL和Mcl-1),含BH1-BH4四个结构域,通过结合促凋亡蛋白抑制细胞凋亡;②多结构域促凋亡蛋白(Bax和Bak),含BH1-BH4结构域,可直接促进线粒体外膜通透性改变;③仅含BH-3结构域的促凋亡蛋白(Bid和Bim)[9]。
Bim在生理和病理生理条件下是启动内在凋亡途径的必需促凋亡蛋白[10]。Singh等[11]研究发现Bim与抗凋亡的Mcl-1结合而不与Bcl-2或Bcl-XL结合;中断Mcl-1和Bak之间的相互作用,导致Bak从Mcl-1解离,并激活Bak[12],引起线粒体外膜通透性改变、细胞色素C释放和内在细胞凋亡途径活化[13]。Bim与Mcl-1的结合稳定了后者[14],Bim解离导致促凋亡Bim和抗凋亡Mcl-1两者去稳定化,这是决定细胞是否凋亡的效应。从本研究结果看,促凋亡的Bak和Bim蛋白以及抑制凋亡的Mcl-1蛋白在胆脂瘤中的表达均明显高于正常皮肤,同时Tunel染色结果表明与正常皮肤相比,胆脂瘤凋亡明显增加,与Juhasz等[15]研究结果一致,说明在胆脂瘤中促凋亡蛋白与抗凋亡蛋白之间可能出现了平衡紊乱,使细胞过度增殖的同时凋亡也加速,从而引起胆脂瘤的形成,这也可能是胆脂瘤不像恶性肿瘤一样无限增殖的原因之一。也有学者认为胆脂瘤中凋亡受到抑制[4,5],可能与胆脂瘤细胞凋亡过程是多基因相互作用共同完成而非相互独立有关;本研究结果显示Bak、Bim和Mcl-1在中耳胆脂瘤组织中的表达之间两两呈正相关,但Bak、Bim与Mcl-1的相关系数较低,考虑可能的原因为Bak、Bim与Mcl-1之间可能不是直接相互作用,而是通过其它蛋白起间接调控作用,凋亡的调控是多基因共同作用的,多通路共同介导,可能对蛋白与蛋白之间的相互作用产生一定的影响,还可能与样本含量不足以及个体差异性有关。
胆脂瘤骨质破坏是由多种因素造成的,如:上皮增生、细菌感染、鼓室压力增加、破骨细胞活化、酸度增加、骨破坏酶活性升高、炎性介质等[16]。既往主导理论认为破骨细胞在骨吸收中发挥关键作用[17],但最近研究揭示破骨细胞不参与胆脂瘤的骨质破坏过程[18,19],而胆脂瘤的角蛋白碎片和上皮细胞呈弱酸性[20],且上皮细胞的通透性与正常皮肤相比增加[21],故推测胆脂瘤上皮的酸泄露可能是造成骨质脱钙和骨质吸收的主要原因[22]。从本研究结果看,Mcl-1在骨质破坏组的表达低于未破坏组,说明Mcl-1可能与胆脂瘤的骨质吸收有关,结合上述其他学者的研究,推测其可能机制为促凋亡蛋白与抗凋亡蛋白之间的平衡紊乱,使中耳胆脂瘤上皮凋亡增加,导致角蛋白鳞屑大量堆积,以及慢性炎症引起黏膜肥厚,粘稠分泌物聚集,使中耳内通风引流通道[23]阻塞,组织缺氧,而缺氧不仅可刺激缺氧诱导因子使基质金属蛋白酶产生,引起骨质破坏[24],也可导致微血管闭塞,引起细胞凋亡[25],从而导致恶性循环;也可能与逐渐增大的胆脂瘤使中耳压力不断增高,从而导致压力性骨质坏死和细胞因子激活造成骨质破坏[26]有关。但文中结果显示,Tunel染色细胞凋亡在骨质破坏组与未破坏组之间无明显统计学差异,与Juhasz等[15]研究不同,他们发现非破坏性胆脂瘤中的细胞凋亡高于破坏性胆脂瘤,推测可能与样本含量不足及国内外患者的个体差异有关,今后需要进一步扩大样本量深入研究。
综上所述,Bak、Bim和Mcl-1在中耳胆脂瘤中的异常表达可能与胆脂瘤上皮的高凋亡相关,且 Mcl-1可能与胆脂瘤的骨质破坏有关。迄今为止,胆脂瘤并无有效药物治疗,只能手术切除且术后复发较常见,因此,找到凋亡调控通路中某些关键分子作为“靶点”,促使开展相应药物治疗,可为干预胆脂瘤的发展提供新的思路。
——外耳道成形技术进展

