广谱抗稻瘟病种质75-1-127的褐飞虱抗性基因鉴定及分子标记辅助选择育种
降好宇 曾盖 郝明 黄湘桂 肖应辉
广谱抗稻瘟病种质75-1-127的褐飞虱抗性基因鉴定及分子标记辅助选择育种
降好宇#曾盖#郝明 黄湘桂 肖应辉*
(湖南农业大学 农学院/水稻油菜抗病育种湖南省重点实验室/南方粮油作物协同创新中心, 长沙 410128;#共同第一作者;*通讯联系人, E-mail: xiaoyh@hunau.edu.cn)
【目的】水稻品系75-1-127携带广谱抗稻瘟病基因,已被广泛应用于抗稻瘟病水稻品种改良。笔者育种实践发现75-1-127表现出较强的褐飞虱抗性,因此鉴定该品系中的褐飞虱抗性基因并进行分子辅助选择育种。【方法】根据水稻品系B5中褐飞虱抗性基因和的序列,设计引物扩增75-1-127的基因组DNA,并对PCR产物进行测序分析。采用苗期集团法鉴定了75-1-127和B5的褐飞虱抗性表型。利用与与连锁的分子标记筛查了75-1-127为稻瘟病抗源回交转育的两系不育系后代,并鉴定了这些后代的稻瘟病抗性、褐飞虱抗性和主要农艺性状。【结果】75-1-127中含有与B5完全一致的和序列。75-1-127和B5苗期褐飞虱抗性均为1级。在以75-1-127为抗源改良的两系不育系中,携带、的单基因系或双基因系的褐飞虱抗性均得以改良,其中双基因聚合系的死苗率为8.5%,与供体亲本75-1-127以及阳性对照B5差异不显著,进一步证实75-1-127含有褐飞虱抗性基因。【结论】水稻品系75-1-127携带褐飞虱抗性基因和,可以作为抗源应用于水稻褐飞虱抗性育种。
水稻;褐飞虱抗性;;;分子标记辅助育种
褐飞虱是单食性刺吸式害虫,吸食维管束内汁液造成植物萎蔫、死亡,同时传播草状丛矮病和齿叶矮缩病等病毒诱发水稻病害,是我国南方稻区的主要害虫之一[1]。褐飞虱平均每年为害我国水稻面积约2.467亿hm2,年均损失稻谷1.12亿kg[2],而且其繁殖力强、生长周期短和远距离迁飞特性,我国南方稻区褐飞虱危害呈逐年加剧趋势。施用化学农药是防治稻飞虱的最常用手段,然而化学防治增加生产成本,加剧环境污染,杀伤害虫的天敌,尤其是长期施用造成稻飞虱种群抗药性不断增强,不利于稻作可持续发展[3]。水稻在与褐飞虱共进化的过程中,形成了多种有效的抗性机制[1],其中利用抗性基因培育抗性品种是抵御和防治褐飞虱危害最有效的途径[4]。
Pathak等[5]报道水稻中存在抗褐飞虱基因,自此各国相继开展了水稻褐飞虱抗性基因的发掘工作。迄今,从栽培稻和野生稻挖掘的水稻抗褐飞虱主效基因至少有31个[4,6-10],除、以外的29个抗性基因均已定位[11-12]。其中,[13]、[14]、[15]、[16]、[10]、[17]、[18]和[19]等13个褐飞虱抗性基因已成功克隆,为通过分子标记辅助选择和转基因技术培育抗虫新品种提供了优异的抗性资源。
和是武汉大学从药用野生稻衍生的水稻品系B5中鉴定的2个显性主效抗褐飞虱基因,对褐飞虱生物型1、2型具有高抗性[1]。是水稻中克隆的抗褐飞虱基因,编码由1323个氨基酸组成的NBS-LRR家族蛋白,该基因通过抗生作用发挥抗褐飞虱功能[13]。编码一种凝集素类受体蛋白激酶,通过与OsADF互作调控防卫基因的表达,进而抵御褐飞虱的危害[20]。利用杂交、连续回交及分子标记辅助技术将和基因导入杂交稻恢复系,发现恢复系及其配制的杂交组合的褐飞虱抗性均得到显著改良[21-23];将和基因渗入粳稻品种或者两系不育系遗传背景,均有显著增强褐飞虱抗性的效果[24-26]。
是从四倍体小粒野生稻与栽培稻远缘杂交、回交构建的渗入系75-1-127中克隆的第一个水稻广谱抗稻瘟病基因,对来自13个国家的43个稻瘟病菌株均表现出很高的抗性[27],被广泛用于分子标记辅助选择育种实践改良水稻稻瘟病抗性[28-30]。近年,笔者分别利用75-1-127和B5为稻瘟病和褐飞虱抗性基因的供体亲本,开展了C815S、帮191S等水稻两用核不育系的抗性基因聚合育种研究[31],育种实践中发现75-1-127的褐飞虱抗性表现突出,并且在和基因附近开发的DNA标记不能有效区分75-1-127与B5间的多态性。因此,本研究比较了两水稻品系目标基因的DNA序列和褐飞虱抗性,并进一步对源于75-1-127系谱的改良株系进行了和基因的DNA分子标记筛选和褐飞虱抗性鉴定,旨在鉴定出75-1-127中的褐飞虱抗性基因,并利用其创制聚合稻瘟病和褐飞虱抗性基因的新种质。
1 材料与方法
1.1 试验材料
受体亲本为水稻光温敏两用核不育系帮191S(B191S),稻瘟病抗性供体亲本75-1-127,褐飞虱抗性供体亲本B5。分别采用CO39和TN1作为稻瘟病和褐飞虱抗性鉴定的阴性对照。所有试验材料种子均由湖南农业大学水稻科学研究所提供。

表1 用于Bph14和Bph15基因测序的PCR引物
表2 用于稻瘟病和褐飞虱抗性基因型分析的分子标记
1.2 试验方法
1.2.1 材料种植
所有试验材料夏季和冬季分别种植在湖南长沙湖南农业大学试验基地和海南三亚试验基地。改良不育系材料在长沙种植时,当不育系幼穗分化处于Ⅳ至Ⅵ期,采用20℃~22℃的低温冷水串灌,诱导植株育性转换。在海南种植时,一般将育性敏感期安排在1~2月份,利用自然低温诱导植株恢复育性自交繁种。
1.2.2 DNA测序
分别提取水稻材料75-1-127和B5的全基因组DNA,委托华智水稻生物技术有限公司进行和基因的序列测定。区间的2个抗性效应基因分别命名为和[13];编码凝集素类受体蛋白激酶(lectin receptor-like kinase,)[20],在定位区间包含3个基因,分别命名为、和。根据参考序列设计PCR扩增引物(表1),获取目的基因转录起始位点至转录结束位点产物,并进行PCR产物测序。
1.2.3 植株基因型分析
根据文献[21, 32],筛选在亲本75-1-127和B191S间多态性较好的引物RM7311和RM7178,用于抗稻瘟病基因的筛选;筛选出InDel标记76-2和SSR标记MS5分别用于抗褐飞虱基因和的分析(表2)。PCR采用10 μL反应体系:10×缓冲液1.0 μL,5 mmol/L dNTPs 0.2 μL,2 μmol/ L引物1.0 μL,5 U/μL酶0.1 μL,DNA模板(约10 ng/μL)1.0 μL,ddH2O 6.7 μL。引物由Invitrogen公司合成,其他试剂购自上海TaKaRa公司。PCR扩增程序如下:95℃下预变性5 min;95℃下30 s;55℃下30 s,72℃下1 min,共35个循环;最后72℃下延伸7 min。PCR产物采用8%的非变性聚丙烯酰胺凝胶电泳分离,银染显色后根据带型分析基因型。
1.2.4 稻瘟病抗性鉴定
2018年夏季,在位于湖南浏阳大围山的稻瘟病圃采用大田接种法鉴定稻瘟病抗性。于5月13日播种改良不育系及其受体亲本B191S,将诱发品种CO39播种在试验材料周边,播种后7 d,将提前在温室接种发病的植株秧苗移栽在诱发品种周边。播种后约30 d,CO39秧苗基本枯死,每份材料取15株按国际水稻研究所稻瘟病抗性评价分级标准[33]调查发病等级,取平均值为该株系的发病等级。
1.2.5 稻飞虱抗性鉴定
参照黄得润等[34]的苗期集团鉴定法鉴定褐飞虱抗性。每一类基因型任选一个株系为样本,S171002、S171008和S171005分别代表单基因系、单基因系以及和聚合系。分别采用TN1和B5为感虫对照和抗虫对照,同时放入受体亲本B191S和供体亲本75-1-127。供试材料统一浸种催芽破胸后播种于小塑料钵(直径15 cm,高5 cm),每株系播3盆,每盆约播种50粒。待秧苗长至4叶1心时,按每株5~7头2~3龄若虫的标准接种褐飞虱,当感虫对照品种TN1死苗率达到95%时,根据各株系水稻死苗率评定抗性级别[31,34]。
1.2.6 农艺性状鉴定
2018年夏季,所有试验材料种植在湖南长沙县江背镇的北大荒垦丰种业湖南育种站试验基地,4月18日播种,5月14日移栽,每个株系田间分小区顺序排列种植,每小区种2行,每行8株,单本栽植,株行距为20 cm×20 cm。齐穗期后每小区随机取3株生长正常的植株,随机选取16~20个单株考查株高、穗长、每穗颖花数、柱头外露率等主要农艺性状。
1.2.7 数据处理
采用Excel 2010进行处理数据,用DPS 9.5进行方差分析。采用Duncan新复极差法进行多重比较。

图1 稻瘟病抗性基因分子标记辅助选择转育程序
Fig. 1. Procedure of rice blast gene transfer with molecular marker-assisted selection.
2 结果与分析
2.1 稻瘟病抗性基因Pi9的回交转移及分子标记辅助选择
2011年夏季,采用B191S为受体亲本,以携带广谱抗稻瘟病基因的水稻品系75-1-127为供体亲本配制杂交组合,并收获杂交种子。于同年冬季在海南三亚种植F1,与B191S回交获得BC1F1种子。在BC1F1和BC2F1世代,采用与基因连锁的标记RM7311、RM7178分析各植株的基因型,选择标记基因型杂合、田间农艺性状优良的单株作父本混合授粉B191S,获得回交种子。在BC3F1世代,依据上述标准选择单株自交收种获得BC3F2种子。2013年冬季,在海南种植BC3F2植株,采取连锁标记对基因进行筛选,在标记基因型纯合单株中,根据田间农艺性状选择优良单株自交收种。此后连续多代自交繁殖,并逐代针对改良不育系的育性、异交特性、稻米品质等性状进行鉴定和选择。至2018年夏季,获得改良的BC3F11植株(图1)。
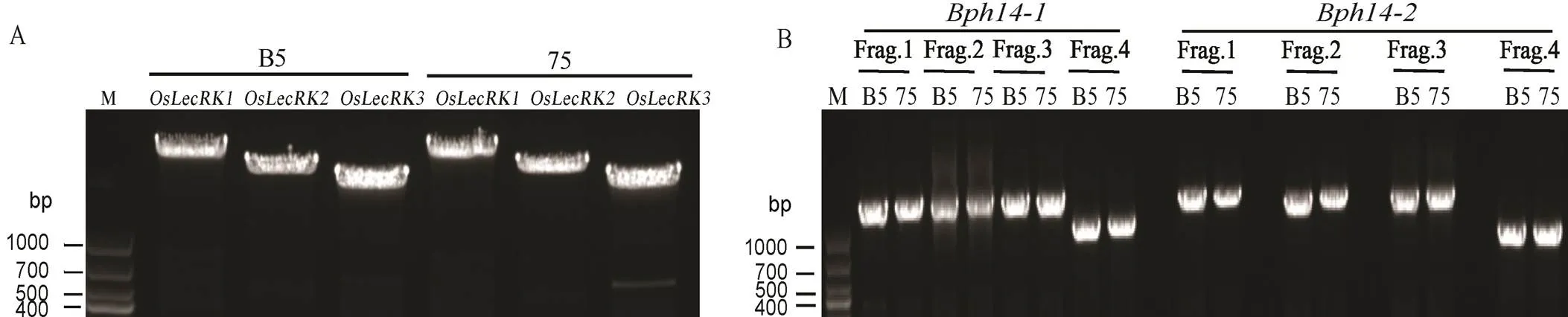
75, 75-1-127.
Fig. 2. PCR products ofandgene.

表3 75-1-127与B5中抗褐飞虱基因Bph14和Bph15序列相似性分析
序列位置是根据对应基因在GenBank中的碱基序列标定。
The location of sequence is based on the base sequence of the corresponding gene in GenBank.
2.2 水稻品系75-1-127和B5中褐飞虱抗性基因Bph14和Bph15的序列比较
根据参考序列设计引物,对目的基因转录起始位点至结束位点的PCR产物进行测序,结果显示,B5和75-1-127两份材料中均含有、和(图2),经BLAST分析两份材料的基因编码区序列完全一致(表3),表明水稻品系75-1-127中包含褐飞虱抗性基因和。
2.3 改良系中褐飞虱抗性基因Bph14和Bph15的筛查
采用与连锁的InDel标记76-2、与连锁的SSR标记MS5,分析了B191S为受体亲本、75-1-127为供体亲本的18个回交株系的标记基因型,鉴定到3个株系为纯合标记基因型,6个株系为纯合标记基因型,仅有2个株系同时为纯合与标记基因型,其余7个株系和标记基因型均为非抗性类型。

表4 B191S不同基因型改良系的稻瘟病抗性
#感病级数为平均值±标准差(=株系数×15);**表示改良系与受体亲本B191S的稻瘟病感病级数在1%水平差异显著。
#Values are mean±(=number of lines×15);**Means significant difference between improved lines and B191S at 1% level.

表5 B191S不同基因型改良系的褐飞虱抗性
#死苗率为平均值±标准差(=3);数字后的大小写字母相同者分别表示在1%和5%水平上差异不显著。
#Values are mean±(=3); The same capital and lowercase letters mean no significant difference at 1% and 5% levels, respectively.
2.4 改良材料的稻瘟病抗性鉴定
采用田间病圃对基于B191S背景、包含不同抗性标记基因型的各株系进行了稻瘟病抗性鉴定,感病对照CO39和受体亲本B191S的感病级数分别为8.7级和7.3级(表4)。与受体亲本B191S相比,包含单一稻瘟病抗性基因的B191S()、聚合和单一褐飞虱抗性基因的B191S(+)和B191S(+)以及聚合和2个褐飞虱抗性基因的B191S(++)感病级数均显著下降,而B191S()、B191S(+)、B191S(+)和B191S(++)的稻瘟病抗性未表现出显著差异。

表6 改良株系的主要农艺性状
除播始历期外,其余性状值为平均值±标准差(=16~20);**表示改良系与受体亲本B191S的相应性状在1%水平差异显著。
Trait values are mean±except duration from seeding to heading(=16~20);**means significant difference between improved lines and B191S at 1% level.

图3 改良材料的褐飞虱抗性鉴定
Fig. 3. Brown planthopper resistance of the improved lines and the parents.
2.5 改良材料的褐飞虱抗性鉴定
B191S和TN1苗期接虫鉴定后死苗率达100%,表现为高感;B5和75-1-127苗期抗性级别均为1级,表现为高抗,两者无显著差异(表5、图3)。改良株系中,单基因系的死苗率为41.8%,抗性显著低于供体亲本75-1-127或者双基因聚合系;而单基因系或者/双基因聚合系的死苗率分别为11.5%和8.5%,与75-1-127死苗率差异不显著。进一步证实75-1-127含有褐飞虱抗性基因和,并且采用与B5中褐飞虱抗性基因相同的分子标记辅助选择同样有效。
2.6 改良材料的农艺性状分析
与受体亲本B191S相比,改良株系的播始历期、株高、穗长、每穗颖花数、双边柱头外露率和柱头外露率等主要农艺性状都发生了较大变化(表6)。受体亲本B191S是一个早稻类型的两系不育系,播始历期仅为81 d,改良不育系播始历期较受体亲本延长4~9 d,可望配制生育期较长的中晚稻组合。伴随着株高的显著增高,穗长、每穗颖花数等性状值也相应增大。值得注意的是,改良株系的柱头外露率显著改善,较受体亲本提高了5.7~7.3个百分点,尤其是双边柱头外露率提高了7.6~8.8个百分点。
3 讨论
本研究通过PCR产物测序证实75-1-127和B5存在相同的和基因序列,褐飞虱苗期集团鉴定结果也表明75-1-127表现出与B5水平相当的褐飞虱抗性,推断75-1-127携带有褐飞虱抗性基因和。采用与水稻品系B5中抗褐飞虱基因与相同的DNA分子标记,对75-1-127回交转育的两系不育系进行DNA分子标记筛选,发现聚合和基因的株系与供体亲本75-1-127、阳性对照品种B5苗期抗性水平基本相当(表5),进一步证实上述推断是正确的。
因携带稻瘟病广谱抗性基因,75-1-127已被广泛应用于不同生态区域的稻瘟病抗性改良育种中[28-30],本研究的发现将进一步拓宽其育种应用价值。一方面,利用75-1-127作为抗源进行水稻品种抗性改良,可以同时对稻瘟病抗性基因和褐飞虱抗性基因和进行筛选,同步改良褐飞虱和稻瘟病抗性,将大大加速育种进程。另一方面,本研究也提示以往采用75-1-127为稻瘟病抗源改良的后代材料中,可采用与和连锁的分子标记进行筛查,可望获得同时兼抗稻瘟病和褐飞虱的新种质。
B5是由两倍体或四倍体CC染色体组的药用野生稻衍生而来[1],后者主要分布在亚洲热带、亚热带和澳大利亚热带地区[35]。75-1-127是小粒野生稻与栽培稻远缘杂交、回交构建的渗入系[27],四倍体BBCC染色体组的小粒野生稻分布于菲律宾以及巴布亚新几内亚等亚洲热带地区[35]。暗示起源于低纬度热带地区或者CC染色体组的野生稻中可能蕴含丰富的褐飞虱抗性基因,这种类型的水稻种质在褐飞虱抗性基因挖掘研究中值得重视。
[1] Jing S L, Zhao Y, Du B, Chen R Z, Zhu L L, He G C. Genomics of interaction between the brown planthopper and rice., 2017, 19: 82-87.
[2] 蒋春先. 广西兴安地区稻纵卷叶螟和稻飞虱发生规律及迁飞规律的研究. 北京: 中国农业科学院, 2012. Jiang C S. Occurrence and migration characteristics of rice leaf roller and rice planthopper in Xingan Guangxi. Beijing: Chinese Academy of Agricultural Sciences, 2012. (in Chinese with English abstract)
[3] 王佳妮, 丁波英, 王璐, 王喆, 周国鑫, 娄永根. 外源油菜素甾酮处理水稻对褐飞虱取食和产卵选择性等行为的影响. 植物保护学报, 2018, 45(5): 998-1004. Wang J N, Ding B Y, Wang L, Wang Z, Zhou G X, Lou Y G. The effects of exogenous castasterone treatment on rice brown planthopperbehaviors, with special reference to feeding and ovipositing preferences., 2018, 45(5): 998-1004. (in Chinese with English abstract)
[4] Hu J, Xiao C, He Y Q. Recent progress on the genetics and molecular breeding of brown planthopper resistance in rice., 2016, 9: 30.
[5] Pathak M D, Cheng C H, Fortuno M E. Resistance toandin varieties of rice., 1969, 223: 502-504.
[6] Cheng X Y, Zhu L L, He G C. Towards understanding of molecular interactions between rice and the brown planthopper., 2013, 6: 621-634.
[7] Fujita D, Kohli A, Horgan F G. Rice resistance to plant hoppers and leaf hoppers., 2013, 32: 162-191.
[8] Kobayashi T. Evolving ideas about genetics underlying insect virulence to plant resistance in rice–brown planthopper interactions., 2016, 84: 32-39.
[9] Yang L, Zhang W L. Genetic and biochemical mechanisms of rice resistance to planthopper., 2016, 35(8): 1559-1572.
[10] Wang Y, Cao L M, Zhang Y X, Cao C X, Liu F, Huang F K, Qiu Y F, Li R B, Lou X J. Map-based cloning and characterization of, a B3 domain-containing recessive gene conferring brown planthopper resistance in rice., 2015, 66: 6035-6045.
[11] Jena K K, Kim S M. Current status of brown planthopper (BPH) resistance and genetics., 2010, 3: 161-171.
[12] Yang L, Li R B, Li Y R, Huang F K, Chen Y Z, Huang S S, Huang L F, Liu C, Ma Z F, Huang D H, Jiang J J. Genetic mapping of(t) and(t)loci conferring brown planthopper resistance toStål in rice (L. )., 2011, 183: 161-171.
[13] Du B, Zhang W L, Liu B F, Hu J, Wei Z, Shi Z Y, He R F, Zhu L L, Chen R Z, Han B, He G C. Identification and characterization of, a gene conferring resistance to brown planthopper in rice., 2009, 106: 22 163-22 168.
[14] Liu Y Q, Wu H, Chen H, Liu Y L, He J, Kang H Y, Sun Z G, Pan G, Wang Q, Hu J L, Zhou F, Zhou K N, Zheng X M, Ren Y L, Chen L M, Wang Y H, Zhao Z G, Lin Q B, Wu F Q, Zhang X, Guo X P, Cheng X N, Jiang L, Wu C Y, Wang H Y, Wan J M. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice., 2015, 33: 301-305.
[15] Lv W T, Du B, Shangguan X X, Zhao Y, Pan Y F, Zhu L L, He Y Q, He G C. BAC and RNA sequencing reveal the brown planthopper resistance genein a recombination cold spot that mediates a unique defense mechanism., 2014, 15: 674.
[16] Tamura Y, Hattori M, Yoshioka H, Yoshioka M, Takahashi A, Wu J, Sentoku N, Yasui H. Map-based cloning and characterization of a brown planthopper resistance genefromL. ssp.cultivar ADR52., 2014, 4: 5872.
[17] Ji H, Kim S R, Kim Y H, Suh J P, Park H M, Sreenivasulu N, Misra G, Kim S M, Hechanova S L, Kim H, Lee G S, Yoon U H, Kim T H, Lim H, Suh S C, Yang J, An G, Jena K K. Map-based cloning and characterization of thegene from wild rice conferring resistance to brown planthopper (BPH) insect pest., 2016, 6: 34376.
[18] Zhao Y, Huang J, Wang Z Z, Jing S G, Wang Y, Ouyang Y D, Cai B D, Xin X F, Liu X, Zhang C X, Pan Y F, Ma R, Li Q F, Jiang W H, Zeng Y, Shangguan X X, Wang H Y, Du B Zhu L L, Xu X, Feng Y Q, Yang S, Chen R Z, Zhang Q F, He G C. Allelic diversity in an NLR geneenables rice to combat planthopper variation., 2016, 113: 12850-12855.
[19] Ren J S, Gao F Y, Wu X T, Lu X J, Zeng L H, Lv J Q, Su X W, Luo H, Ren G J., a novel gene encoding an unknown SCR domain containing protein, confers resistance against the brown planthopper in rice., 2016, 6: 37645.
[20] Cheng X Y, Wu Y, Guo J P, Du B, Chen R Z, Zhu L L, He G C. A rice lectin receptor-like kinase that is involved in innate immune responses also contributes to seed germination., 2013, 76: 687-698.
[21] 李进波, 夏明元, 戚华雄, 何光存, 万丙良, 查中萍. 水稻抗褐飞虱基因和的分子标记辅助选择. 中国农业科学, 2006, 39(10): 2132-2137. Li J B, Xia M Y, Qi H X, He G C, Wan B L, Zha Z P. Marker-assisted selection for brown planthopper (Stål) resistance genesandin rice., 2006, 39(10): 2132-2137. (in Chinese with English abstract)
[22] Hu J, Li X, Wu C J, Yang C J, Hua H X, Gao G J, Xiao J H, He Y Q. Pyramiding and evaluation of the brown planthopper resistance genesandin hybrid rice., 2012, 29(1): 61-69.
[23] 阎勇, 粟学俊, 梁曼玲, 黄凤宽, 陈彩虹. 抗褐飞虱基因和杂交稻的分子标记辅助选育与抗性评价. 分子植物育种, 2015, 13(7): 1450-1456. Yan Y, Su X J, Liang M L, Huang F K, Chen C H. Resistance evaluation and marker-assisted selection (MAS) for brown planthopper resistance genesandin hybrid rice., 2015, 13(7): 1450-1456. (in Chinese with English abstract)
[24] 蔡之军, 周德银, 高荣村, 王建华, 李金军. 水稻抗褐飞虱基因和在粳稻育种上的应用. 江苏农业学报, 2016, 32(2): 257-261. Cai Z J, Zhou D Y, Gao R C, Wang J H, Li J J. Application of brown planthopper-resistant genesandinrice breeding., 2016, 32(2): 257-261. (in Chinese with English abstract)
[25] 徐晓明, 程攀, 陈龙, 曲姗姗, 阴云伙, 田发春, 彭炳生, 吴帅, 李土明, 周卫营. 应用分子标记辅助选育抗褐飞虱水稻两系不育系. 安徽农业科学, 2016, 44(20): 107-108, 213. Xu X M, Cheng P, Chen L, Qu S S, Yin Y H, Tian F C, Peng B S, Wu S, Li T M, Zhou W Y. Breeding TGMS lines with resistance to brown planthopper by marker-assisted selection., 2016, 44(20): 107-108, 213. (in Chinese with English abstract)
[26] 任西明, 向聪, 雷定强, 雷东阳. 利用分子标记辅助选择改良水稻两系不育系C815S的褐飞虱抗性研究. 杂交水稻, 2018, 33(3): 54-58. Ren X M, Xiang C, Lei D Q, Lei D Y. Improvement of BPH resistance of rice TGMS line C815 through molecular marker-assisted selection., 2018, 33(3): 54-58. (in Chinese with English abstract)
[27] Qu S H, Liu G F, Zhou B, Bellizzi M, Zeng L Y, Dai L Y, Han B. Wang G L. The broad-spectrum blast resistance geneencodes a nucleotide-binding site-leucine-rich repeat protein and is a member of a multigene family in rice., 2006, 172(3): 1901-1914.
[28] 马文清, 裴庆利, 梁云涛, 刘丕庆, 赵开军, 王春连, 林纬, 杨培忠, 于洁. 聚合抗稻瘟病基因和抗褐飞虱基因(t)选育水稻恢复系. 分子植物育种, 2014, 12(06): 1082-1088. Ma W Q, Pei Q L, Liang Y T, Liu P Q, Zhao K J, Wang C L, Lin W, Yang P Z, Yu J. Pyramiding the blast resistant geneand the brown planthopper gene(t) to develop restorer lines in rice (L.)., 2014, 12(6): 1082-1088. (in Chinese with English abstract)
[29] 殷得所, 夏明元, 李进波, 万丙良, 査中萍, 杜雪树, 戚华雄. 抗稻瘟病基因的STS连锁标记开发及在分子标记辅助育种中的应用. 中国水稻科学, 2011, 25(1): 25-30. Yin D S, Xia M Y, Li J B, Wan B L, Zha Z P, Du X S, Qi H X. Development of STS marker linked to rice blast resistance genein marker-assisted selection breeding., 2011, 25(1): 25-30. (in Chinese with English abstract)
[30] Ni D H, Song F S, Ni J L, Zhang A F, Wang C L, Zhao K J, Yang Y C, Wei P C, Yang J B, Li L. Marker-assisted selection of two-line hybrid rice for disease resistance to rice blast and bacterial blight., 2015, 184: 1-8.
[31] 曾盖. 利用MAS改良水稻两用核不育系的稻瘟病和褐飞虱抗性[D]. 长沙: 湖南农业大学, 2017. Zeng G. Improving blast and BPH resistance of dual-purpose genic sterile rice using molecular marker-assisted selection[D]. Changsha: Hunan Agricultural University, 2017. (in Chinese with English abstract)
[32] 曹志, 曾盖, 郝明, 盛浩闻, 叶乃忠, 肖应辉. 利用MAS技术改良水稻两用核不育系C815S的稻瘟病抗性. 分子植物育种, 2015, 13(6): 1193-1200. Cao Z, Zeng G, Hao M, Sheng H W, Ye N Z, Xiao Y H. Improving blast resistance of dual-purpose genic sterile line C815S by using molecular marker-assisted selection., 2015, 13(6): 1193-1200. (in Chinese with English abstract)
[33] IRRI. Standard Evaluation System for Rice (SES). Los Banos, Philippines: IRRI, 2013: 18.
[34] 黄得润, 陈洁, 赖凤香, 刘光杰, 庄杰云. 东乡野生稻抗褐飞虱QTL分析. 作物学报, 2012, 38(2): 210-214. Huang D Y, Chen J, Lai F X, Liu G J, Zhuang J Y. Analysis of quantitative trait loci for resistance to brown planthopper in Dongxiang wild rice (Griff.)., 2012, 38(2): 210-214. (in Chinese with English abstract)
[35] 卢宝荣, 葛颂, 桑涛, 陈家宽, 洪德元. 稻属分类的现状及存在问题. 植物分类学报, 2001(4): 373-388, 394. Lu B R, Ge S, Sang T, Chen J K, Hong D Y. The current taxonomy and perplexity of the genus(Poaceae)., 2001(4): 373-388, 394. (in Chinese with English abstract)
Identification of Brown Planthopper Resistance Genes in Broad-spectrum Blast Resistant Rice Germplasm 75-1-127 and Its Molecular Marker-Assisted Selection Breeding
JIANG Haoyu#, ZENG Gai#, HAO Ming, HUANG Xianggui, XIAO Yinghui*
(,//,,;#;*Corresponding author,:)
【Objective】Rice line, 75-1-127, which harbors the broad-spectrum blast resistance gene, has been widely used in rice variety improvement for blast resistance. Given that 75-1-127 shows strong resistance to brown planthoppers in our previous breeding projects, we identified its resistance genes to brown planthoppers and used it in molecular marker-assisted selection breeding. 【Method】The PCR products, which amplified from the genomic DNA of 75-1-127 with the primers designed according to the sequence ofandgenes in rice line B5, were sequenced and analyzed. The brown planthopper resistance of 75-1-127 and B5 were also identified with seedling bulk test method. A series of two-line genic male sterile lines derived from backcross with 75-1-127 as a donor parent, were screened with the molecular markers linked toandgenes. The blast resistance, brown planthopper resistance and main agronomic traits of these progenies were also identified and evaluated. 【Result】The sequences ofandin 75-1-127 were identical with those in B5. The resistance scores at seedling stage of 75-1-127 and B5 were both grade 1. In the progenies with 75-1-127 as resistance resource, the resistances to brown planthoppers of those monogenic lines oforand thosepyramiding lines were all improved. That the seedling mortality ofpyramiding lines was 8.5%, equivalent to the donor parents 75-1-127 and the positive control B5, further confirming that 75-1-127 contained resistance genes to brown planthoppers. 【Conclusion】Rice line 75-1-127, which carries the genes ofand, could be used as resistance resource in breeding.
rice; brown planthopper resistance;;; molecular marker-assisted selection breeding
S511.03;Q943.2
A
1001-7216(2019)03-0227-08
10.16819/j.1001-7216.2019.9005
2019-01-08;
2019-02-18。
国家重点研发计划资助项目(2016YFD0101100); 湖南省科技重大专项(2015NK1001-1); 湖南省研究生科研创新项目(CX2015B255)。

