不同酿造因子对酵母菌β-葡萄糖苷酶活性的影响
陈彦雄,马腾臻,李 蔚,潘陆霞,韩舜愈
(1.甘肃祁连葡萄酒业有限公司,甘肃高台 734304;2.甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄与葡萄酒产业技术研发中心,甘肃兰州 730070)
香气是构成葡萄酒品质的主要因素之一,决定着产品的品种典型性和产地风格[1]。葡萄汁和葡萄酒中呈花香和果香味的萜烯类、C13降异戊二烯类和苯衍生物等品种香气物质以游离态和糖苷键合态形式存在,且以键合态形式存在的风味前体物含量远高于游离态形式[2-3]。这些糖苷键合态香气物质可在酿造过程中通过酸水解或酶水解作用转化成挥发性的、可被感知的游离态香气物质,但酸水解在葡萄酒酿造条件下相当缓慢,作用有限;酶水解则因其作用条件较为温和,且迅速受到广泛关注。因此,糖苷酶在分解风味前体物及调控葡萄酒香气品质方面具有重要作用[4-5]。
β-葡萄糖苷酶(β-glucosidase,EC3.2.1.21)能够水解结合于非还原性末端的β-葡萄糖苷键,释放出β-D-葡萄糖和相应的糖苷配基,是水解键合态糖苷前体物质的关键酶[5-6]。有学者研究表明,来源于黑曲霉的商品酶制剂可使处理酒样中的单萜类物质含量显著增加,花香和果香味也更加浓郁,风味品质显著提高[7-8],但纯化该酶制剂所需成本较高,很难大规模应用于葡萄酒生产中。近年来研究表明,部分酿酒酵母和非酿酒酵母也能产生β-葡萄糖苷酶[9],从而使葡萄原料的风味特征在酒体中得到充分表达[10],对葡萄酒的风味形成具有十分重要的意义。
酵母β-葡萄糖苷酶存在于细胞外、细胞膜表面和细胞内,但只有胞外酶和胞膜酶才能水解糖苷键合态香气前体物,胞内酶的作用十分有限[11-12]。发酵结束后,酵母细胞在重力作用下沉降,作为酒泥除去,而胞外酶活性则可维持较长时期,是葡萄酒品种香气调控的关键酶。然而在酒精发酵过程中,具有 β-葡萄糖苷酶活性的酿酒酵母在葡萄酒环境条件下的产酶能力及糖苷酶活性均较低[8],葡萄醪中碳源、氮源、pH值、多酚、SO2等酿造因子对酵母β-葡萄糖苷酶活性的影响是葡萄酒酿造过程中品种香气调控亟需解决的关键问题之一。
试验以一株β-葡萄糖苷酶活力较高的商品酿酒酵母为出发菌株,通过单因素试验研究了不同酿造条件对该菌株酒精发酵过程中β-葡萄糖苷酶活性的影响,以期为葡萄酒酿造过程中酵母糖苷酶的增香应用提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
商业酿酒酵母,Vintage Red(VR),意大利Enartis公司提供。
对硝基苯基β-D-吡喃葡萄糖苷(p-NPG,4-Nitrophenyl β-D-glucopyranoside,纯度 >98%),美国Sigma公司提供;胰蛋白胨、蛋白胨、酵母浸粉,北京奥博星生物技术有限责任公司提供;柠檬酸、无水磷酸氢二钠、无水碳酸钠、肌醇、偏重亚硫酸钠、对硝基苯酚(p-NP)、葡萄糖、纤维二糖、D-麦芽糖、蔗糖、D-果糖、麦芽浸膏粉、糊精、葡萄皮、硝酸钠、硫酸铵、磷酸氢二铵(DAP)、尿素、酒石酸氢钾、L-苹果酸、柠檬酸、硫酸镁、氯化钙等,以上试剂均为国产分析纯。
YPD液体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,超纯水,pH值5.0,在121℃下灭菌20 min。
1.2 仪器与设备
HH-S型电热恒温水浴锅,金坛市恒丰仪器制造有限公司产品;H2050R型高速冷冻离心机,长沙湘仪离心机仪器有限公司产品;CP214型电子天平,奥豪斯仪器(上海)有限公司产品;紫外-可见分光光度计,Thermo Fisher scientific公司产品;SYQDSX-280B型手提式不锈钢压力蒸汽灭菌器,上海申安医疗器械厂产品;SPX-150-Ⅱ型生化培养箱,上海跃进医疗器械有限公司产品;SW-CJ-2FD型洁净工作台,苏净集团苏州安泰空气技术有限公司产品;18100摩尔型超纯水机,重庆摩尔水处理设备有限公司产品;NRY-200型空气恒温摇床,上海南荣实验室设备有限公司产品;单道移液器,德国Eppendorf公司产品;PHS-3C pH计,上海雷磁有限公司产品。
1.3 试验方法
1.3.1 菌株的活化与培养
按推荐用量(0.2 g/L)称取于4℃下保存的红佳酿活性干酵母,于38℃下复水活化30 min后接种至含有200 mL模拟葡萄汁的250 mL三角瓶中,在28℃下静置培养,每天摇瓶6次,发酵结束后(残糖量小于4 g/L)取样测定OD600值和上清液酶活,每个样品重复3次。
1.3.2 模拟葡萄汁的配制
模拟葡萄汁[13]:葡萄糖、果糖各100 g/L,酒石酸氢钾2.5 g/L,L-苹果酸3.0 g/L,柠檬酸0.2 g/L,氨基态氮1.5 g/L(酵母浸粉,含3.75%氨基态氮,折算后加入量为 16 g/L),K2HPO41.14 g/L,MgSO4·7H2O 1.23 g/L,CaCl2·2H2O 0.44 g/L, MnCl2·4H2O 0.2 mg/L,ZnCl20.135 mg/L,肌醇100 mg/L,偏重亚硫酸钠120 mg/L,烟酸 2 mg/L,吡哆醇2 mg/L,泛酸钙1 mg/L,维B10.5 mg/L,叶酸 0.2 mg/L,核黄素0.2 mg/L,维H 0.125 mg/L;超纯水,于121℃下灭菌20 min。
1.3.3 标准曲线绘制
准确称取对硝基苯酚(p-NP)139.0 mg,溶解于蒸馏水并定容至1 000 mL,分别吸取0.1,0.2,0.3,0.4,0.5,0.6 mL于10 mL容量瓶中,用浓度为1 mol/L Na2CO3溶液定容后混匀,以蒸馏水为空白,于波长400 nm处测定吸光度并绘制标准曲线[13]。
对硝基苯酚标准曲线见图1。
1.3.4 β-葡萄糖苷酶活性测定
取5 mL培养液于4℃条件下以转速8 000 r/min离心10 min,收集上清液。取100 μL上清液,加入200 μL p-NPG(浓度为40 mmol/L溶于pH值5.5柠檬酸-磷酸氢二钠缓冲溶液中,P-C缓冲液)混匀,于50℃下反应10 min,立即加入浓度为1 mol/L Na2CO3溶液2 mL终止反应并显色,于波长400 nm处测定吸光度[13],以加热失活的酶液按照同样的处理作为空白。β-葡萄糖苷酶的酶活定义为pH值5.5,温度50℃条件下,每分钟1 mL酶液催化生成的对硝基苯酚的μmol数。
酶活力计算方式如下:

式中:U——酶活力单位,U/mL;
C——对硝基苯酚的浓度,μmol/mL;
V——反应体系的体积,mL;
N——稀释倍数;
t——反应时间,min;
0.1 ——所取上清液或细胞液的体积,mL。
β-葡萄糖苷酶酶活力单位(U)定义为,在上述反应条件下,1 min时间内底物被释放出1 μmol的p-NP所需要的酶量[14]。
1.3.5 酵母细胞OD600值测定
收集1.3.4中的酵母细胞,用无菌水清洗2次,将酵母细胞重新悬浮于5 mL的无菌水中,于波长600 nm处测定其吸光度。
1.3.6 酿造条件对酵母产β-葡萄糖苷酶的影响
(1)初始碳源浓度。分别配制初始碳源质量浓度为150,175,200,225,250 g/L的模拟葡萄汁,按1.2.1方法活化并接种酵母,于28℃下静置培养10 d,取样测定OD600值及上清液酶活,重复测定2次。
(2)复合碳源种类。分别向模拟葡萄汁中加入1%以下碳源:葡萄糖、蔗糖、麦芽糖、麦芽浸膏粉、纤维二糖、糊精、果糖、葡萄皮,按1.2.1方法活化并接种酵母,于28℃条件下静置培养10 d,取样测定OD600值及上清液酶活,重复测定2次。
(3)氮源种类。将模拟葡萄汁中的酵母浸粉换成以下氮源:硫酸铵、磷酸氢二铵(DAP)、硝酸钠、尿素、酵母浸粉、蛋白胨、胰蛋白胨,其余成分不变,按1.2.1方法活化并接种酵母,于28℃下静置培养10 d,取样测定OD600值及上清液酶活,重复测定2次。
(4)有机氮与无机氮之比。以酵母浸粉和磷酸氢二铵为试材,根据有机氮与无机氮之比分别为1∶1,1∶2,2∶1,1∶3,3∶1配制模拟葡萄汁,按1.2.1方法活化并接种酵母,于28℃条件下静置培养10 d,取样测定OD600值及上清液酶活,重复测定2次。
(5)初始pH值。用柠檬酸-磷酸氢二钠缓冲溶液配制初始pH值分别为3.5,4.0,4.5,5.0,5.5,6.0的模拟葡萄汁,按1.2.1方法活化并接种酵母,于28℃下静置培养10 d,取样测定OD600值及上清液酶活,重复测定2次。
(6)SO2添加量。分别配制 SO2质量浓度为10,30,60,90,120 mg/L的模拟葡萄汁,按1.2.1方法活化并接种酵母,于28℃下静置培养10 d,取样测定OD600值及上清液酶活,重复测定2次。
(7)多酚浓度。分别配制多酚(一水合没食子酸)质量浓度为0,0.5,1.0,1.5,2.0 g/L的模拟葡萄汁,按1.2.1方法活化并接种酵母,于28℃条件下静置培养10 d,取样测定OD600值及上清液酶活,重复测定2次。
2 结果与分析
2.1 初始碳源质量浓度对酵母β-葡萄糖苷酶活性的影响
初始碳源质量浓度对酵母β-葡萄糖苷酶活性的影响见图2。

图2 初始碳源质量浓度对酵母β-葡萄糖苷酶活性的影响
碳源是维持微生物生命活动的主要能源,是产生各种代谢产物的重要元素。由图2可知,模拟酒中生物量随碳源质量浓度的升高而升高;但酶活呈先增大、后减小的变化趋势,初始碳源质量浓度为175 g/L时达到最大值。这可能是由于碳源质量浓度的升高有利于酵母细胞的生长,但含量过高时使得其他营养物质(如氮源、生长因子等)相对不足,无法提供酶合成所需的营养成分。碳源质量浓度为175 g/L时,菌株酶活最大,这可能是由于在该质量浓度下,菌株生物量较高,同时对各种物质的利用较为充分所致。而当葡萄糖质量浓度达到225 g/L和250 g/L时,酶活明显降低,这可能是由于高质量浓度的碳源对糖苷酶的酶活有抑制作用[15]。
2.2 复合碳源对酵母β-葡萄糖苷酶活性的影响
复合碳源对酵母β-葡萄糖苷酶活性的影响见图3。

图3 复合碳源对酵母β-葡萄糖苷酶活性的影响
β-葡萄糖苷酶是诱导酶,碳源是该酶合成的诱导物质,复合碳源一般比单一碳源更有利于酶的合成[16]。由图3可知,与以葡萄糖为单一碳源相比,以麦芽浸膏粉为复合碳源的模拟葡萄汁进行模拟发酵时,菌株生物量和β-葡萄糖苷酶活性均有所提升,这可能是因为麦芽浸膏粉含有丰富的低聚糖及生长因子,在促进酵母菌生长的同时可诱导其糖苷酶的合成。
2.3 不同氮源种类对酵母β-葡萄糖苷酶活性的影响
不同氮源对酵母β-葡萄糖苷酶活性的影响见图4。

图4 不同氮源对酵母β-葡萄糖苷酶活性的影响
氮源亦会影响细胞的正常生长繁殖和代谢产物的分泌[17],由图4可知,不同氮源对模拟发酵中酵母细胞生物量及β-葡萄糖苷酶活性影响很大。在上述8种氮源中,酶活性最高的是以DAP(磷酸氢二铵)为唯一氮源的模拟葡萄汁,这可能是因为DAP本身是酵母细胞生长及次级代谢产物积累过程中的优良氮源,其所含的磷酸盐是酵母细胞壁及酶合成的重要前体物[17]。模拟葡萄汁中酵母浸粉和蛋白胨等有机氮源酶活较低的可能原因是氮含量差异所致,酵母浸粉中氨基态氮的含量约为3.75%,而相同质量情况下DAP中氮含量则更高。
2.4 有机氮与无机氮比值对酵母β-葡萄糖苷酶活性的影响
有机氮与无机氮比值对酵母β-葡萄糖苷酶活性的影响见图5。

图5 有机氮与无机氮比值对酵母β-葡萄糖苷酶活性的影响
由图5可知,有机氮与无机氮比值对模拟酒中酵母细胞生物量及β-葡萄糖苷酶活性影响很大,随着有机氮与无机氮比值的增大,酶活逐渐增大,而菌体生物量逐渐降低。这可能与酵母浸粉不仅用作氮源,而且也是生长因子、多种维生素和微量元素等的来源有关[17]。
2.5 初始pH值对酵母β-葡萄糖苷酶活性的影响
初始pH值对酵母β-葡萄糖苷酶活性的影响见图6。
由图6可知,随着pH值的增大,酶活呈先增加后减小趋势,其中pH值为5.0和5.5时酶活均较高,但此时菌体生物量却较低。这可能与β-葡萄糖苷酶是一种酸性蛋白[18],在弱酸性条件下更有利于菌体产酶所致。
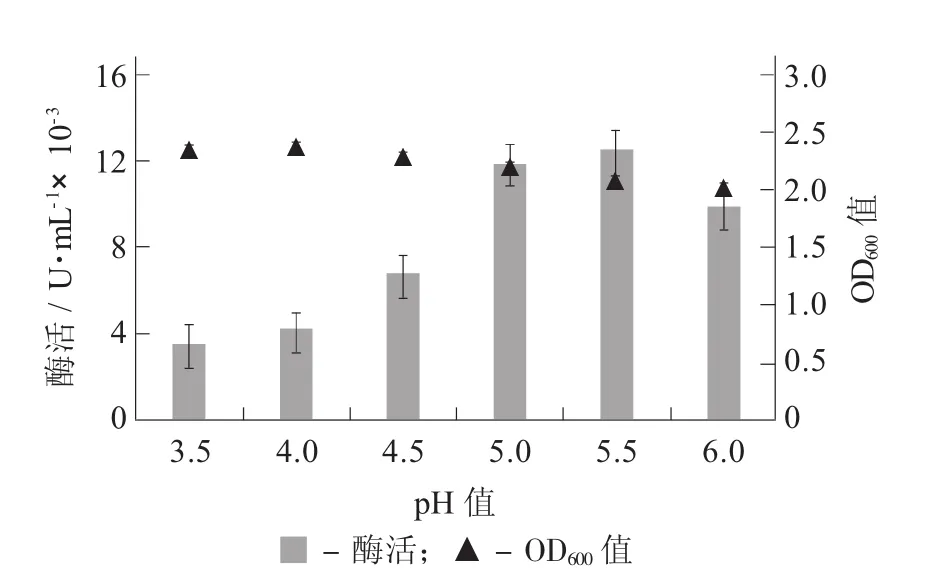
图6 初始pH值对酵母β-葡萄糖苷酶活性的影响
2.6 SO2浓度对酵母β-葡萄糖苷酶活性的影响
SO2浓度对酵母β-葡萄糖苷酶活性的影响见图7。

图7 SO2浓度对酵母β-葡萄糖苷酶活性的影响
由图7可知,不同浓度SO2对红佳酿酵母生物量的影响较小,而对其β-葡萄糖苷酶产量的影响较大,随着SO2浓度的增大,酶活先减小后增大,当SO2浓度为30 mmol/L时酶活最低,这可能是由于在低浓度(10 mmol/L)时,其对酿酒酵母的生长无影响;而当SO2浓度较高时,酵母细胞处于一种抗性环境中,其生长和繁殖周期延长所致[19]。
2.7 多酚质量浓度对酵母β-葡萄糖苷酶活性的影响
多酚质量浓度对酵母β-葡萄糖苷酶活性的影响见图8。
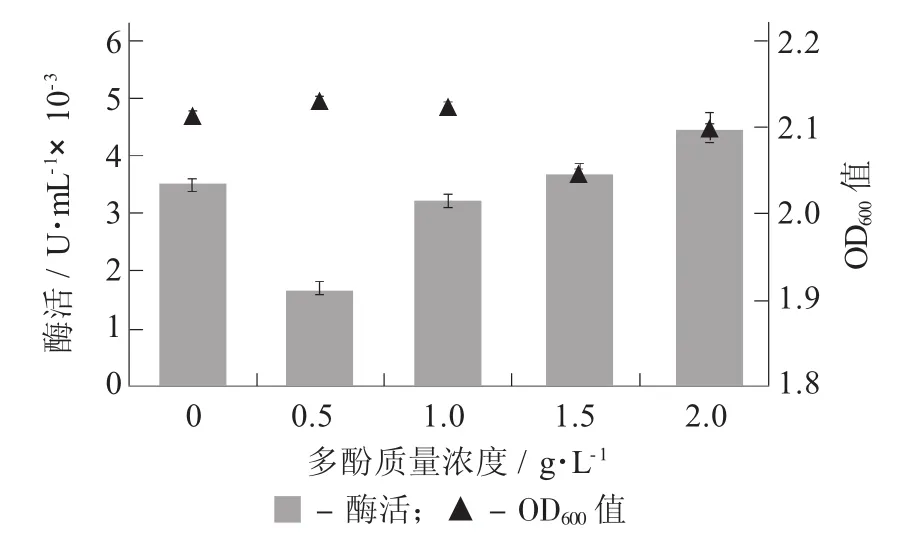
图8 多酚质量浓度对酵母β-葡萄糖苷酶活性的影响
由图8可知,多酚含量对酵母菌生物量的影响较小,但随着多酚质量浓度的增加,酵母菌酶活力呈增大趋势,其中多酚质量浓度为0.5 g/L时酶活最低,这可能是由于多酚抑制酵母特定的酶或与金属离子结合,抑制了β-葡萄糖苷酶的合成;而当多酚质量浓度较高时,其对酵母细胞的生长及繁殖有抑制作用,该环境条件下可能更有利于糖苷酶的合成[20]。
3 结论
试验结果表明,初始碳源质量浓度为175 g/L,以1%麦芽浸膏粉为附加碳源,DAP为单一氮源,有机氮(酵母浸粉)与无机氮(DAP)比例为3∶1,模拟汁初始pH值为5.5时更有利于酿酒酵母β-葡萄糖苷酶的分泌,SO2和多酚在较低浓度时对酵母产酶无影响,但较高浓度时有促进作用。

