XELOX新辅助化疗用于局部进展期低位直肠癌的效果及对癌基因表达的影响
啜东宇,林大鹏,陈玉泽,刘放
直肠癌是最常见的肠道恶性肿瘤,由于早期症状不明显许多患者至中晚期才确诊[1-2]。采取何种治疗方案最大程度优化局部进展期直肠癌患者的治疗结局,是当下研究的热点。对处于Ⅱ、Ⅲ期的局部进展期低位直肠癌患者而言,术后放化疗已经较为普及,但术前新辅助化疗应用的可行性仍存在争议。XELOX新辅助化疗由奥沙利铂、卡培他滨等化疗药物组成,已经在进展期胃癌、局部晚期食管癌等消化系统恶性肿瘤的治疗中获得成功应用[3-4],现用该方案治疗局部进展期低位直肠癌患者,探讨其应用效果及安全性,旨在为此类患者寻找更为理想的治疗方案并改善治疗结局,具体报道如下。
1 资料与方法
1.1 临床资料 选取2014年2月—2016年9月在辽宁省肿瘤医院结直肠外科接受根治性手术治疗的进展期低位直肠癌患者88例,按照随机数字表法将入组患者分为对照组、研究组各44例。对照组中男25例,女19例,年龄31~76(57.83±12.99)岁;TNM分期:Ⅱ期30例,Ⅲ期14例;肿瘤分化程度:高分化11例,中分化29例,低分化4例。研究组中男24例,女20例,年龄30~77(57.25±13.02)岁;TNM分期:Ⅱ期31例,Ⅲ期13例;肿瘤分化程度:高分化12例,中分化27例,低分化5例。2组间一般资料的比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,患者及家属同意并签属知情同意书。
1.2 选择标准 纳入标准:(1)术中所得病灶组织经病理证实为直肠腺癌;(2)肿瘤距肛门<7 cm;(3)TNM分期为临床Ⅱ期或Ⅲ期;(4)Karnofsky评分≥90分;(5)心、肝、肾功能正常。排除标准:(1)合并其他部位原发恶性肿瘤;(2)合并全身感染性疾病;(3)妊娠或者哺乳期女性。
1.3 治疗方法 研究组患者接受XELOX新辅助化疗+根治性手术治疗,具体化疗方案如下:奥沙利铂(江苏奥赛康药业股份有限公司生产)静脉滴注,130 mg/m2,d1;卡培他滨片(江苏恒瑞医药股份有限公司生产)口服,130 mg/m2,12 h/次,d1~d14。以21 d为1周期,持续化疗3个周期。上述新辅助化疗结束后行CT或者MR复查,其后行直肠癌根治术。对照组患者术前未进行化疗,直接实施直肠癌根治术。
1.4 观察指标与方法
1.4.1 手术评价: 术后比较2组患者的近远端、环周肿瘤病灶切除情况。包括R0、R1、R2切除,其中R0切除是指切缘近端、远端边缘1 mm内无肿瘤细胞残留;R1切除是指显微镜下可见癌残留灶;R2切除是指肉眼可见癌残留灶。
1.4.2 肿瘤标志物检测: 术前(研究组实施新辅助化疗前)、术后1周,均留取2组患者的外周静脉血清标本,采用酶联免疫吸附法测定其中直肠癌相关肿瘤标志物血清糖链抗原19-9(CA19-9)、糖链抗原50(CA50)、癌胚抗原(CEA)的含量。
1.4.3 癌基因表达检测: 留取术中病灶组织标本、冻存备用。参照实时荧光定量PCR法(RT-PCR)操作过程测定标本中癌基因PTTG、Smad4、Runx3、APC的mRNA表达量。设置对照组标本中上述目标基因表达量为标准值100,计算研究组标本中该基因的相对表达量。RT-PCR操作步骤如下:抽取样品RNA、测定RNA质量、样品cDNA合成、梯度稀释的标准品及待测样品的管家基因(β-actin)实时定量PCR、制备用于绘制梯度稀释标准曲线的DNA模板、待测样品的待测基因实时定量PCR,实时定量PCR使用引物列表、电泳。
1.4.4 XELOX新辅助化疗相关不良反应: 参照《国际肿瘤化疗药物不良反应评价系统——通用不良反应术语标准4.0版》评估患者恶心呕吐、中性粒细胞减少、皮疹发生情况及严重程度[5]。
1.4.5 生存率: 术后进行为期2年的随访,以术后2年或者死亡作为结点,共随访87例,失访1例,失访按最后一次随访时间计算。计算1年、2年总生存率。
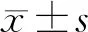
2 结 果
2.1 2组患者病灶切除情况比较 研究组患者的R0切除率为95.45%,高于对照组患者的79.55%,差异有统计学意义(P<0.01)。2组患者均未出现R2切除,见表1。
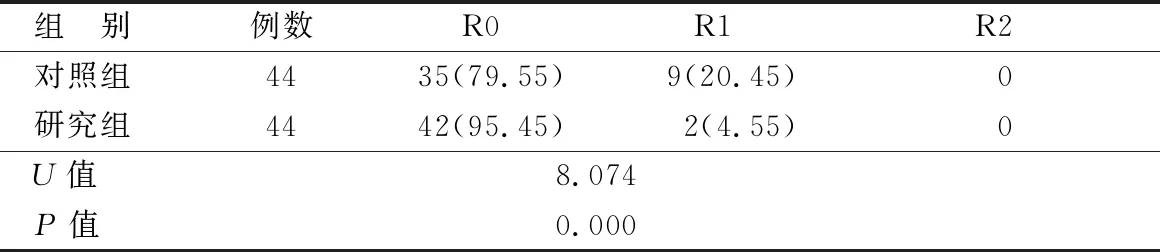
表1 2组患者的病灶切除情况比较 [例(%)]
2.2 2组患者治疗前后血清肿瘤标志物含量比较 2组术前(新辅疗前)外周血中CA19-9、CA50、CEA含量比较差异无统计学意义(P>0.05)。2组术后1周外周血中CA19-9的含量低于术前/新辅疗前(P<0.01),而手术前后CA50、CEA含量比较差异无统计学意义(P>0.05)。研究组术后1周外周血中CA19-9的含量低于对照组(P<0.01),2组术后外周血中CA50、CEA含量比较差异无统计学意义(P>0.05),见表2。
表2 2组患者治疗前后外周血中肿瘤标志物含量的比较
2.3 2组患者病灶组织中癌基因表达量比较 研究组病灶组织中PTTG、Smad4 mRNA的相对表达量高于对照组,Runx3、APC mRNA的相对表达量低于对照组,差异有统计学意义(P<0.01),见表3。
表3 2组患者病灶组织中癌基因表达量的比较
2.4 XELOX新辅助化疗相关不良反应 研究组44例患者全部完成3个周期的化疗,未因严重不良反应而终止治疗。发生3~4级不良反应9例(20.45%),其中恶心呕吐8例,中性粒细胞减少1例,经对症处理后好转,未影响手术。
2.5 2组患者术后1年、2年总生存率比较 2组患者1年OS水平差异无统计学意义(P>0.05)。研究组患者的2年OS水平高于对照组,差异有统计学意义(P<0.05),见表4。
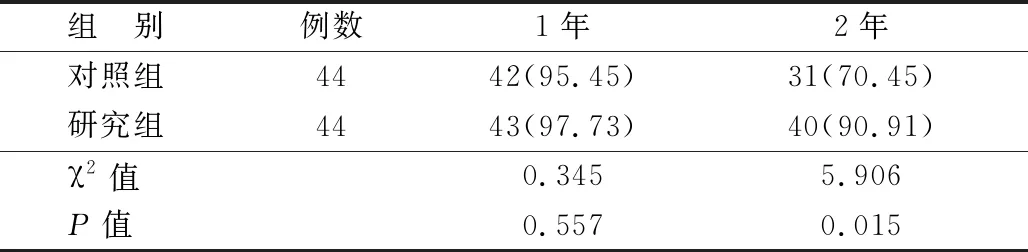
表4 2组患者术后OS比较 [例(%)]
3 讨 论
低位直肠癌是指距肛缘7 cm以内的直肠癌,早期患者预后良好,对局部进展期患者而言根治性手术仍是最主要的治疗手段,但应配伍其他方式以巩固疗效、优化生存率[6-7]。直肠癌根治术后放化疗较为普遍,但术前化疗的使用是否必要存在争议。本研究中研究组患者采取术前XELOX新辅助化疗联合直肠癌根治术的治疗方案,与未接受新辅助化疗的对照组相比,其R0切除率高达95.45%。肿瘤切除情况与其术后复发率及生存率均密切相关,是判定治疗效果的可靠指标之一,上述结果说明XELOX新辅助化疗可提升局部进展期低位直肠癌的病灶切除彻底程度,这与新辅助化疗缩小肿瘤体积、减少相关淋巴结对周围组织的侵犯直接相关。
除了上述直观表现,外周血肿瘤标志物是量化反映患者肿瘤恶性程度的常规指标。CA19-9、CA50、CEA在不同研究报道中与消化系统恶性肿瘤相关,其中CA19-9与结直肠癌的关系最为密切[8-10]。本研究中2组患者术后1周外周血中CA19-9的含量均下降,且研究组下降更为显著,而CA50、CEA在手术(新辅疗)前后均处于正常范围内且无明显差异。以上结果说明XELOX新辅助化疗可更为显著地降低直肠癌相关敏感肿瘤标志物的含量、间接反映其抑癌作用。CA50、CEA含量不发生改变与其灵敏度相关,也符合临床实际。癌基因是影响直肠癌细胞恶性行为的分子,肿瘤标志物含量发生改变也源于癌基因对直肠癌细胞的增殖、侵袭活力的促进作用。PTTG、Smad4属于原癌基因,已有研究证实其可促进直肠癌细胞恶性转移[11-12];Runx3、APC则具有抑癌作用,已在直肠癌细胞实验中发现其异常低表达[13-15]。本研究说明XELOX新辅助化疗能够有效抑制直肠癌细胞的恶性程度,这也是患者术后CA19-9含量下降的分子学原理。
XELOX新辅助化疗使用后仅出现3~4级不良反应9例,且经对症处理后均好转,未影响后续治疗实施,故具有良好的安全性。术后进行为期2年的随访发现,研究组的2年生存率达90.91%,显著高于对照组的70.45%,说明XELOX新辅助化疗在提升局部进展期低位直肠癌患者的生存率方面也有积极作用。
综上,XELOX新辅助化疗适用于局部进展期低位直肠癌患者,可提升近期及远期疗效,且不会引发严重不良反应。文中纳入病例数相对较少,可能对以上结论的准确性产生一定影响,有待后续大样本研究进一步明确。
利益冲突:无
作者贡献声明
啜东宇:负责研究设计、实施,数据收集及文章撰写;林大鹏、陈玉泽:负责标本收集及指标送检;刘放:负责研究指导及文章审校

