辅酶Q10联合Q伴侣对模型大鼠皮肤氧化损伤的改善作用
邱楚群 ,梁美婷 ,江文菁 ,吴海游 ,吕思敏 ,吴 铁 ,
(1.广东医科大学中药与新药研究所,广东 东莞 523808; 2.广东医科大学-广东润和生物科技有限公司辅酶Q10联合研究中心,广东 东莞 523808)
辅酶Q10又名泛醌,为广泛存在于生物体内的脂溶性醌环类化合物,可直接清除自由基以起到减轻氧化应激和稳定生物膜的作用[1],可协同体内的抗氧化物增强抗氧化作用,可通过抑制线粒体通透性和促进三磷酸腺苷(ATP)的生成抑制细胞凋亡[2],还可促进淋巴细胞增殖和转化而增强免疫[3-4]。Q伴侣为新型营养液,可增强辅酶Q10对皮肤的保护作用,主要成分为牛磺酸、硫辛酸等。牛磺酸为以游离氨基酸形式存在于动物体内的含硫 β-氨基酸,具有增强免疫功能、细胞膜的抗氧化能力、心脏收缩能力,保护心血管系统和维持视觉功能等广泛的生物学作用[5]。硫辛酸是由线粒体产生的含有二硫键的抗氧化剂,主要存在于心脏、肝脏和肾脏中,双硫封闭环状的化学结构使其具有较高的电子密度和亲电子性,因而具有较强的抗氧化能力,临床主要用于治疗糖尿病、帕金森综合征、心脏病、风湿病等疾病[6]。随着年龄的增长,机体抗氧化能力下降,抗氧化系统失衡,外源性补充辅酶Q10可提高机体清除自由基的能力,但辅酶Q10联合Q伴侣是否对损伤皮肤有改善作用尚不明确。本研究中观察了辅酶Q10联合Q伴侣对模型大鼠皮肤氧化损伤的改善作用,现报道如下。
1 材料与方法
1.1 材料
动物:清洁级SD健康大鼠32只,雄性,3月龄,体质量(277.93±31.18)g,由南方医科大学实验动物中心提供,实验动物合格证号为 SCXK(粤)2011-0015。实验期间大鼠自由饮水和进食,且实验方案已得到学校实验动物伦理委员会批准。
仪器:手动匀浆器(四川蜀牛玻璃仪器有限公司,规格为100 mL);5810R型高速冷冻离心机,G25005型酶标仪(德国 Eppendorf公司);B00141型手摇式切片机(上海医疗器械四厂);MGC30型光学显微镜及显微照相机(德国Leica公司)。
试药:辅酶Q10(广东润和生物科技有限公司,批号为16012120,以小麦胚芽油为溶剂,配成每100 mL含辅酶Q101 g的受试物供试品溶液);Q伴侣(由本研究室根据本项目前期申报的发明专利配方配制,专利申请号为 201610184057.0)。
1.2 方法
建模与分组、给药:将32只SD大鼠随机分为空白对照组(A组,等体积0.9%氯化钠溶液)、模型组(B组,等体积 0.9% 氯化钠溶液)、辅酶 Q10组(C 组,3 mL /kg)、辅酶 Q10联合 Q 伴侣组(D 组,3 mL /kg+3 mL /kg),各8 只。B组、C组、D组大鼠皮下注射 D-半乳糖(150mg/kg),每天1次,连续14 d,以建立皮肤氧化损伤模型[7-8];A组大鼠皮下注射 0.9%氯化钠注射液(150 mg/kg);同时各组大鼠灌胃相应药物,每天1次,连续14 d。
组织病理形态学观察与表皮厚度测定:建模成功后,取0.5 cm×0.5 cm大鼠皮肤组织于10%中性甲醛液中固定,脱水后进行石蜡包埋,切片厚度5 μm,脱蜡,苏木素-伊红(HE)染色,苦味酸酸性复红(VG)染色,封片。在光学镜显微镜下观察病理形态学,以Image-Pro Plus 6.0软件测定表皮厚度。
生化指标测定:参照试剂盒说明书[9]测定大鼠皮肤组织匀浆中丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)水平[9],试剂盒由南京建成生物工程研究所提供。
基质金属蛋白酶(MMP-1)mRNA表达水平测定:采用聚合酶链式反应法。取大鼠皮肤组织,匀浆。Trizol法提取 RNA,鉴定完RNA纯度和完整性后,反转录制备cDNA;PCR反应条件为,预变性95℃,10 min;95℃变性 15 s,60℃退火 60 s,循环 40次;60℃→90℃,每15 s升温 0.3℃。GADPH上游引物为 CACTCCCTTGGACTCACTCATT(5′-3′), 下 游 引 物 为 TGTGGTGTTGTTGCACCTGTT(5′-3′); MMP-1 上 游 引 物 为TTCCTACCCCCAATGTATCCG(5′-3′), 下 游 引 物 为CATGAGGTCCACCACCCTGTT(5′-3′)。PCR 反应结束后,定量分析PCR获得的熔解曲线和扩增曲线结果的可靠性,并设定循环阈值(Ct),以 MMP-1/GADPH 比值分别代表相对表达水平,2-ΔΔCt法计算MMP-1的相对表达水平。各组设3个复孔,重复3次。
DNA甲基转移酶(DNMT1)蛋白表达水平测定:采用Western blot法。取大鼠皮肤组织,加入1 mL RIPA蛋白裂解液,冰上匀浆,每隔5 min超声20 s,检测蛋白含量。以10%SDS-PAGE电泳后湿法电转,加入一抗,4℃ 孵育过夜,回收一抗,清洗3次,加入二抗,室温振摇1 h,回收二抗,清洗3次,加入ECL化学发光试剂,显影、定影、清洗。用Image J软件将条带灰度值数字化,目的条带与内参条带灰度比值为蛋白相对表达量[10]。
1.3 统计学处理
采用SPSS 22.0统计学软件分析。计量资料以 X±s表示,行 t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠皮肤病理形态学
A组大鼠皮肤角质层无脱落,胶原纤维排列均匀整齐;B组大鼠皮肤表皮厚度明显变薄,角质层飘起脱落,胶原纤维变粗断裂,排列紊乱;C组大鼠表皮厚度有所增加,角质层无脱落,胶原纤维排列整齐,且大小良好;D组大鼠表皮厚度明显增加,角质层无脱落,胶原纤维排列整齐,粗细均匀。详见图1。
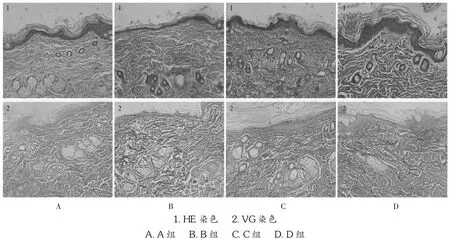
图1 各组大鼠皮肤组织病理形态学(×200)
2.2 其他观察指标
结果见表1、图2至图4。
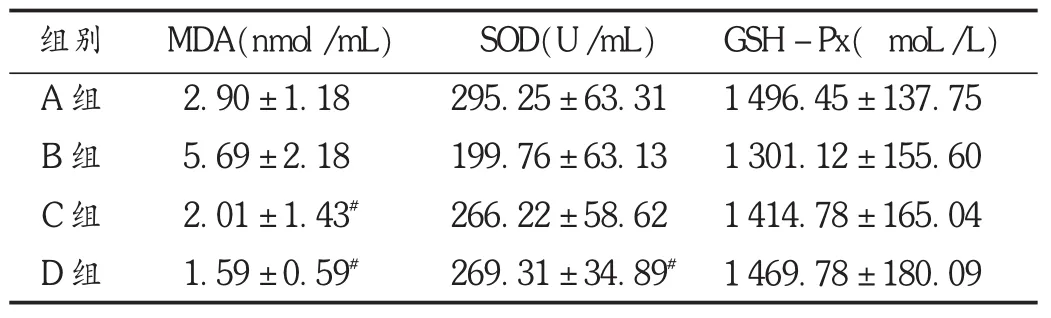
表1 大鼠皮肤组织匀浆中生化指标水平比较(X±s,n=8)
注:与 A 组比较, P <0.05;与 B 组比较,#P <0.05。

图2 各组大鼠皮肤的表皮厚度

图3 各组大鼠皮肤组织匀浆中MMP-1表达水平

图4 各组大鼠皮肤组织匀浆中DNMT1表达水平
3 讨论
本研究中采用 D-半乳糖皮下注射建立大鼠皮肤氧化损伤模型,皮肤的氧化损伤是由机体自由基(如MDA)过多造成的,正常情况下机体的抗氧化系统可以清除、转化过多的自由基,但由于机体受到外部刺激,自由基数量会成倍增加,造成抗氧化系统负担过重,无法快速地清除自由基,同时过多自由基也会攻击机体的氧化酶(如SOD,GSH-Px),导致氧化酶的活性下降,形成恶性循环[11-12]。D-半乳糖是由半乳糖氧化酶所代谢生成的半乳糖醛,半乳糖醛无法进一步代谢,这使得细胞内的渗透压升高,并产生大量自由基,造成大鼠皮肤氧化损伤[13]。模型组大鼠机体产生大量MDA,同时SOD及GSH-Px的活性减弱,造成大鼠机体的抗氧化系统失衡,导致皮肤组织的MMP-1表达水平升高与DNMT1表达水平降低,表皮厚度增加,纤维排列紊乱,皮肤出现氧化损伤情况。另一方面,D-半乳糖少量还以游离态形式存在于乳汁中,并与葡萄糖结合构成乳糖,对婴幼儿的生长发育可起到促进作用,但当大剂量食用D-半乳糖会产生严重的不良反应,这一点与 D-半乳糖造成皮肤氧化损伤的原理一致[14],故 D-半乳糖是把“双刃剑”。
辅酶Q10为机体抗氧化剂和非特异性免疫增强剂,可清除机体MDA等自由基,维护机体抗氧化系统平衡,改善氧化应激状态,起到抗氧化损伤作用[15-16]。体内辅酶Q10的水平与皮肤活性氧簇(ROS)的产生量呈负相关,当辅酶Q10含量下降到正常值的30%~50%时,皮肤组织中的ROS含量则明显增加,辅酶Q10的含量与ROS的产生增多和细胞死亡存在一定的相关性[17-18]。C组大鼠症状明显比B组大鼠轻,这是由于辅酶Q10可以维护机体的抗氧化系统平衡,同时清除机体过多的自由基,缓解氧化应激状态。Q伴侣主要含牛磺酸、硫辛酸,首先,牛磺酸可抑制瞬时受体点位TRPM2的激活,减少氧化应激,还可通过羧-氨反应减少醛类所造成的细胞损伤,也能通过抑制Caspase-3 mRNA的表达,起到抗氧化抗衰老的作用[19]。其次,硫辛酸和辅酶Q10的混合剂能对抗运动所引起的疲劳[20],硫辛酸不仅可清除自由基和再生体内的抗氧化剂,还可通过还原PMSR,使其参与到生物大分子的残基修复过程中,维持机体的稳定[6],因此Q伴侣与辅酶Q10起到了协同作用。
综上所述,辅酶Q10联合Q伴侣对模型大鼠皮肤氧化损伤有一定改善作用,其机制与抗氧化有关。参考文献:
[1]方艳娟,吴军林,吴清平,等.辅酶Q10生理功能及应用研究进展[J].食品工业科技,2014,27(14):390-395.
[2]QUINZII CM,LÓPEZ LC,GILKERSON RW,et al.Reactive oxygen species,oxidative stress,and cell death correlate with level of CoQ10deficiency[J].FASEB J,2010,24(10):3733-3743.
[3]ACOSTA MJ, VAZQUEZ FONSECA L, DESBATS MA, et al.Coenzyme Q biosynthesis in health and disease[J].Biochim Biophys Acta,2016,1857(8):1079-1085.
[4]张继忠,迟莉丽,沈亚领.辅酶Q10的生产及在医学领域中的应用[J].上海应用技术学院学报(自然科学版),2004,41(4):301-305.
[5]白小琼,孔德义.牛磺酸研究进展[J].中国食物与营养,2011,17(5):78-80.
[6]SUN JH,WANG H.(R)-alpha-ipoic acid reverses the agerelated loss in GSH redox status inpostm itotic tissues:evidence for increased cysteine requirementforGSH synthesis[J].Arch Biochem Biophys,2004,423(1):126-135.
[7]VENUS M,WATERMAN J,MCNAB I.Basic physiology of the skin[J].Surgery(Oxford),2011,29(10):471-474.
[8]XIA W,QUAN TH,HAMMERBERG C,et al.A mouse model of skin aging:fragmentation of dermal collagen fibrils and reduced fibroblast spreading due to expression of human matrix metallopoteinase-1[J].Dermatol Sci,2015,78(1):79-82.
[9]高钟禹.病理诊断与技术操作手册[M].济南:山东大学出版社,2002:54-63.
[10]彭晓敏.MiR-377通过抑制DNMT1促进人皮肤成纤维细胞衰老[D].长沙:中南大学湘雅医院,2013.
[11]BLACK HS.Potential involvement of free radical reactions in ultraviolet-light-mediated cutaneous damage[J].Photochem Photobiol,1987,46(2):213-221.
[12]LAICHEONG JE,MCGRATH JA.Structure and function of skin,hair and nails[J].Medicine,2013,41(6):317-320.
[13]HAIDER S, LIAQUAT L, SHAHZAD S, et al.A high dose of short exogenous d-galactose administration in yong male rats produces symptoms simulating the natural aging process[J].Life Sci,2015,124(3):110-119.
[14]纪秀军,闫丙健,赵彩玲.D-半乳糖诱导性亚急性衰老大鼠模型皮肤胶原代谢及相关通路分子的表达[J].中国麻风皮肤病杂志,2016,32(2):77-81.
[15]陈欢珠,崔碧玲,黄银铃,等.辅酶Q10对环磷酰胺致大鼠皮肤老化和毛囊损伤的影响[J].广东医学院学报,2015,33(6):637-639.
[16]邱楚群,吴海游,赖文秀,等.辅酶Q10对自然衰老小鼠皮肤超氧化歧化酶活性及病理学变化的影响[J].海峡药学,2017,29(3):15-18.
[17]吴海游,梁美婷,邱楚群,等.三种含辅酶Q10的防晒剂抗小鼠皮肤紫外线损伤的效果评价[J].中国皮肤性病学杂志,2017,31(4):365-399.
[18]薛建安,王可莉,魏敏吉.辅酶Q10的抗氧化与抗疲劳作用及临床应用[J].中国医药导报,2014,16(7):1167-1168.
[19]徐 玲,王庆争,杜孝贵,等.牛磺酸消炎抗氧化机理及其在幼龄动物中的应用[J].动物营养学报,2015,27(12):3683-3688.
[20]吕 鹤,马东晓. -硫辛酸辅酶 Q10混合剂对抗力竭运动疲劳的动物实验研究[D].长春:吉林体育学院,2010.

