人参皂苷Rb1对小鼠非酒精性脂肪肝病的治疗作用及其机制
韩晓春,张峰,刘长虹,张怀凤,顾良臻,刘雅楠,封俊辰,杨哲
(1山东中医药大学,济南250355;2山东中医药大学附属医院;3山东省千佛山医院)
非酒精性脂肪肝病(NAFLD)全球发病率高达25%[1],也是我国第二大类慢性肝病[2],严重影响生命健康。目前临床治疗NAFLD多以降脂、增强胰岛素敏感性和肝脏保护为主,缺乏针对性的治疗药物[3,4]。祖国医学对NAFLD治疗积累了丰富的经验,认为NAFLD病机与肝失疏泄、脾失健运有关,治疗当以除邪补虚、益气健脾为宜。人参可补虚扶正,顺应肝气运化,起到治疗NAFLD的效果,但其具体作用成分及药效缺乏实验验证。2018年3~8月,本研究构建了NAFLD小鼠模型,观察人参皂苷Rb1的治疗作用,以期丰富NAFLD治疗药物种类,为NAFLD治疗提供新的切入点。
1 材料与方法
1.1 实验动物 健康C57BL/6小鼠40只[济南朋悦实验动物繁育有限公司,许可证号SCXK(鲁)2014-0007],6周龄,雄性,体质量20~25 g,SPF级环境喂养,温度25 ℃,湿度50%~70%。
1.2 NAFLD模型制作及Rb1给药方法 40只小鼠适应性饲养1周后,按照体质量随机分为模型组30只、正常对照组10只。对照组给予MCS饲料(即蛋氨酸、胆碱完全正常的饲料)喂养,模型组给予MCD饲料(蛋氨酸、胆碱联合缺乏饲料)喂养制作NAFLD模型[5,6],饲养周期为4周。造模成功后对模型组小鼠进一步随机分组,分为模型对照组、高剂量组和低剂量组,每组10只。参考《中华人民共和国药典》(2015),高剂量组和低剂量组小鼠分别通过灌胃给予80、40 mg/(kg·d)的Rb1,给药体积为0.5 mL/kg,1次/d,连续给药15 d。
1.3 小鼠体质量、肝脏质量、脾脏质量检测 实验过程中记录小鼠体质量变化,给药15 d后处死小鼠,摘取肝脏、脾脏称重,计算肝脏系数、脾脏系数。
1.4 肝功能检测 小鼠处死后,腹主动脉取血,肝素抗凝,离心后收集血浆,采用生化分析仪(日立7600)检测血浆谷丙转氨酶(ALT)、谷草转氨酶(AST)。
1.5 血脂检测 采用生化分析仪(日立7600)检测各组小鼠血浆总胆固醇(TC)、甘油三酯(TG)。
1.6 肝组织病理检查 小鼠处死后摘除肝脏,用生理盐水稍作冲洗后以4%多聚甲醛固定,浸蜡,脱水,透明,浸蜡,包埋后切为4~8 μm的薄片,HE染色,镜下观察肝脏组织病理变化。
1.7 肝组织丙二醛(MDA)、超氧化物歧化酶(SOD)检测 小鼠处死后,迅速取出肝脏,冰上研磨后离心,取上清液,采用ELISA法检测MDA、SOD。

2 结果
2.1 各组小鼠体质量及肝、脾质量比较 模型对照组、低剂量组、高剂量组小鼠体质量、肝质量、脾质量和脾脏系数均低于正常对照组(P均<0.01)。见表1。

表1 各组小鼠体质量及肝、脾质量比较
注:与正常对照组相比,*P<0.01。
2.2 各组小鼠血浆ALT、AST水平比较 模型对照组、低剂量组、高剂量组血浆ALT、AST水平均高于正常对照组(P均<0.01),高剂量组血浆ALT、AST水平低于模型对照组和低剂量组(P均<0.05),低剂量组血浆AST水平低于模型对照组(P<0.05)。见表2。
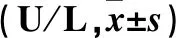
表2 各组小鼠血浆ALT、AST水平比较
注:与正常对照组相比,**P<0.01;与模型对照组相比,△P<0.05,△△P<0.01;与低剂量组相比,▽P<0.05,▽▽P<0.01。
2.3 各组小鼠TC、TG水平比较 模型对照组、低剂量组、高剂量组TC、TG水平均低于正常对照组(P均<0.05);高剂量组TC水平高于模型对照组,TG水平高于低剂量组(P均<0.05)。见表3。
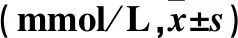
表3 各组小鼠TC、TG水平比较
注:与正常对照组相比,*P<0.05,**P<0.01;与模型对照组相比,△P<0.05;与低剂量组相比,▽P<0.05。
2.4 各组小鼠肝组织病理变化 正常对照组小鼠肝细胞无明显病变,无脂肪变性,肝小叶结构完整,细胞索排列整齐,血管周围未见炎细胞浸润。模型对照组肝细胞内可见大量脂肪变性,胞质内充满大小不一的脂滴,肝小叶内可见炎细胞浸润;低剂量组和高剂量组脂肪变性均有所减轻,脂滴大小不一,其中高剂量组血管周围炎细胞浸润程度明显好转。见图1。
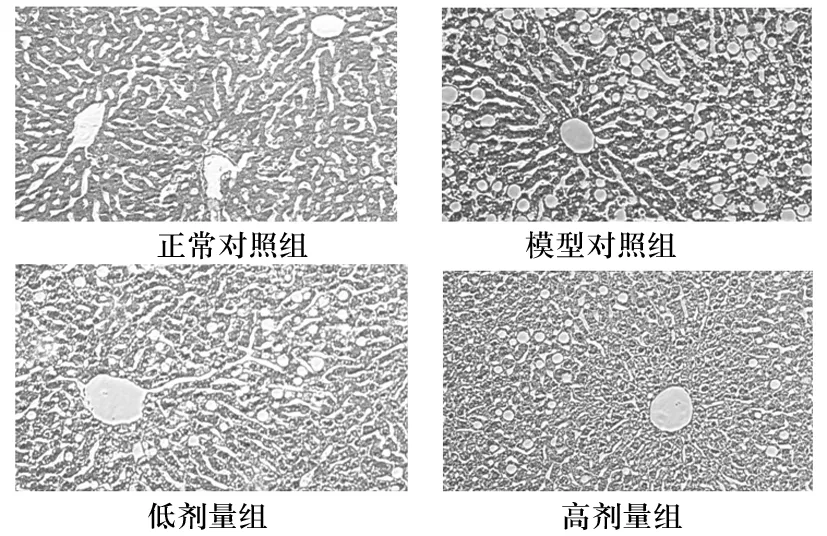
图1 各组小鼠肝组织病理变化(HE染色)
2.5 各组小鼠肝组织中MDA、SOD表达比较 模型对照组、低剂量组、高剂量组小鼠肝组织中MDA、SOD表达均高于正常对照组,高剂量组肝组织中MDA表达低于模型对照组和低剂量组,低剂量组、高剂量组肝组织中SOD表达均低于模型对照组(P均<0.01)。见表4。

表4 各组小鼠肝组织中MDA、SOD表达比较
注:与正常对照组相比,*P<0.01;与模型对照组相比,△P<0.01;与低剂量组相比,▽P<0.01。
3 讨论
NAFLD是临床常见疾病,其发生往往伴有其他代谢性疾病,如肥胖、血脂紊乱、高血压、2型糖尿病(T2DM)等[7,8]。虽然许多学者认为NAFLD为良性病变,但流行病学调查[9,10]显示有10%~20%的患者最后可发展为肝硬化,其中28%的肝硬化患者会发展成肝细胞癌乃至肝衰竭,1.7%死于肝硬化并发症。目前NAFLD发病率呈现上升趋势,但其机制不明确,也缺乏有效的防治药物。
中医经典文献中无“脂肪肝”定义,但根据其临床表现,常将其归属为“积聚”“胁痛”“痞满”等范畴。中国中医研究院朱振红等[11]根据《难经·第五十六难》中“肝之积,名曰肥气,在左胁下,如覆杯,有头足”,以肝积论之。中医理论认为,此病病位在肝,与脾、胃、肾关系密切。痰浊久聚为标,肝、脾、肾亏虚为本,本虚标实证居多。脾主运化,脾虚则运化痰浊乏力,痰湿久聚成积,积聚亦阻碍气机,加重积聚。人参甘,微温,归脾、肺、心、肾经,为后天补脾益气之要药。脾健则水湿得运,气旺则痰浊得行。除化痰湿积聚之标外,人参亦可补肝肾虚之本,标本兼顾,配以疏肝行气之品则效果益著。
近年来研究发现,人参提取物人参皂苷对酒精性脂肪肝和NAFLD均具有治疗作用。有学者[12]以人参花提取物治疗酒精性脂肪肝大鼠模型,发现治疗组血清TC、TG水平明显降低。陈静等[13]在油酸诱导HepG2细胞脂肪变模型中发现,人参皂苷Rb1能够显著降低TG含量,减轻胞内脂质堆积。彭璇等[14]发现,人参皂苷Rb1可减轻高脂饮食诱导的NAFLD大鼠模型的脂肪肝浸润现象,低剂量(5 mg/kg)即出现脂肪颗粒明显减少,高剂量组(20 mg/kg)则完全看不到脂滴。这种作用与Rb1改善肝脏脂酰CoA合成酶1(CoASH1)、肉毒碱脂酰转移酶I(CATI)、脂酰CoA氧化酶1(ACOX1)等β-氧化相关酶的功能相关。有学者[15]在高脂饮食诱导的肥胖大鼠模型中也发现,Rb1能够显著降低肝组织中TG含量,减轻肝脏质量,其作用机制与腺苷酸活化蛋白激酶的激活有关。
本研究结果也显示,Rb1对MCD诱导的小鼠NAFLD模型具有显著治疗作用。它可以保护C57BL/6小鼠肝功能,并在一定程度上调节血脂变化。从病理切片上看,Rb1可明显减少肝细胞内脂肪蓄积,减轻炎细胞浸润和坏死,缓解NAFLD病情。为研究其治疗机制,我们检测了小鼠肝组织中的MDA和SOD,结果显示,Rb1能够明显减轻NAFLD小鼠肝脏过氧化程度,具有明显的抗氧化作用,且高剂量组[80 mg/(kg·d)]效果更为显著。
氧化应激和脂质过氧化是NAFLD发病的重要机制之一[16]。TG等在肝脏蓄积,本身及其代谢产物可导致线粒体内质网代谢压力增高,引起活性氧簇(ROS)募集,并进一步诱导炎症反应,同时导致脂质过氧化的发生。SOD是机体清除ROS的重要介质,MDA则是ROS作用的终产物。MCD诱导小鼠出现SOD、MDA增高也进一步证明NAFLD存在氧化应激失衡和脂质过氧化[17,18]。Rb1能够降低SOD、MDA含量,发挥抗氧化作用,进而起到治疗NAFLD的效果。
MCD饲料是胆碱、蛋氨酸联合缺乏的饲料,通过人为引起小鼠脂肪酸代谢障碍,诱导肝细胞脂肪变。该造模方法可导致小鼠体质量下降,与人类NAFLD发病过程并不完全一致。但由于MCD喂养小鼠早期即可出现肝细胞脂肪变性,有明显的气球样变特征,非常类似人类NAFLD表现,因此国际上仍将此法作为公认的NAFLD动物模型制作方法[19,20]。在本研究基础上,我们计划开展Rb1作用于高糖高脂小鼠的效果研究,以进行重复性验证。
综上所述,Rb1能够减轻NAFLD小鼠肝脏过氧化程度,减少肝脏脂肪堆积,改善肝功能,并在一定程度上调节血脂,起到治疗NAFLD的作用。本研究结果提示Rb1很可能成为治疗NAFLD的理想药物,这对丰富NAFLD药物种类、改善NAFLD治疗效果都具有重要意义。

