雨生红球藻源虾青素酯的消化吸收特性研究
周庆新 杨 鲁 徐 杰
(1日照职业技术学院海洋工程学院 山东日照276816 2 中国海洋大学食品科学与工程学院 山东青岛266003)
虾青素是一类非维生素A 源脂溶性类胡萝卜素,其在动物体内不能被合成,须从食物中摄取。美国食品和药物管理局(FDA)禁止化学合成虾青素作为膳食补充剂用于食品生产,批准其作为着色剂在动物及水产饲料和日化领域中使用,欧盟委员会批准天然虾青素作为食品着色剂在食品行业应用[1]。雨生红球藻(Haematococcus pluvialis)被公认为天然虾青素的良好来源。其中虾青素主要以与脂肪酸链接形成的虾青素酯形式存在,且虾青素酯的脂肪酸链分子组成复杂多样[2]。传统利用雨生红球藻制备天然游离虾青素的方法主要有化学皂化法和生物酶解法[3],而在制备过程中主要面临两个难题:第一,由于虾青素分子结构中含有大量的不饱和双键和羰基,所以其化学性质极其不稳定,使虾青素酯在皂化过程中易产生大量的副产物——虾红素及半虾红素[4];第二,生物酶法制备游离虾青素虽然过程条件温和,利于保持虾青素的稳定,但其转化率较低,使生产成本较高[5]。有学者将水解制备游离虾青素视为虾青素行业发展的关键限制因素,只有解决这些问题,整个虾青素的产业链才会向前发展。
面对这一问题,做出如下思考:在开发虾青素功能性产品的过程中,首先要解决的问题便是功能因子的选择,如果经过水解过程,直接将虾青素酯作为功能因子用于食品或药品行业,其能否在体内发挥与游离虾青素相同的生物学功能? 为探究这一问题,先要明确虾青素酯在体内的吸收代谢机制。Coral 等[6]研究表明,人体在口服摄入虾青素酯后,在血清中只检测到游离态虾青素,据此推测虾青素酯是在消化道内发生水解转化为游离虾青素后被吸收的,这一研究为虾青素酯在体内发挥与游离态虾青素相同的生物学效价提供了证据,然而缺乏系统的研究数据,来证明这一推测的准确性。研究虾青素酯在体内的消化吸收特性对虾青素功能因子的选择及产品运载系统设计具有重要意义。
鉴于此,本文以纯化制备的雨生红球藻来源虾青素酯为原料,选取Balb/c 小鼠作为动物模型,系统研究虾青素酯在模型小鼠消化道内的消化、排泄和吸收情况,为评价雨生红球藻源虾青素酯作为功能因子的可行性提供科学的数据。
1 材料与仪器
1.1 原料与试剂
新鲜破壁雨生红球藻粉(总虾青素含量2%),荆州天然虾青素有限公司;全反式虾青素标准品(all-trans-astxanthin),纯度为(95.8±0.5)%,德国Dr.Ehrenstorfer 公司;色谱纯甲基叔丁基醚(MBTE),Burdick & Jackson (美国Muskegon 公司生产);甲醇(色谱纯),德国Merck 公司;乙酸乙酯、丙酮、氯仿、正己烷(均为国产分析纯级),国药集团化学试剂有限公司;玉米油 (脂肪酸组成:15%饱和脂肪酸,30.8%单不饱和脂肪酸,54.1%多不饱和脂肪酸),山东西王食品有限公司;小鼠基础饲料,北京科澳协力饲料有限公司。
1.2 主要仪器
Millipore Q 纯水机,美国Millipore 公司;MS 3B-S25 型电动高速匀浆器,德国IKA 公司;HH-4数显恒温水浴锅,国华电器有限公司;CP100MX型高速冷冻离心机,日本日立公司;SD-50 型制冰机,上海雪人机电设备有限公司;DW-86L486 型立式超低温保存箱,青岛海尔特种电器有限公司;N-EVAP1 12 氮吹仪,美国Organomation Associates 公司;1260 型液相色谱仪、二极管阵列检测器(DAD)、G6410B 三重四极杆质谱仪、 大气压化学电离源(APCI),美国Agilent 公司;KQ-300E 超声波清洗机,昆山市超声仪器有限公司。
1.3 色谱柱
YMC-Carotenoid-C30 色谱柱 (4.6 mm×250 mm,5 μm),日本YMC 株式会社。
1.4 实验动物
雄性Balb/c 小鼠,SPF 级,体质量(22±2)g,购自青岛市药检所。
2 试验方法
2.1 雨生红球藻虾青素酯的制备
参照文献[7]报道方法,以新鲜破壁雨生红球藻粉为原料,制备纯化虾青素酯。制备方法:称取一定量的新鲜雨生红球藻藻粉,加入20 倍体积的乙酸乙酯,在4 ℃、避光、充氮条件下振荡提取10 min,然后4 ℃、5 000 r/min 离心5 min,收集上清液;剩余藻粉重复提取3 次,合并提取液;提取液于25 ℃条件下真空旋转蒸发至无液体流出,得到虾青素酯粗提物;称取100 g 已活化硅胶,采用湿法上柱,用约3~4 倍柱体积正己烷压实硅胶柱,将前述得到的虾青素酯粗提物用正己烷重新溶解后上样,然后依次用正己烷∶丙酮(100 ∶0→96 ∶4→92 ∶9→88∶12,体积比)进行洗脱纯化,并利用薄层层析(TLC)和HPLC 对洗脱组分进行检测,最后将虾青素单酯和双酯组分合并,合并后的洗脱液在25 ℃条件下真空旋转蒸发至无液体流出,得到纯化虾青素酯,并利用HPLC-MS 对其分子种组成及纯度进行检测分析。结果表明,制备得到的纯化虾青素酯纯度为(96.8±1.2)%,其中粗提物和纯化虾青素酯的分子种组成如表1所示。
2.2 虾青素酯灌胃液的制备
准确称量(0.01 mg)一定量的纯化虾青素酯,将其分散于适量的玉米油中,在冰浴和氮气保护下超声波振荡5 min,使其分散均匀,按照灌胃剂量配制成相应虾青素当量浓度的灌胃液。
2.3 虾青素酯在小鼠消化道内消化过程的测定
2.3.1 动物分组及灌胃 试验小鼠按照体质量随机分为8 组,分别对应消化过程的8 个时间点,每组5 只小鼠。饲料和水自由摄取,适应喂养一周,实验前,禁食不禁水10 h。各试验组小鼠按照30 mg/kg·体质量(虾青素当量)的剂量和10 mL/kg·体质量的灌胃体积灌胃2.2 节方法制备的虾青素酯玉米油,灌胃结束后正常进食进水。分别于灌胃0,3,5,7,9,12,17,24 h 后处死小鼠,处死后取完整消化道,按照胃、小肠、大肠进行分段,并分别用2 mL 生理盐水冲洗消化道内容物,合并内容物收集于10 mL 离心管中,冻于-80 ℃保存;然后将不同消化道区段剖开,分别用生理盐水刮洗干净,洗净的消化道区段分别包好,液氮速冻后于-80 ℃保存。
2.3.2 不同区段消化道壁中虾青素组成分析 参考Matyash 等[8]公布的利用MTBE 提取生物样本中脂质的方法,提取消化道壁中的总虾青素类化合物,并优化:将样品置于具塞玻璃离心管中,加入300 μL 甲醇,涡旋1 min,加入1 mL MTBE,在冰浴条件下以8 000 r/min 转速匀浆5 min,匀浆后静置10 min,加入250 μL 超纯水,涡旋30 s,再次静置10 min,于4 ℃,8 000 r/min 条件下离心5 min,离心后用移液枪小心吸取上层有机相,置于另一具塞玻璃离心管中,原离心管下层加入400 μL 混合液重复提取,混合液组分与上层相同(配制方法:配制MTBE∶甲醇∶水(10 ∶3 ∶2.5,体积比)的混合液,静置分层后,取上层),提取完全后,合并上层有机相,并用氮气吹干,吹干后再用1 mL的MTBE ∶甲醇(1 ∶1,体积比)复溶,经0.22 μm滤膜过滤,置于棕色样品瓶中,于-20 ℃保存,3 d内进行HPLC 分析,试验过程尽量避光操作。
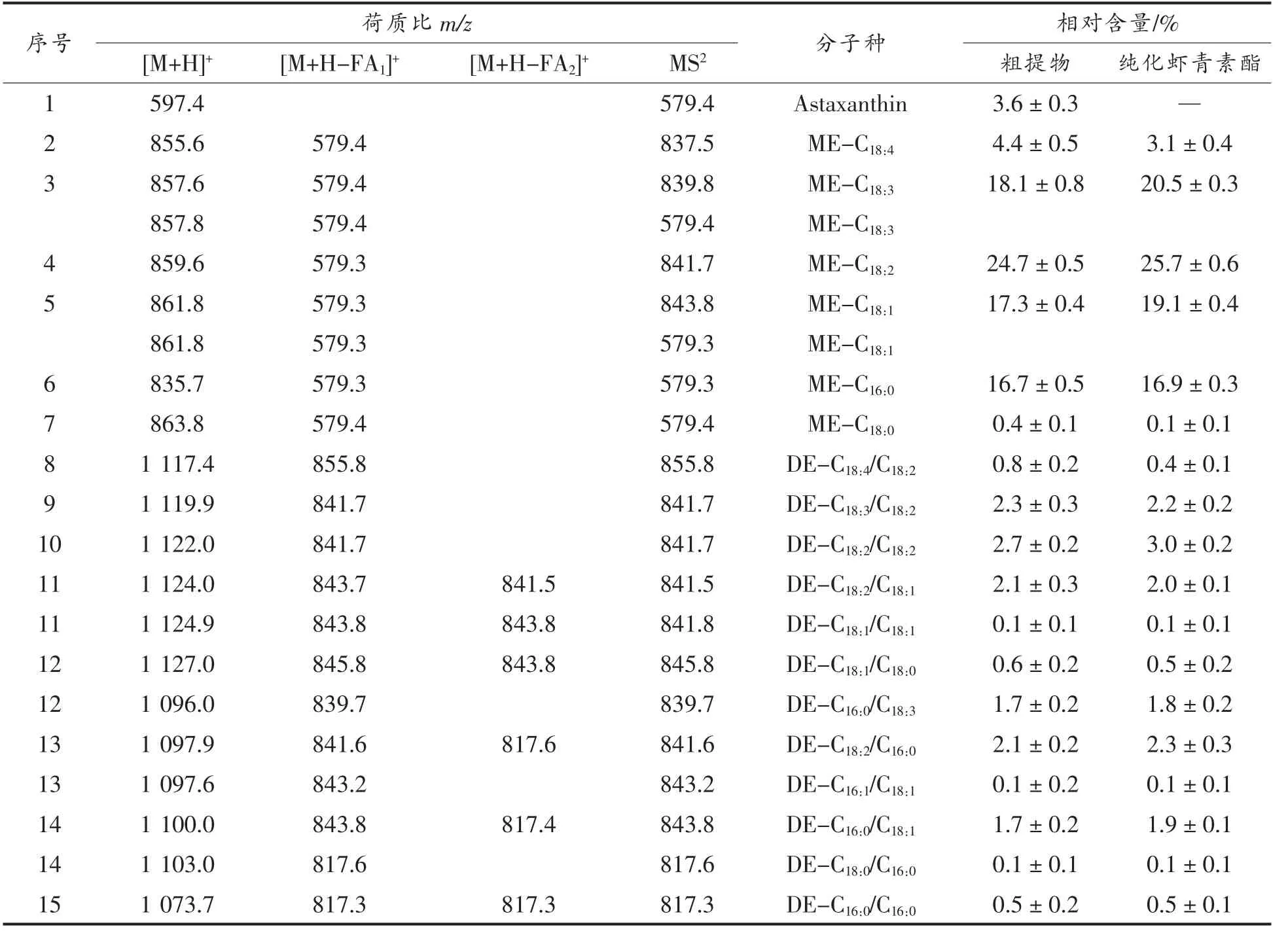
表1 雨生红球藻粗提物和纯化虾青素酯的质谱分析结果和各组分相对含量Table1 Mass spectroscopy data and the relative contents of astaxanthin and esterified astaxanthins in the H.pluvialis extract and purified esterified astaxanthins
2.3.3 消化道内容物中虾青素组成分析 消化道内容物经冻干后,研磨并充分混合均匀,然后称取60 mg 于10 mL 玻璃离心管中,加入3 mL 氯仿∶甲醇溶液(2 ∶1,体积比),涡旋5 min,静置10 min,6 000 r/min 离心5 min,离心后小心吸取上层有机相,重复提取3 次,合并提取液,氮气吹干,吹干后用1 mL 甲醇∶MBTE(1 ∶1,体积比)复溶,经0.22 μm 有机膜过滤,置于棕色样品瓶中,于3 d 内进行HPLC 分析,试验过程尽量低温避光操作。
2.4 粪便中虾青素排泄情况的测定
试验小鼠按照体重随机分为2 组,分别为对照组和虾青素酯组,每组5 只小鼠。饲料和水自由摄取,适应喂养1 周,试验前,禁食不禁水10 h。虾青素酯组实验小鼠按照30 mg/kg·体质量(虾青素当量)的剂量和10 mL/kg·体质量的灌胃体积灌胃虾青素酯玉米油,对照组按照10 mL/kg·体质量的灌胃体积灌胃玉米油。灌胃结束后正常进食进水,并分别于灌胃后2,4,6,8,10,12,14,16,18,20,22,24 h 收集小鼠粪便,真空冷冻干燥,称量,研磨,-80 ℃冰箱保存;然后按照2.3.3 处理消化道内容物的方法进行萃取处理,利用HPLC 分析其中虾青素存在形态及含量。
2.5 不同肠段、血清和肝脏中虾青素代谢时间曲线测定
2.5.1 动物分组及灌胃 实验小鼠按体质量随机分为2 大组:对照组和虾青素酯组,每组45 只,然后每一大组按照对应时间点再随机分为9 小组。小鼠禁食10 h 后,虾青素酯组按100 mg/kg·体质量的灌胃剂量和10 mL/kg·体质量的灌胃体积灌胃虾青素酯玉米油,对照组按照10 mL/kg·体质量的灌胃体积灌胃玉米油。
分别在灌胃0,5,7,9,12,17,24,48,72 h 后摘眼球取血,置于含EDTA 的离心管中,室温(25~26 ℃)放置30 min 分层后,在4 ℃、7 500 r/min 条件下离心15 min,用移液枪仔细吸取上层血清,于-80 ℃保存。小鼠处死后,取消化道,并按照十二指肠、空肠、回肠和结肠进行分段,分别用生理盐水洗净消化道内容物,然后将不同消化道区段剖开,分别用生理盐水刮洗干净,洗净后的消化道区段用滤纸吸干的游离水,称重,分别包好,冻于-80℃保存。
2.5.2 不同肠段对虾青素吸收情况的测定 将2.5.1 节中收集的不同时间点的肠段按2.3.2 方法进行处理,利用HPLC 测定其中虾青素的含量,以考察不同肠段对虾青素的吸收情况。
2.5.3 血清中虾青素组成分析 参考Khachik等[9]公布的方法萃取小鼠血清中虾青素,并根据实际情况进行优化,具体操作:取500 μL 血清,加800 μL 甲醇,涡旋30 s,再加入1 500 μL 的氯仿,涡旋30 s,静置10 min,8 000 r/min 条件下离心3 min,取下相,重复萃取3 次,合并下相溶液,氮气吹干,再用1 mL 甲醇∶MBTE(1 ∶1,体积比)复溶,经0.22 μm 有机膜过滤,置于棕色样品瓶中,于3 d 内进行HPLC 分析,测定其中虾青素的含量,试验过程尽量低温避光操作。
2.5.4 肝脏中虾青素组成分析 肝脏中虾青素组成分析方法参照2.3.2 方法。
2.6 数据处理与分析
试验数据以平均值±SD 表示,采用SPSS 19.0软件进行单因素方差one-way ANOVA 分析,并采用Tukey’s 法进行两两比较分析,以P<0.05 为显著水平。
3 结果与分析
3.1 虾青素酯在消化道不同部位的消化吸收过程
3.1.1 消化道不同部位中虾青素的存在形态 图1描述了灌胃虾青素酯5 h 后,在小鼠的不同部位消化道壁及其内容物中虾青素的存在形态。图中结果显示,虾青素酯在胃内未发生水解,全部以虾青素酯的形式存在;而在小肠和大肠内容物中检测到了大量游离态虾青素,而虾青素酯的相对含量显著下降,说明虾青素酯在小肠内被消化酶水解成游离态虾青素;粪便中虾青素酯的含量相对较高,说明有大量虾青素酯在消化道内未被酶解,即被排出体外,进而无法被生物体吸收利用。据此推断,虾青素酯在消化道内的酶解效率可能是影响其在生物体内利用度的重要因素。另外,不同部位消化道壁中虾青素的分析结果显示,在胃壁中未检测到虾青素,而在小肠和大肠中均检测到游离虾青素,而未检测到酯化态虾青素,该结果进一步证明了虾青素酯进入体内后是以游离态虾青素的形式被生物体吸收利用。在上述试验结果的基础上,推测虾青素酯在小鼠体内消化吸收过程中分子形态的变化如图2所示。据文献报道[10-11],叶黄素酯同样作为一类自然界存在的酯化态类胡萝卜素,其在大鼠体内的消化水解过程与本研究结果一致,目前认为叶黄素酯在体内水解为叶黄素是一个自然的生理过程。
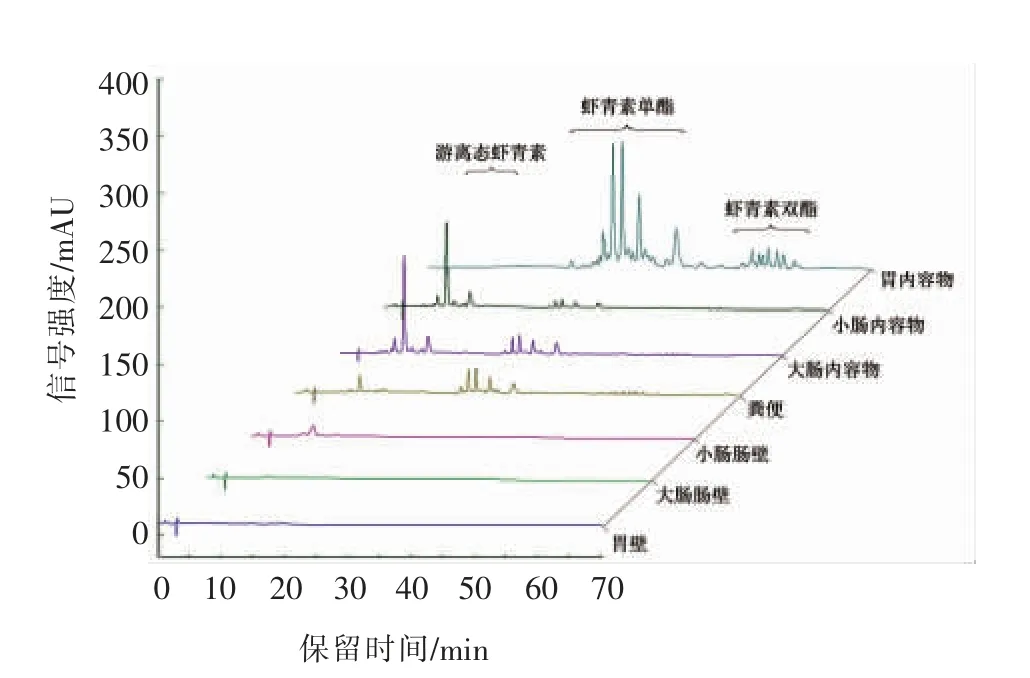
图1 消化道不同部位中虾青素及其酯的HPLC-DAD 分离谱图Fig.1 The molecular speciation of astaxanthin in different part of digestive tract
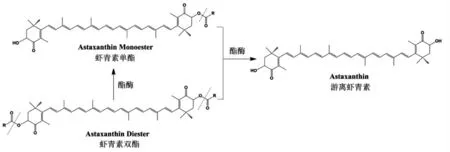
图2 虾青素酯在小鼠体内消化过程中形态变化Fig.2 The changes of esterified astaxanthins form during digestion in mice
3.1.2 不同肠段对虾青素的吸收效应 本试验考察了模型小鼠在灌胃虾青素酯后,不同肠段对虾青素的吸收情况,结果如图3所示。从图中可以看出,虾青素在十二指肠、空肠、回肠中均有吸收,由浓度-时间曲线下面积可知,虾青素在空肠肠段被吸收的量最高,在结肠中的吸收量较小,且吸收量显著低于其它肠段中虾青素的吸收量 (P<0.05)。故推测,虾青素在消化道内主要是在小肠肠段被吸收,且以空肠为主要吸收场所,同时有少量在大肠部位被吸收。该结论与目前已报道[12]类胡萝卜素的吸收相一致。
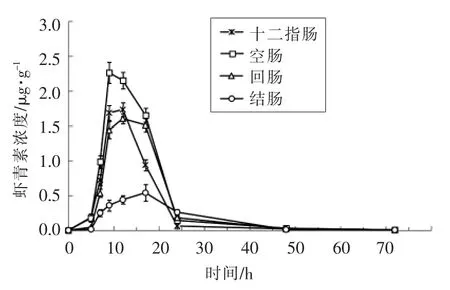
图3 不同肠段中虾青素浓度-时间曲线Fig.3 The content-time curve of astaxanthin in different intestine segments after gavage
3.1.3 消化道内容物中虾青素含量及组成变化为进一步明确虾青素酯在小鼠体内的消化水解过程,该部分考察了灌胃虾青素酯后,不同时间点消化道内容物中虾青素的组成情况。由表2可知,小鼠经口灌胃虾青素酯后,在3 h 时,消化道内容物中游离态虾青素的相对含量开始缓慢上升,推测此时灌胃样品中的虾青素酯进入小肠,在小肠内开始发生水解;随后虾青素酯开始大量水解,游离虾青素的相对含量不断升高。另外,根据图4所示的不同形态虾青素相对含量随时间的变化情况,推测7~12 h 是虾青素酯在模型小鼠体内消化水解的高峰期,17 h 后,游离态虾青素的相对含量变化缓慢,至24 h 时,游离态虾青素的相对含量略微下降,而虾青素单酯的含量略微上升,此现象可能由于24 h 时虾青素在消化道内已基本排空,其中总虾青素含量较低,在HPLC-DAD 谱图中难以积分,从而造成一定的试验误差。另外需要注意的是,由于游离态虾青素和虾青素酯在消化道内可能会发生降解,而研究报道[13-14],酯化态类胡萝卜素与游离态类胡萝卜素在稳定性方面存在差异,故虾青素类化合物在消化道内的降解亦会表现出差异性。因此,试验测得的不同虾青素组分相对百分含量应是消化道内酶解和失稳降解两方面共同作用的结果。
3.2 小鼠粪便中虾青素含量和组成变化
由表3可知,小鼠经口灌胃虾青素酯后,在0~2 h 粪便中无虾青素类化合物排出,随后粪便中游离态虾青素的相对含量开始上升,直至18 h后,粪便中的游离虾青素相对含量趋于稳定。另外,通过考察模型小鼠粪便中总虾青素类化合物在HPLC-DAD 图中的峰面积随时间的变化情况(图5)。结果表明:一方面,灌胃虾青素酯试验组小鼠在粪便中出现最大总虾青素排泄量的时间为14 h,至24 h 时几乎无虾青素类化合物检出。通过与3.1.3 试验结果比较,灌胃虾青素酯后,消化道内的不同形态虾青素组成随时间的变化趋势几乎一致。该部分试验结果为后续评价虾青素酯和游离虾青素生物可接受率试验中粪便收集时间提供参考依据。
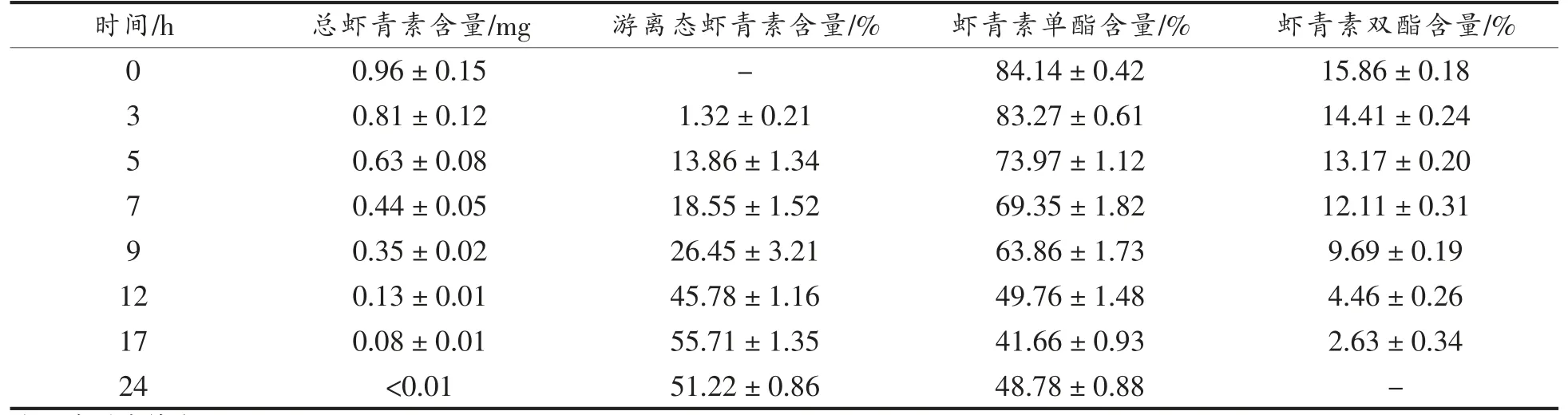
表2 小鼠消化道内容物中虾青素组成变化(n=5)Table2 The changes of astaxanthin’s composition for digestive tract in mice (n=5)
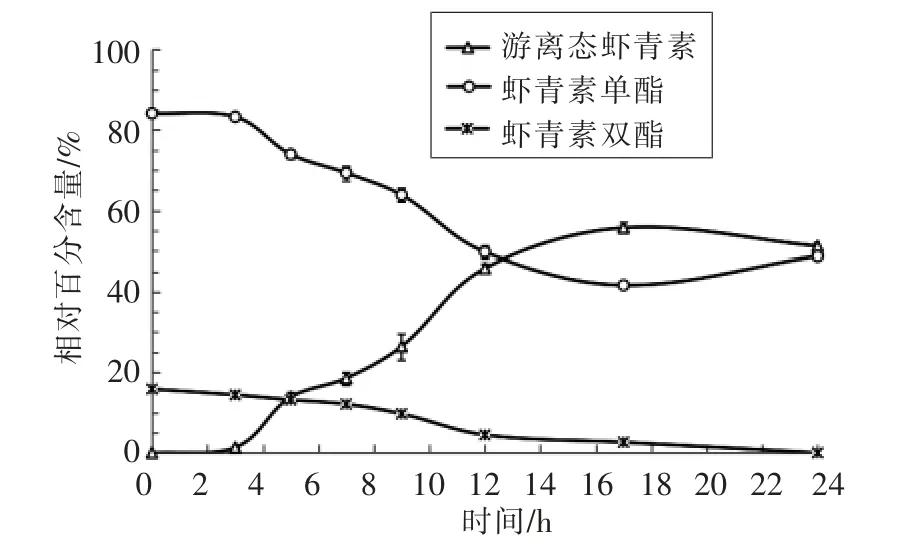
图4 灌胃虾青素酯后消化道内容物中虾青素形态变化(n=5)Fig.4 The changes of astaxanthins’s form fordigestive tract in mice after gavage of esterified astaxanthins (n=5)
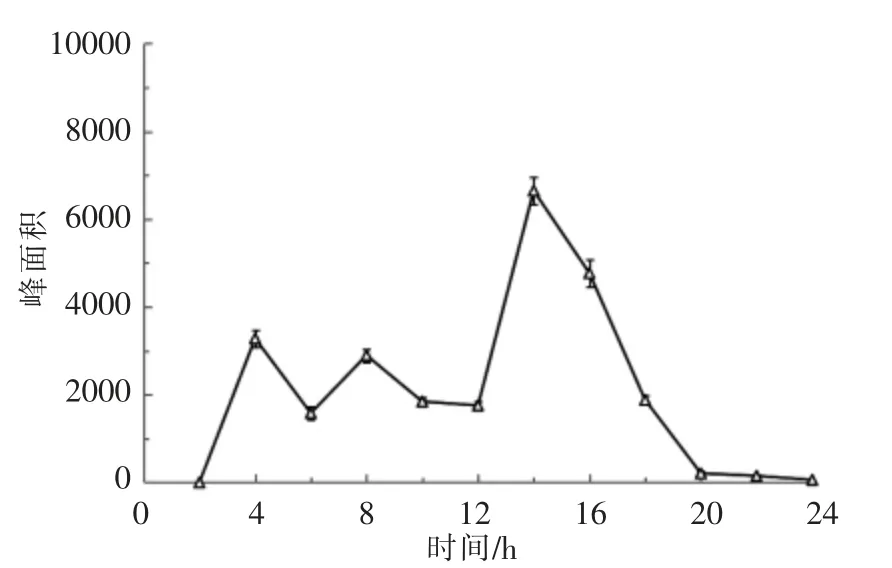
图5 灌胃虾青素酯后粪便中的总虾青素峰面积-时间曲线(n=5)Fig.5 The content-time curve of total astaxanthin in excrement after gavage of esterified astaxanthins (n=5)
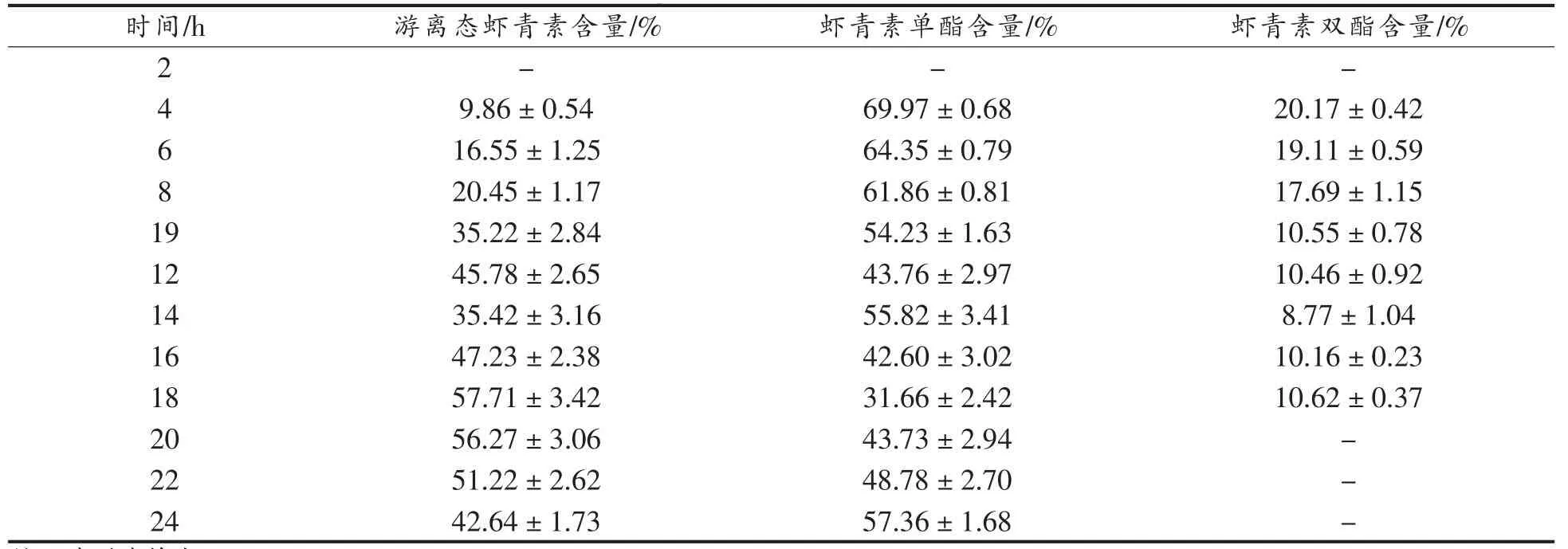
表3 粪便中虾青素组成变化(n=5)Table3 The changes of astaxanthins in excrement (n=5)
3.3 虾青素酯在小鼠血清和肝脏中的代谢动力学研究
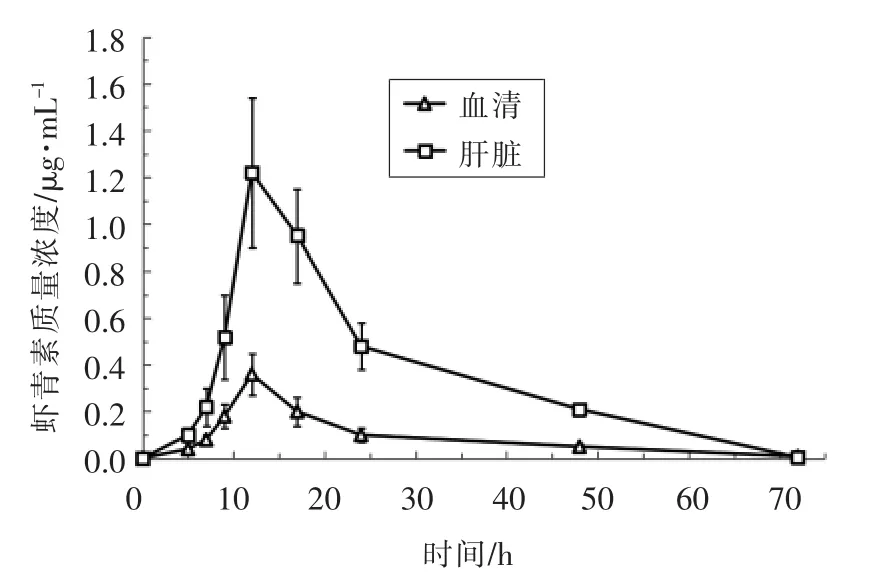
图6 灌胃虾青素酯后血清和肝脏中虾青素的质量浓度变化(n=5)Fig.6 The change of astaxanthin mass concentration in plasma and liver after oral gavage of esterified astaxanthins (n=5)
试验小鼠在灌胃虾青素酯后,在血清和肝脏中仅检测到游离虾青素,进一步说明虾青素酯进入小鼠体内后是以游离态虾青素的形式被生物体利用,该结论符合Coral 等[6]的研究报道。模型小鼠血清和肝脏中虾青素质量浓度随时间变化曲线如图6所示,灌胃后,小鼠血清和肝脏中的虾青素质量浓度明显上升,且变化趋势近似,均在12 h 时虾青素质量浓度达到最高峰值(Cmax),分别为0.215 μg/mL 和0.727 μg/mL;在随后的12~72 h,虾青素在血清和肝脏中的质量浓度逐渐下降。通过对比虾青素在血清和肝脏中的最大积累浓度发现,虾青素在肝脏中的积累浓度显著高于在血液中的积累浓度,两者最大吸收浓度相差约3 倍。试验结果表明,虾青素酯在模型小鼠体内能以游离虾青素的形式发挥作用。据报道[15-18],类胡萝卜素生物利用率受到化合物结构形式、 在生物体内的结合方式、溶解度、食品基质等因素的影响。Breithaupt等[19-20]研究表明,游离态和酯化态的叶黄素、辣椒红素和β-玉米黄质在模型动物小肠吸收方面没有显著差异。而有关虾青素酯和游离虾青素在生物利用率方面的差异性还未见系统报道,有待进一步研究。
4 结论
本文通过体内动物实验,研究了虾青素酯在小鼠体内的消化吸收过程。结果表明:虾青素酯在模型动物小肠内先被水解转化成游离虾青素,然后以游离态的形式被消化道壁细胞吸收;虾青素的吸收部位主要在小肠,在胃中无吸收,在大肠(结肠)中被少量吸收,试验发现不同肠段对虾青素的吸收能力从高到低依次为:空肠>回肠>十二指肠>结肠;灌胃虾青素酯后,虾青素在模型小鼠血液和肝脏中达到最大积累浓度的时间均为12 h,且肝脏中的最大浓度约为血清中的3 倍。本研究阐述了虾青素酯在体内的消化吸收情况,为下一步研究不同分子形式虾青素化合物在生物体内生物利用率的差异性奠定了基础,并为虾青素酯作为功能因子代替游离虾青素在食品、 药品行业中应用提供了科学依据。

