白桦脂酸对HepG2细胞的诱导凋亡作用及其机制
李 豪 周万怡 吴嘉南 陈启和
(浙江大学食品科学与营养系 杭州310058)
白桦脂酸(Betulinic acid),又名桦木酸,是一种天然存在的五环三萜类化合物,具有抗炎[1]、抗癌[2]等多种生物活性[3]。在自然界中广泛存在,其大量存在于桦木属植物中,在白桦树皮中含量最为丰富[4]。目前,白桦脂酸的来源主要有3 种:一是从天然植物中提取分离所得;二是以白桦脂醇为前体,通过有机合成所得;三是以白桦脂醇为前体,通过微生物转化所得。
1995年首次发现白桦脂酸可以选择性地杀死人类黑色素瘤细胞[5],而不杀伤健康细胞,并进一步证实其能诱导肿瘤细胞凋亡[6]。随后大量试验表明白桦脂酸具有广泛的抗肿瘤活性,能诱导多种肿瘤细胞凋亡,包括白血病细胞[7]、脑瘤[8]、神经外胚层瘤[9]、前列腺癌[10]、卵巢癌[11]、乳腺癌[12]、肺癌、结肠癌[13]以及宫颈癌[14-15]等细胞。此外,它还能阻止肿瘤的形成及发展。
白桦脂酸作为一种有着良好前景的抗肿瘤药物,目前对人的肝癌细胞HepG2 的作用及其机制还没有相关的研究报道。本试验旨在研究白桦脂酸对HepG2 增值、 凋亡的影响及其可能的机制,为其进行临床抗肿瘤、 抗癌治疗提供一些试验依据。
1 材料与方法
1.1 试验药物
白桦脂酸,梯希爱(上海)化成工业发展有限公司。使用时需要用DMSO 溶解,用无菌的0.22 μm 的有机系滤膜过滤除菌。使用时,先配成5 mg/mL 的母液,然后根据需要用完全培养基稀释成不同的浓度。
1.2 细胞
人肝癌HepG2 细胞株,中国科学院细胞库/中国科学院上海生命科学研究院化学与细胞生物学研究所。用含有10%胎牛血清、1×105U/L 青霉素、链霉素的DMEM 高糖培养基,在37 ℃、含5%CO2的饱和湿度培养箱中培养。2~3 d 传代一次,取对数生长期的细胞进行试验。
1.3 试剂材料
DMEM 培养基,Corning;胎牛血清,杭州四季青生物科技公司;胰酶、青霉素、链霉素双抗,Hy-Clone;PBS 缓冲液(配制:NaCl 0.85 g,KCl 0.2 g,Na2HPO4·12H2O 2.85 g,KH2PO40.27 g,蒸馏水1 L);DMSO、MTT,北京索莱宝生物科技有限公司;细胞凋亡检测试剂盒Annexin V-FITC/PI,联科生物科技公司AP101-100-kit;细胞周期检测试剂盒,联科生物科技公司CCS012;罗丹明123 染色试剂盒,南京凯基生物科技有限公司KGA217。
1.4 仪器
CO2培养箱,日本SANYO;倒置显微镜,德国LEICA;FC500MCL 流式细胞仪,美国贝克曼库尔特;酶标仪,Thermo 公司。
1.5 试验方法
1.5.1 细胞存活率检测 将处于对数生长期的HepG2 细胞消化传代,细胞以每孔2.5×105/mL 的密度接种100 μL 于无菌的96 孔板中,在37 ℃,5%CO2的培养箱中培养。过夜约24 h 待细胞贴壁后,将原来的培养基吸出,加入含白桦脂酸(终质量浓度分别为2.5,5,10,20,30,40,60,80 μg/mL)的完全培养液,每孔100 μL,各试验组每组均设6个平行孔,铺3 个板,分别于24,48,72 h 后终止培养,24 h 换一次药。试验中同时设定不加药物的正常对照组,以及既不加药物也不加细胞的空白对照组。
加药培养24,48,72 h 后,小心弃培养基,每孔加入5 mg/mL 的MTT 溶液20 μL,37 ℃培养4 h 后,每孔加入150 μL DMSO,充分振荡10 min溶解紫色结晶,置酶标仪上测定波长570 nm 下的吸光度,间接反应细胞存活率。按照下列细胞存活率计算公式:细胞存活率=试验组吸光度/对照组吸光度×100%。
1.5.2 流式细胞仪检测凋亡率 取对数生长期细胞以每孔2.5×105/mL 的密度接种于6 孔板中,培养24 h 后,加入0,20,30,40 μg/mL 的白桦脂酸培养液2 mL,每个质量浓度设3 个复孔。48 h 后用胰酶消化细胞,在4 ℃下1 500 r/min 离心5 min收集细胞,每个样用预冷的PBS 洗2 次。每个样收集约106个细胞,在每个管里加500 μL 1×Binding Buffer。在避光的环境中,加入5 μL Annexin VFITC,混匀,再加入5 μL PI,混匀。
此前应从未经药物干预的细胞中分出3 管细胞,用于设门。具体方法为:空白,只加结合缓冲液;V 单染,加结合缓冲液和5 μL Annexin VFITC,不加PI;PI 单染,加结合缓冲液,5 μL PI,不加Annexin V-FITC。在室温中避光反应5 min,之后转入到流式管中。放入冰盒中,等待上流式仪检测。
结果判读:散点图左下象限LL:正常细胞群,Annexin-V (-),PI (-);右下象限LR:早期凋亡细胞群,Annexin-V (+),PI (-);右上象限UR:晚期凋亡细胞或死亡细胞群,Annexin-V (+),PI(+);左上象限UL:机械损伤或坏死细胞群,Annexin-V (-),PI(+)。计算总凋亡率=LR%+UR%。
1.5.3 流式细胞仪检测细胞周期 取对数生长期细胞以每孔2.5×105/mL 的密度接种于6 孔板中,培养24 h 后,加入0,20,40,80 μg/mL 的白桦脂酸培养液2 mL,每个质量浓度设3 个复孔。48 h 后用胰酶消化细胞,在4 ℃下1 500 r/min 离心5 min 收集细胞,每个样用预冷的PBS 洗2 次。每个样收集约106个细胞。弃去PBS 后,加入预冷的75%乙醇,-20 ℃固定过夜。离心收集固定后的细胞,用PBS 洗1 次,离心去上清,加入1 mL DNA Staining solution,涡旋振荡5~10 s,使其混匀,浓度约为106/mL,室温避光孵育30 min 后,上流式细胞仪检测。
1.5.4 线粒体膜电位检测 取对数生长期细胞以每孔2.5×105/mL 的密度接种于6 孔板中,培养24 h 后,加入不同质量浓度的白桦脂酸培养基处理24 h 后,用胰酶消化细胞,在4 ℃下1 500 r/min离心5 min 收集细胞,每个样用预冷的PBS 洗2次。每个样收集约106个细胞。重悬于100~200 μL PBS 中,加入10 μL 罗丹明123(Rh123)染液(1 mg/mL)37 ℃染色10 min,离心收集细胞,PBS洗涤2~3 次后,重悬于PBS 中,流式细胞仪测定荧光强度,激发波长488 nm,发射波长530 nm。荧光强度的变化与对照比较。
2 结果与分析
2.1 白桦脂酸抑制HepG2 细胞增殖
MTT 试验结果如图1所示,不同质量浓度的白桦脂酸均可以抑制HepG2 细胞增殖,并呈剂量和时间依赖关系。随着白桦脂酸质量浓度的增加,HepG2 细胞存活率在逐渐降低,说明处理相同时间,白桦脂酸的质量浓度越高,对HepG2 的抑制效果越强。结果表明,作用24,48,72 h 的白桦脂酸对于HepG2 细胞的半抑制质量浓度分别为52,26,17.5 μg/mL,这为接下来的试验提供参考。
白桦脂酸作用后的细胞具有不规则的细胞巧态,如图2b所示。而且细胞核崩裂,染色质浓缩,这是细胞凋亡的重要特征。
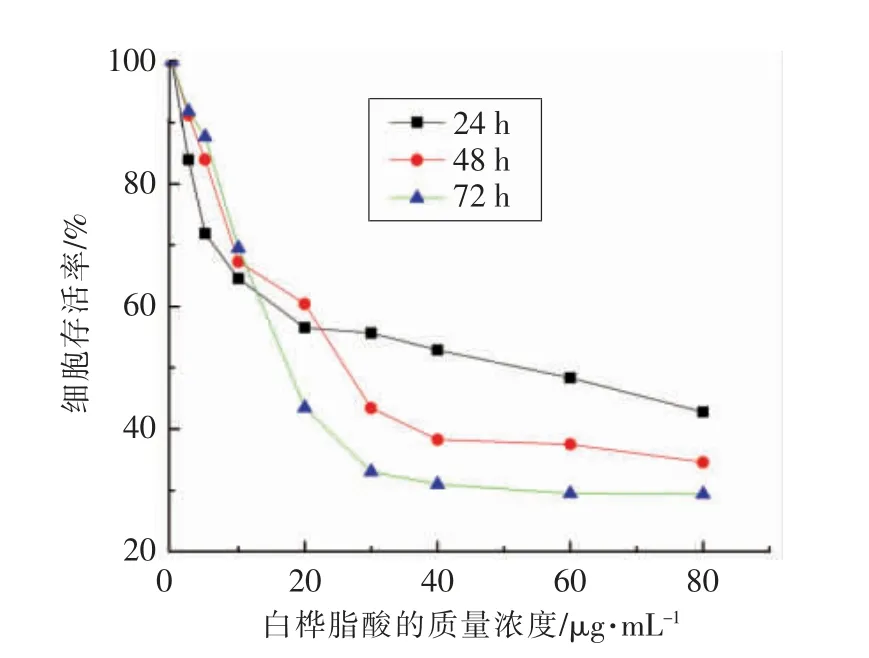
图1 HepG2 细胞存活率随白桦脂酸质量浓度和时间的变化Fig.1 Cell viability varied with the mass concentration of betulinic acid and time
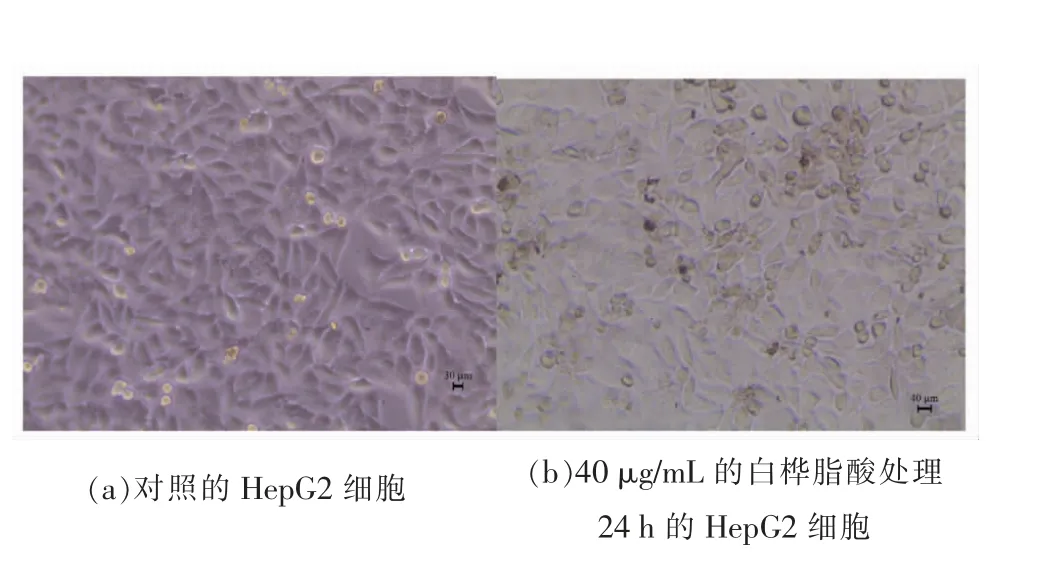
图2 白桦脂酸处理前、后的HepG2 细胞形态变化Fig.2 The photograph of untreated and the treated HepG2 cells at 40 μg/mL betulinic acid
2.2 流式细胞技术检测白桦脂酸对HepG2 细胞凋亡的影响
为进一步验证白桦脂酸能否引起人的肝癌细胞HepG2 细胞调亡,采用流式细胞仪对白桦脂酸处理后的细胞进行检测。细胞经白桦脂酸处理48 h 后,用Annexin V-FITC 和PI 染色,并用流式细胞仪检测。结果如图3和表1所示,右下象限Annexin-V(+)/PI(-)(B4)为早期凋亡细胞群,右上象限Annexin-V(+),PI(+)(B2)为晚期凋亡细胞。由图3可知,随着白桦脂酸质量浓度的增加,凋亡细胞的比例也在增加,而且大部分被白桦脂酸处理过的细胞集中在B4 区域,也随着白桦脂酸质量浓度的增加而增加,说明白桦脂酸主要引起的是早期凋亡。加药的每一组凋亡率都比空白对照组高很多,如表1。说明白桦脂酸可以有效促进HepG2 细胞凋亡。
2.3 流式细胞技术检测白桦脂酸对HepG2 细胞周期的影响
细胞周期分布的变化也是细胞凋亡的一个重要指标。培养后的细胞用PI 染色,流式细胞仪检测周期变化,结果如图4、图5所示。通过PI 染色,流式细胞仪检测HepG2 细胞周期,发现随着白桦脂酸质量浓度的增加,G1、G2 期的细胞比例下降,S 期的细胞比例在逐渐增加,说明细胞发生了S期的阻滞。由于S 期是DNA 复制时期,即说明白桦脂酸阻碍了HepG2 细胞的DNA 合成,从而促进了HepG2 细胞的凋亡。

表1 流式细胞仪检测HepG2 细胞凋亡率Table1 FCM analysis of the cell apoptosis rates of HepG2 cells
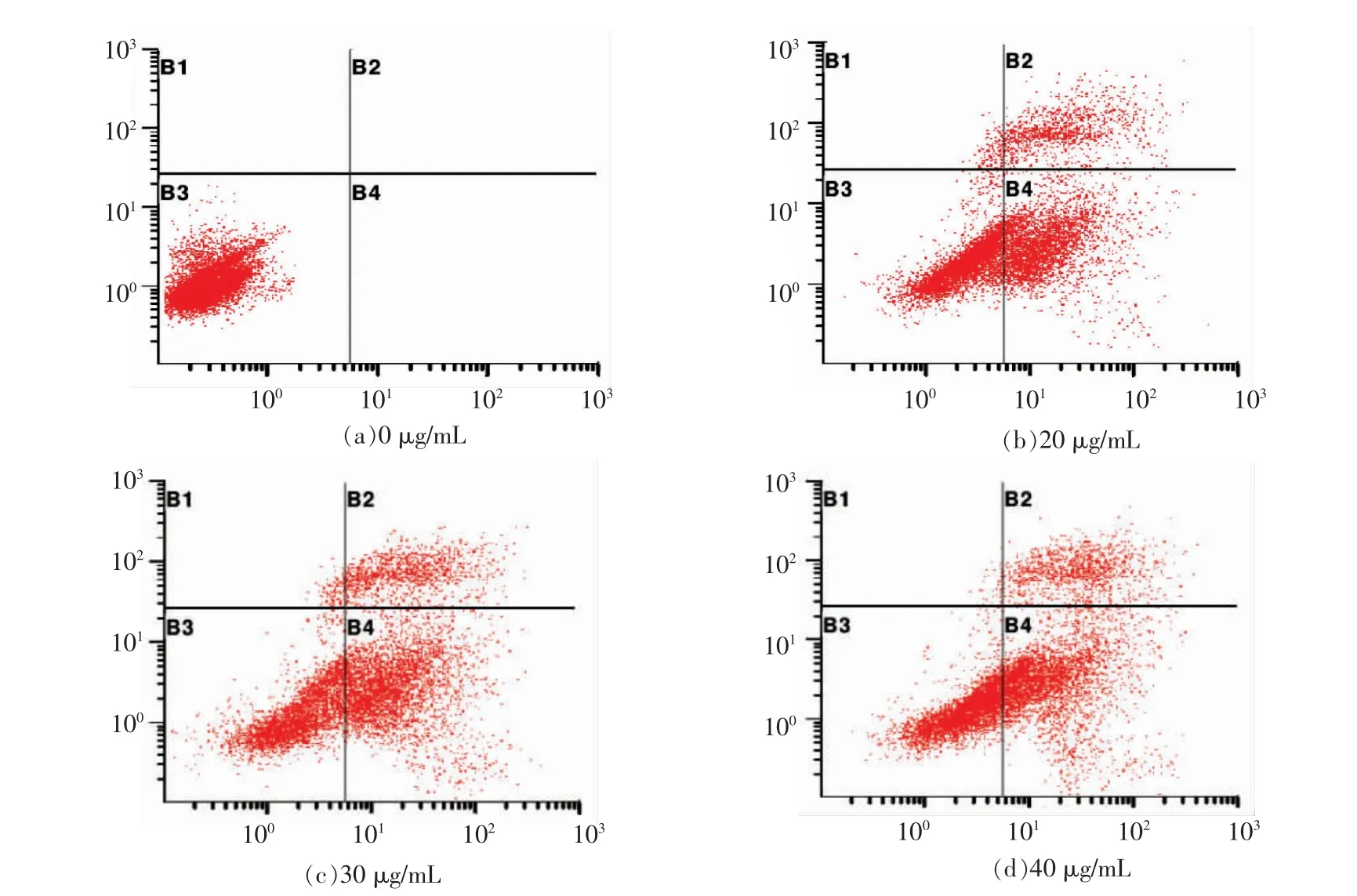
图3 流式细胞技术检测各组细胞凋亡结果图Fig.3 FCM analysis of the cell apoptosis results

图4 白桦脂酸对细胞周期的影响Fig.4 The influence of betulinic acid on cell cycle
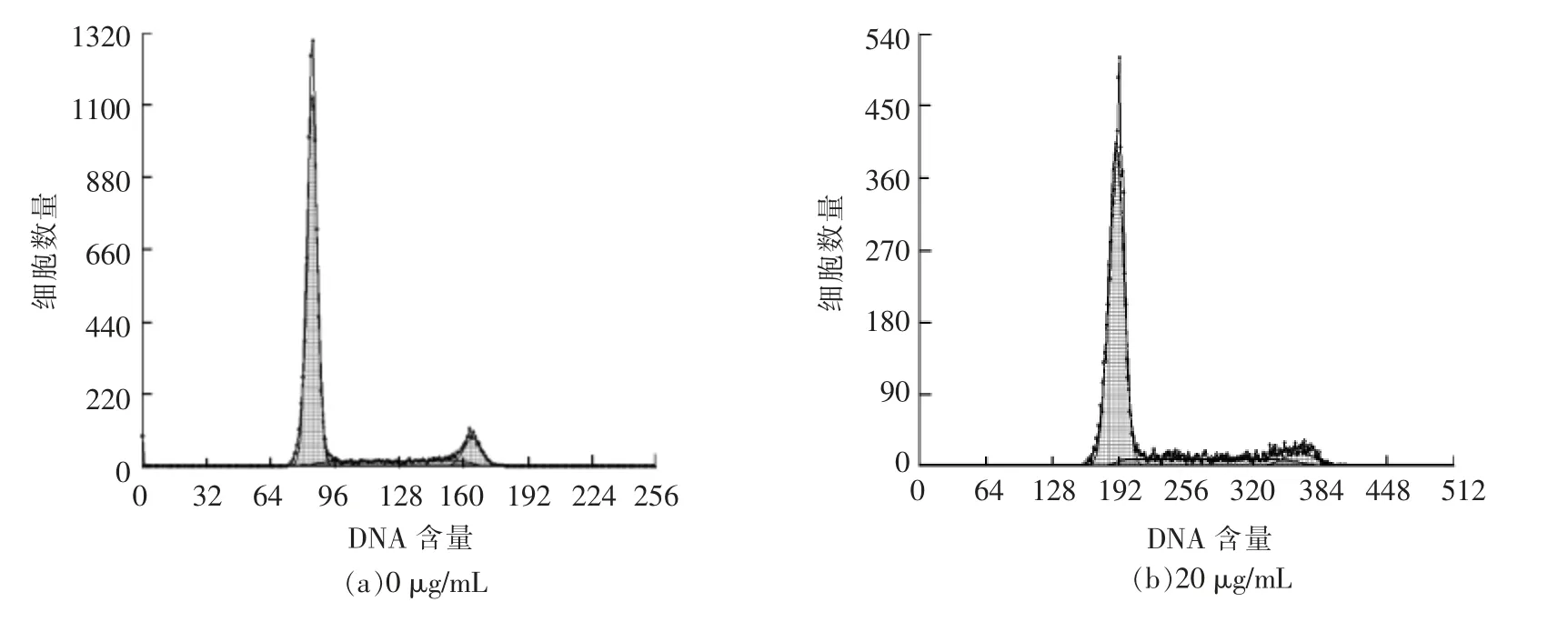
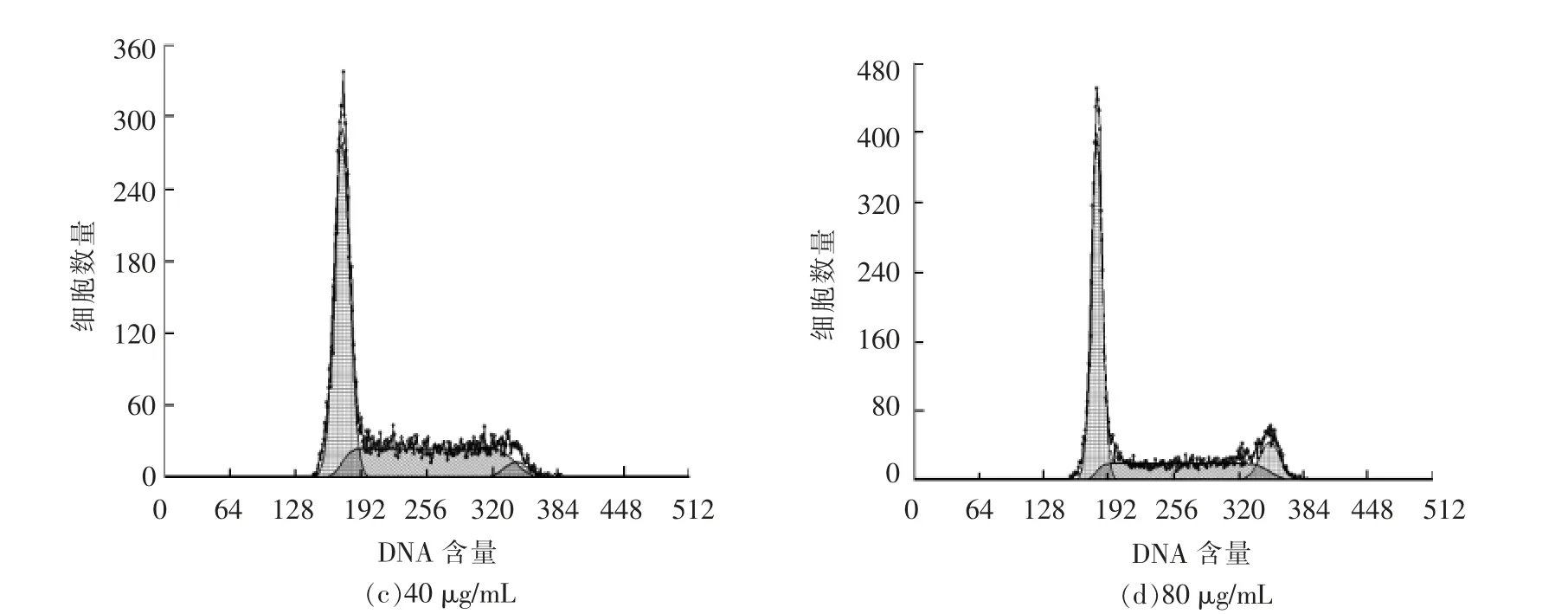
图5 流式细胞术检测各组细胞周期结果图Fig.5 FCM analysis of the cell cycle results
2.4 流式细胞仪检测白桦脂酸对HepG2 线粒体膜电位的影响
细胞凋亡的早期特征之一便是线粒体膜电位(Mitochondrial membrane potential,MMP)的降低。通过测定线粒体膜电位,可以判断细胞调亡是否与线粒体途径有关[16]。染料罗丹明123(Rhodamine123)是一种可透过细胞膜的阳离子荧光染料,是一种线粒体跨膜电位的指示剂。用流式细胞仪检测,通过荧光信号的强弱来检测线粒体膜电位的变化和凋亡的发生。用白桦脂酸处理过的HepG2 线粒体膜电位如图6所示。发现随着白桦脂酸质量浓度的增加,线粒体膜电位越来越低,而且用白桦脂酸处理过的HepG2 线粒体膜电位与对照相比,均出现了明显下降,说明白桦脂酸诱导的HepG2 细胞凋亡可能与线粒体途径有关。
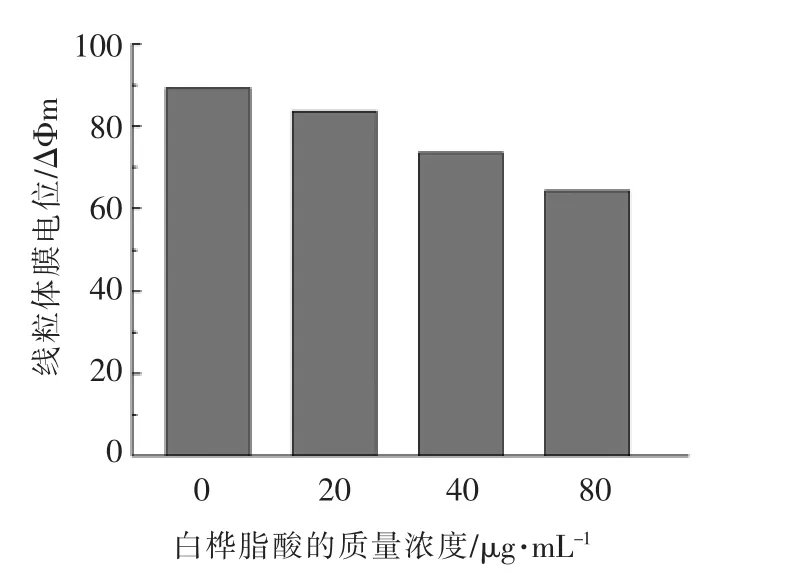
图6 白桦脂酸对线粒体膜电位的影响Fig.6 The influence of betulinic acid on mitochondrial membrane potential
3 讨论
本试验研究表明,白桦脂酸可以显著降低HepG2 细胞的存活率,而且作用相同的时间,药物浓度越高,对HepG2 细胞的抑制效果越强。作用24,48,72 h 的白桦脂酸对于HepG2 细胞的半抑制质量浓度分别为52,26,17.5 μg/mL。流式细胞仪检测结果表明,白桦脂酸诱导HepG2 细胞凋亡主要为早期凋亡,且凋亡比例随白桦脂酸质量浓度的增加而增加。细胞周期的检测结果表明白桦脂酸的加入使细胞发生了S 期的阻滞,即白桦脂酸阻碍了HepG2 细胞的DNA 合成。线粒体膜电位的研究结果表明白桦脂酸可以降低线粒体膜电位,说明白桦脂酸诱导的细胞凋亡可能与线粒体途径有关。
综上所述,白桦脂酸可抑制HepG2 细胞增殖,诱导HepG2 细胞凋亡,这一机制可能与线粒体途径有关,通过将细胞阻滞在S 期来实现。本试验结果为研究肿瘤治疗药物提供了试验基础,也为白桦脂酸应用于肝癌的免疫治疗提供了新的试验依据。

