海洋环境体系中放射性核素吸附-解吸迟滞机制研究
陈 超,朱 君,石云峰,邓安嫦,刘团团,谢 添,张艾明
(中国辐射防护研究院,山西 太原 030006)
核设施运行期间其液态流出物会随温排水和冲洗水等进入受纳水域,进入水体后水中的悬浮物和沉积物会对其中的放射性核素有吸附作用,后又通过沉积作用使放射性核素累积。而被吸附的放射性核素在外界环境改变时又可从沉积物中解吸释放出来从而造成环境水体二次污染。目前,采用合适的吸附材料有效降低海洋环境放射性污染是行之有效的手段,而放射性核素与单一吸附材料之间作用机制的研究则对复杂环境体系中核素的吸附、扩散机理探索有高度的可借鉴性[1-2],同时放射性核素在海洋环境中的吸附-解吸行为研究是核设施环境影响评价地表水输运模式的重要环节,对于评估核设施临近水域环境容量及放射性液态流出物对生态环境影响具有重要意义[3]。
近年来,许多研究表明,海洋环境对多种污染物的吸附过程存在不同程度的解吸迟滞性,即吸附-解吸过程并非完全可逆[4-6]。目前,国内外针对重金属、瓦斯及有机质吸附过程不可逆吸附机制的研究已有大量报道,但由于其复杂性和体系特殊性,至今还未达成一致共识。潘纲等[7-10]提出了亚稳平衡态理论(MEA),认为吸附反应达到平衡时吸附体系实际上处于一种亚稳吸附平衡态,测量得到的吸附密度并非热力学状态函数,只有当吸附-解吸过程为完全可逆时,吸附质分子才能达到唯一的理想平衡态。徐丛等[11]利用亚稳平衡态理论研究了Zn在针铁矿(α-FeOOH)体系中的固体浓度效应,吸附等温线随固体浓度升高而降低的现象,揭示了固体浓度效应的产生机制,即增加吸附体系反应物固体浓度可加快反应速率,而反应速率的增加降低了体系的热力学可逆性,吸附过程的不可逆性导致了固体浓度效应。王公达等[12]研究了瓦斯在深部煤层气中的吸附-解吸迟滞现象,考察了体系最高吸附压力和煤粒粒径与吸附等温线之间的关系,发现体系解吸迟滞性随最高吸附压力的增加明显增强;用定量评价指标解吸滞后系数(IHI)反映了吸附-解吸迟滞从完全可逆至完全非可逆的程度,深入讨论了不可逆吸附机制,表明吸附体系中瓦斯分子在高压作用下嵌入了连通性较差的孔隙通道中并引起孔隙变形,孔隙变形会阻滞瓦斯分子向外扩散,导致吸附质分子很难从孔隙中解吸脱落,解吸等温线与吸附等温线不能重合从而表现出明显的解吸迟滞性。吴文伶等[13]研究了不同初始浓度菲在沉积物中的解吸迟滞性,用解吸迟滞系数(TII)描述了体系解吸迟滞性随菲初始浓度的增加先减小后增大的变化过程,表明不同初始浓度的菲分布到的沉积物吸附点位的结合能与菲分子是否受沉积物微孔限制是导致体系解吸迟滞性的原因。本研究拟通过考察海洋环境体系中沉积物浓度和核素初始浓度对体系吸附-解吸等温线、解吸滞后角(θ)以及解吸迟滞系数TII的影响,以分子环境科学界面吸附理论为切入点阐述放射性核素110Agm在海洋环境中的不可逆吸附机制。
1 实验
1.1 材料和仪器
沉积物样品及海水样品均采自河北省海兴县黄骅港附近海域,地理坐标38°28′53.3″N,117°41′51.6″E。将去除海藻、石块及其他杂物后的海水样品过孔径0.22 μm的微孔过滤膜,真空抽滤后备用,pH=8.06,呈弱碱性。将沉积物样品置于通风橱内自然风干后用软质木质工具研磨过筛,取粒径<75 μm(200目)的沉积物颗粒作为实验介质,采用比表面分析仪(ASAP-2010,Micromeritics,USA)测得BET比表面积为187 m2/g,采用激光粒度分析仪(Mastersizer 2000,Malvern,UK)测定粒度分布,同时根据沉积物中砂粒、黏粒及粉粒三者所占比例参照谢帕德三角形判定样品类型属黏土质粉砂,沉积物矿物成分及化学成分列于表1、2。其他实验试剂NaOH、HCl均为分析纯;示踪核素110Agm为中国同辐股份有限公司进口标准源。
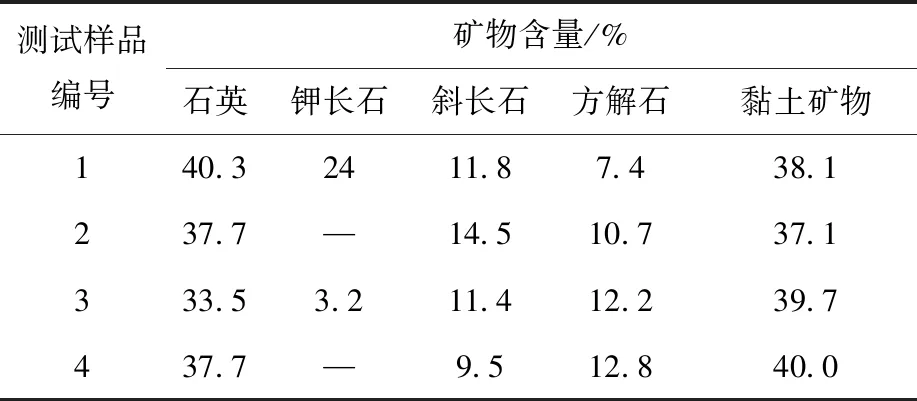
表1 沉积物矿物成分Table 1 Mineral composition of marine sediment
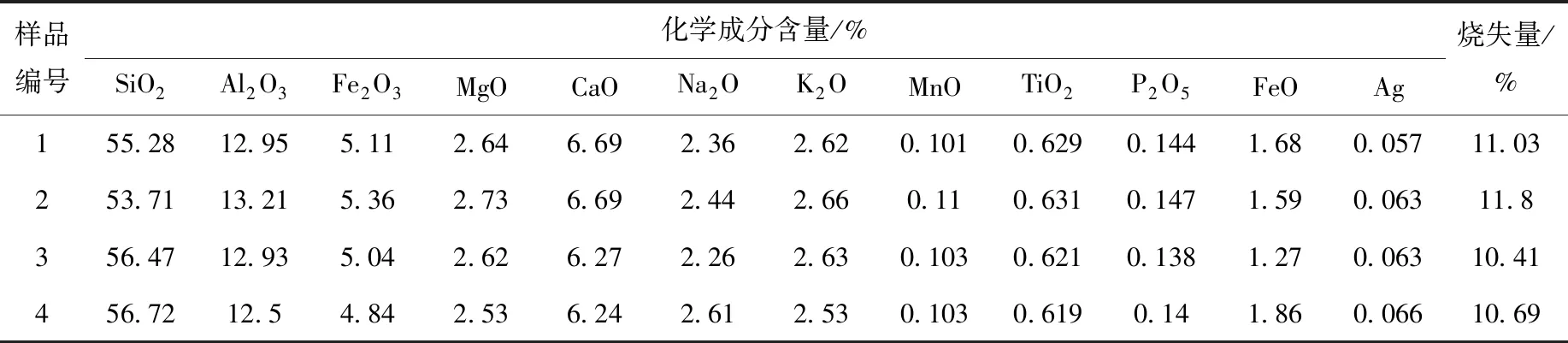
表2 沉积物化学成分Table 2 Chemical composition of marine sediment
1.2 吸附-解吸等温实验
根据吸附动力学曲线选取合适的取样时间,测定不同沉积物浓度cp和核素初始浓度c0条件下110Agm在表层沉积物上的吸附和解吸等温线。在15 mL聚四氟乙烯离心管中,依次加入一定沉积物浓度cp的沉积物悬浊液及一系列不同初始浓度c0的110Agm示踪溶液,反应体系总体积为10 mL,密封后置于恒温水浴振荡器中避光振荡,温度为25 ℃。每个浓度做3个平行样和1个空白样。吸附实验期间,利用电子pH计定期检测溶液pH值,用0.1 mol/L NaOH和0.1 mol/L HCl调节溶液pH值始终维持在8.06左右。对cp=3 g/L、c0=0.751 pmol/L的反应体系,在设定的取样时间分批次以8 000 r/min离心40 min,取8 mL上清液用0.22 μm微孔滤膜真空抽滤,用GEM40P4高纯锗γ谱仪测定滤液中110Agm的浓度ce,确定反应平衡时间。其余样品待反应平衡后一次性取出测量。由空白实验得到器壁吸附和挥发造成的110Agm损失<5%。根据初始浓度c0与平衡浓度ce之差计算沉积物的平衡吸附量qe,并得到不同沉积物浓度下的吸附等温线。平衡吸附量及吸附率分别按下式计算:
qe=(c0-ce)V/m
(1)
R=at/a0
(2)
式中:V为反应体系体积,L;m为吸附剂质量,g;R为吸附率,%;at为t时刻吸附剂总活度,Bq;a0为初始时刻反应体系总活度,Bq。
每组吸附等温实验对应1组解吸等温实验,解吸实验具体操作如下:将吸附实验完成后的沉积物悬浊液2 mL加入到8 mL海水样品中,用0.1 moL/L NaOH和0.1 moL/L HCl调节溶液pH值维持在8.06左右,其他条件与吸附实验均保持一致,待解吸平衡后离心测量上清液得到不同沉积物浓度cp下的解吸等温线,之后再如此更换上清液3次,即解吸实验连续进行4次得到不同初始浓度c0条件下的解吸等温线。
2 结果与讨论
2.1 沉积物对110Agm的吸附动力学
cp=3 g/L、c0=0.751 pmol/L、pH=8.06条件下,110Agm在沉积物表面的吸附动力学曲线示于图1。由图1可见,0~24 h内,吸附量qt首先呈指数快速增长,t=24 h时吸附率R达62.43%,24 h后随着沉积物表面覆盖度的增加及表面活性点位的减少,吸附速率变化缓慢,吸附逐渐趋于平缓,吸附动力学过程存在快慢两个阶段。为确保整个吸附体系达到平衡,本实验选取的反应平衡时间为168 h,此时平衡吸附率R=78.31%。

图1 110Agm在表层沉积物上的吸附动力学曲线Fig.1 Adsorption kinetic curve of 110Agm in surface sediment
2.2 吸附-解吸迟滞现象及其表征
110Agm在不同沉积物浓度及核素初始浓度下的吸附-解吸实验中均有明显解吸迟滞现象(图2)。目前,有2种观点可较好地解释和量化表征吸附体系解吸迟滞现象:第一种观点为潘纲等[7-10]等提出的亚稳平衡态理论,认为反应终了时,吸附态分子不是以唯一的、能量最低的方式吸附在固体表面,吸附体系平衡态可受吸附动力学过程、吸附剂沉积物浓度、核素初始浓度的影响,从而表现出不同程度的解吸迟滞性;另一种观点为吸附剂表面微孔结构的大小及其在环境变化时结构形态的改变是造成体系吸附-解吸迟滞现象的主要原因[14-16]。
参照文献计算方法给出2种表征吸附-解吸迟滞性的参数:吸附与解吸等温线之间的夹角定义为吸附滞后角θ[17],反映的是吸附体系不可逆程度,θ越大表明体系的不可逆程度越高;Sander等[18]基于热力学理论提出的解吸迟滞系数TII,其值根据某一吸附体系实际解吸状态和与之相对应的理想完全可逆解吸状态之间自由能差异计算,可有效区分由实验误差导致的解吸迟滞性和体系真实的解吸迟滞性,当吸附-解吸实验数据满足Freundlich等温吸附模型时,TII表达式可简化为:TII=1-nd/ns,式中nd和ns分别为由Freundlich等温吸附模型拟合的吸附、解吸参数,TII绝对值一般介于0~1之间,越接近0,表明吸附体系可逆性越强,反之越弱。
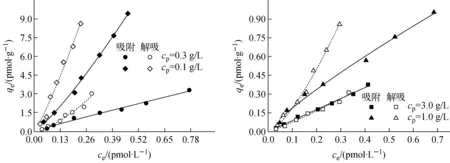
图2 110Agm在4个浓度沉积物上的吸附-解吸等温线Fig.2 Adsorption-desorption isotherms of 110Agm on sediment under four sediment concentrations
2.3 沉积物浓度对110Agm解吸迟滞性影响
25 ℃下,110Agm在4种浓度沉积物上的吸附-解吸等温线示于图2。吸附-解吸等温线的线性相关系数R2均大于0.95,表明Freundlich等温吸附模型可很好地描述不同沉积物浓度下的吸附-解吸。由θ和TII来描述不同沉积物浓度对110Agm解吸滞后性的影响,即根据吸附-解吸等温线计算θ,由Freundlich等温吸附模型拟合得到的n计算TII,结果列于表2。Freundlich等温吸附模型表达式如下:
(3)
式中:KF为弗林德利常数;n为非均质系数。
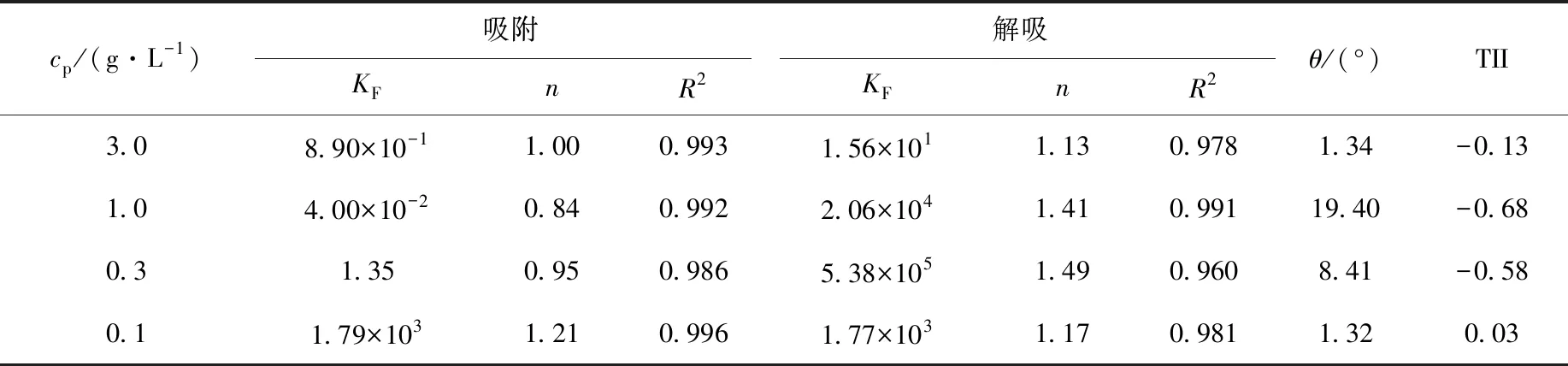
表2 吸附-解吸等温线Freundlich模型拟合参数Table 2 Parameters of Freundlich model for adsorption-desorption on sediment
由图2可看出,当反应温度为25 ℃、cp从0.1 g/L增加至1.0 g/L时,吸附等温线快速下降;当cp从1.0 g/L增加至3.0 g/L时,吸附等温线下降幅度逐渐减小,整体上体系吸附等温线随沉积物浓度的升高明显下移,110Agm在海洋沉积物中的吸附存在明显的沉积物浓度效应。同时,由表2可看出,随着沉积物浓度从0.1 g/L增加至1.0 g/L,θ由1.32°增加到了19.40°,而TII的绝对值也相应地由0.03增加至0.68。以上结果说明,当沉积物浓度介于0.1~1.0 g/L时,随沉积物浓度的增加解吸迟滞性逐渐增强,体系不可逆性逐渐增强,产生沉积物浓度效应的原因的确是由于沉积物浓度改变了吸附体系的不可逆性,符合亚稳平衡态理论对不可逆吸附体系实验结果的预测。但实验中发现,当沉积物浓度由1.0 g/L增加到3.0 g/L时,θ由19.40°减小到了1.34°,而TII的绝对值也相应地由0.68减小到了0.13,体系解吸迟滞性呈减小趋势,体系不可逆性逐渐减弱。表明110Agm在沉积物上的吸附滞后角θ和解吸迟滞系数TII并未随着沉积物浓度的增加而无限增大,当沉积物浓度达到3.0 g/L时,吸附滞后角θ又减小至1.34°,TII的绝对值也减小至0.13,其吸附-解吸等温线几乎重合,吸附体系接近可逆反应。
综上所述,在所研究沉积物浓度范围内(0.1~3.0 g/L),随着沉积物浓度的增加,体系解吸迟滞性呈先增大后减小的变化趋势。这是因为:在低沉积物浓度(约0.1 g/L)下,110Agm在沉积物中主要以点-点(1个吸附质分子只占据1个吸附点位)结合的弱吸附形式存在,且易从吸附剂表面脱落发生解吸,体系表现出较高的可逆性;随沉积物浓度的增加(0.1~1.0 g/L),110Agm在沉积物中则是以边-边(1个吸附质分子同时占据2个吸附点位)结合的强吸附与点-点结合的弱吸附按一定比例共存,且强弱吸附比例缓慢增加,由于存在边-边结合的强吸附,体系从宏观上表现出较强的不可逆性。而当沉积物浓度增加到一定值(≥3.0 g/L)后,吸附剂泥沙颗粒间的相互作用进一步加剧,粒子通过碰撞絮凝集聚,微小颗粒因集聚形成絮团,造成可吸附表面迅速减小,110Agm着重吸附在絮凝后的大颗粒外表面,使得颗粒有效吸附表面及强弱吸附比例减小,容易解吸下来的比例增加,体系又表现出较高的可逆性,吸附滞后角接近0°。
2.4 初始浓度对110Agm解吸迟滞性影响
对4种沉积物浓度吸附等温线上各实验点依次进行解吸实验,结果示于图3。用Freundlich模型对图3的解吸等温线进行拟合,拟合参数及由拟合参数计算的解吸迟滞系数TII及吸附滞后角θ列于表3。由表3可看出,随着体系110Agm初始浓度c0的增加,4种沉积物浓度吸附体系中解吸迟滞系数TII和吸附滞后角θ整体上都呈先减小后增大的变化趋势。以cp=0.1 g/L吸附体系为例,当初始浓度c0从0.129 pmol/L逐渐增加至1.554 pmol/L时,θ首先从7.66°减小至4.19°后又逐渐增加到13.39°,TII也从0.90逐渐减小到0.83后又增加到0.97。110Agm在其他3种浓度沉积物上的解吸也存在同样的现象。说明随初始浓度的增加,体系解吸迟滞性呈先减小后增大的变化趋势,即在一定的温度、pH值和沉积物浓度等吸附-解吸条件下,初始浓度的改变造成了吸附反应的热力学不可逆性。

空心实验点为110Agm初始浓度,由下至上依次为0.129、0.259、0.518、0.777、1.040、1.294、1.554 pmol/L图3 不同初始浓度下110Agm在沉积物上的吸附-解吸等温线Fig.3 Adsorption-desorption isotherms of 110Agm on sediment under different initial concentrations
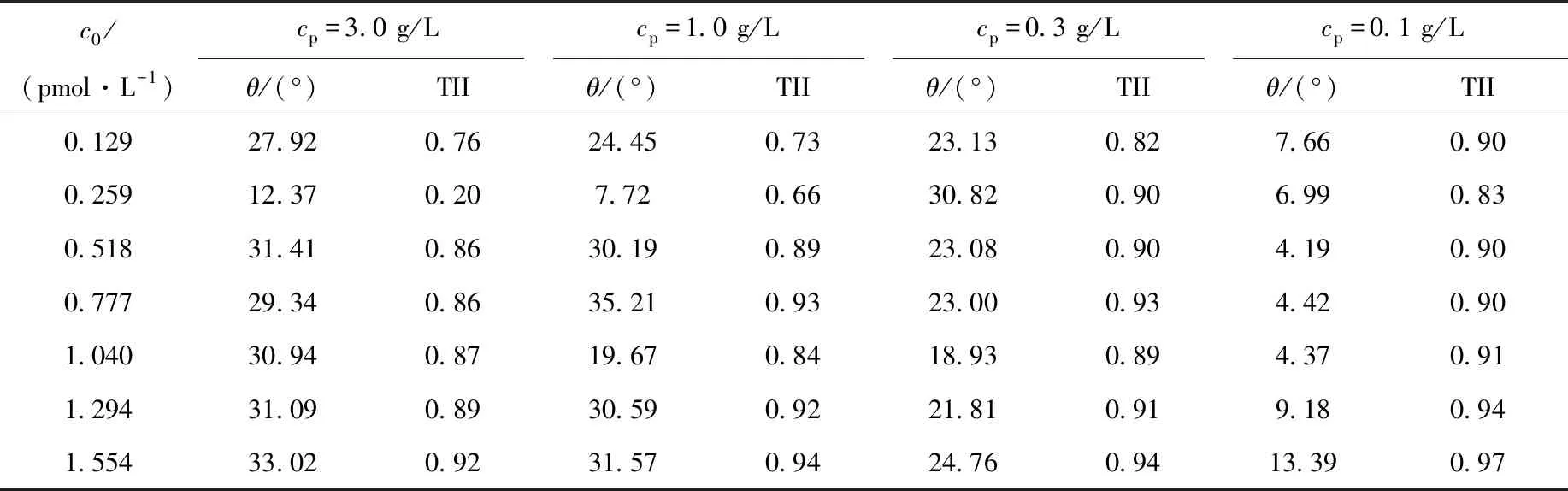
表3 不同初始浓度吸附-解吸等温线拟合θ及TII参数Table 3 Parameters of θ and TII under adsorption-desorption isotherms by different initial concentrations
表3表明,当110Agm初始浓度较低时,4种沉积物浓度下,吸附滞后角和解吸迟滞系数均相对较大,体系表现出较强的吸附不可逆性(吸附迟滞性),即在低浓度条件下占据强吸附点位的吸附质数量众多,比例较大,不易发生解吸。究其原因,当投入吸附体系的110Agm浓度较低时,沉积物表面(吸附界面)瞬间所能接触到的110Agm浓度和溶液体系相差无几,此时,吸附质浓度梯度很小,颗粒表面有效吸附点位较多,110Agm吸附速率很快,同时110Agm会优先占据吸附结合能较大的强吸附点或同时占据两个吸附点(边-边结合)而难以脱落解吸,宏观上表现出较强的解吸迟滞性。而随着初始浓度的缓慢增加,颗粒物表面这种强弱吸附比例逐渐减小,吸附在高能点位上的110Agm显著减少,容易解吸的数量缓慢增加,吸附迟滞性有所减弱。但当110Agm初始浓度足够大后,颗粒表面(吸附界面)的110Agm浓度在短时间内并不能迅速达到与溶液中保持一致,从而使溶液体系和颗粒表面之间产生浓度梯度,110Agm分子在浓度梯度力作用下会穿透或嵌入沉积物颗粒内部微孔及极微孔隙中,而海洋沉积物属非均质和表面能量各向异性明显的多孔介质,颗粒表面孔隙结构复杂多样,微孔形状大小各异,这些进入微孔的110Agm分子会发生一系列内表面扩散吸附作用,被微孔内表面吸附的分子在解吸过程中很难脱落并扩散出来,由于沉积物中还存在某些超微孔隙,孔径与110Agm分子直径相当,因浓度梯度力的作用,嵌入超微孔隙的110Agm分子会导致微孔结构变形,110Agm分子被有效禁锢在孔内不能解吸,因此当吸附质初始浓度增大到一定程度后,解吸迟滞性随初始浓度的增大又缓慢增加,整个吸附体系又表现出较高的不可逆性。
3 结论
1)110Agm在不同固体浓度海洋沉积物上的解吸行为均存在一定的解吸迟滞性,吸附等温线随沉积物浓度升高而降低的现象明显,体系吸附可逆性与沉积物浓度密切相关,即存在明显的沉积物浓度效应。
2)110Agm在不同沉积物浓度下的解吸滞后角θ和解吸迟滞系数TII并不随沉积物浓度的升高持续增大,即泥沙颗粒间因相互碰撞导致微粒絮凝是影响体系解吸迟滞性的重要因素。
3) 不同110Agm初始浓度的吸附-解吸实验表明,吸附体系均存在不同程度的解吸迟滞性,且随初始浓度的增加体系解吸迟滞性呈先减小后增大的变化趋势。
4)110Agm初始浓度对体系解吸迟滞性的影响可用110Agm与泥沙颗粒间的结合方式及吸附过程中颗粒表面微孔结构形态改变从而影响核素解吸过程来解释。随初始浓度的增加,颗粒表面强弱吸附比例逐渐减小,解吸迟滞性逐渐减弱,而当初始浓度增加到一定值后,颗粒表面的浓度梯度力迫使110Agm分子嵌入微孔内部并破坏微孔及孔隙结构,使内表面吸附质分子难以解吸扩散,造成体系解吸迟滞性显著增强。

