生防放线菌ZZ-9耐药菌株的微波诱变选育
陈大为,薛应钰,沈志彦,毛维兴,张树武,徐秉良
(甘肃农业大学植物保护学院 甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070)
放线菌存在于各种自然环境中,种类繁多,代谢功能各异,能够产生种类丰富具有生物活性的次级代谢产物,被广泛用于植物病害的防治中[1]。但目前单独使用生防因子来控制作物病害,往往受到环境条件等因素的干扰,造成田间防治效果不稳定[2]。尤其是为了减轻病害造成的经济损失,多年来都依赖化学杀菌剂,但长期过量使用化学农药对农产品的品质和食用价值产生了严重的影响,而且导致病菌抗药性问题日益突出[3]。因此,有必要在筛选生防菌株的过程中提高和改良野生菌株,选育出耐化学农药的优良突变型菌株,为实现生物农药与化学农药的协同作用提供科学依据。
目前的菌株改良手段主要有诱变育种[4]、原生质体融合[5]和遗传改造[6]。其中,诱变育种是一种简便、实用、应用广泛的菌种改良方法,经诱变得到的菌株其生长特性、耐药性等能力同亲本菌株相比大多有所提高[4]。近年来,国内利用诱变育种手段来对微生物菌株进行耐药性改良方面的研究已有相关报道。岳素红[7]等利用紫外线对球孢白僵菌菌株Bb00进行诱变处理,获得3株耐800 mg·L-1吡虫啉的突变菌株。李剑锋等[8]以红豆草根瘤菌RS-1为原始菌株进行微波诱变处理,筛选出一株耐80 mg·L-1卡那霉素和300 mg·L-1青霉素菌株RSW-96。田连生[9]等利用紫外线重复诱导处理的方法,对拮抗性木霉T21进行改良,筛选到5株在多菌灵2 000 mg·L-1浓度下仍能较好生长的具有显著抗性的菌株T21-1~T21-5。但是,目前国内利用微波诱变育种手段对放线菌菌株进行耐药性改造的报道较少。放线菌ZZ-9是前期从苹果树根际土壤中分离出的一株生防菌,其发酵液对苹果树腐烂病菌的抑制率为96.4%,在离体枝条上对苹果树腐烂病的防效达75%以上[10]。因此,本试验以放线菌ZZ-9为试验材料,对其进行微波诱变处理,拟筛选出能够与甲基硫菌灵混配的突变菌株,为新型农药的研发提供一定的理论依据。
1 材料与方法
1.1 材料
供试菌株:放线菌(Streptomycesrochei)ZZ-9 和苹果树腐烂病菌(Cytosporasp.)由甘肃农业大学植物保护学院植物病原学实验室提供。
供试药剂:甲基硫菌灵(70%,可湿性粉剂)由山东曹达化工有限公司生产。
1.2 方法
1.2.1 出发菌株的制备 取新鲜斜面培养的放线菌1支,加入5 mL无菌生理盐水(1%),用接种针小心刮取斜面孢子使其悬浮于生理盐水中,充分震荡,然后将菌液转入无菌管中,经无菌滤纸过滤,收集单孢子悬浮液,调整浓度为106CFU·mL-1左右,即为出发菌株。
1.2.2 甲基硫菌灵对出发菌株孢子致死浓度的确定 将制备好的出发菌株ZZ-9孢子悬液涂布于含浓度分别为0、10、30、50、70 μg·mL-1甲基硫菌灵的高氏一号平板上,每处理3个重复,28℃培养5~7 d,统计不同平板上的菌落数,并计算致死率。当某个较高浓度平板上未长出菌落时,该浓度即为甲基硫菌灵对出发菌株孢子的致死浓度。
致死率(%)=(不含甲基硫菌灵平板上长出的菌落数-含甲基硫菌灵平板上长出的菌落数)/不含甲基硫菌灵平板上长出的菌落数×100,式中菌落数单位为CFU·mL-1。
1.2.3 微波诱变剂量的测定及突变菌株的获得 将装有出发菌株ZZ-9孢子悬液的三角瓶置于含有冰块的烧杯中,于微波炉(生产厂家:格兰仕微波炉电器有限公司;型号:P70D20P-TD(W0);输出功率:750 W;脉冲频率:2450 MHz)内分别照射0、15、30、45、60、75 s。分别取孢子悬液0.1 mL涂布于含致死浓度的甲基硫菌灵和不含甲基硫菌灵的高氏一号平板上,每处理3个重复,28℃培养5~7 d,在含致死浓度甲基硫菌灵的高氏一号平板上长出的菌落即为突变菌株,对其进行编号,统计菌落数,计算其存活率、致死率和突变率,并将单菌落挑接于高氏一号斜面培养基上,28℃培养5~7 d,待斜面孢子丰满,于4℃冰箱保存。
存活率(%)=n1/n0×100
致死率(%)=(n0-n1)/n0×100
突变率(%)=n2/n0×100
式中,n0为出发菌株在不含甲基硫菌灵的高氏一号平板上长出的菌落数;n1为出发菌株微波处理后在不含甲基硫菌灵的高氏一号平板上长出的菌落数;n2为出发菌株微波处理后在含致死浓度甲基硫菌灵的高氏一号平板上长出的菌落数,菌落数单位均为CFU·mL-1,下同。
1.2.4 耐药菌株的筛选
(1)耐药菌株的初筛。采用平板对峙法[11]进行筛选,用“十”字交叉法在 PDA (马铃薯葡萄糖琼脂培养基)平板背面做标记,中心位置接倒置的苹果树腐烂病菌菌饼(d=5 mm),“十”字两端等距离( 距中心位置30 mm) 接倒置的各耐药性菌株和亲本菌株(未经任何处理的菌株ZZ-9)菌饼,每处理3个重复,以只接苹果树腐烂病菌作为对照,28℃下恒温培养,待对照菌丝铺满整个平板时,用十字交叉法测量菌落生长直径,计算生长抑制率。
生长抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-5)×100,式中菌落直径单位为cm,下同。
(2)耐药菌株的复筛。将耐药菌株与亲本菌株菌体接种在80 mL种子发酵培养基(液体高氏一号培养基)中,于28℃和180 r·min-1摇瓶培养3 d后,制成种子液,然后再按6%的接种量接入到装液量为60 mL的发酵培养基(小米浸汁培养基)中,在上述条件下振荡培养4 d后,于4℃、1 000 r·min-1条件下离心20 min,取上清液经0.22 μm微孔过滤器过滤,收集发酵滤液(原液),于4℃保存备用。
用菌丝生长速率法[12],取制备好的无菌发酵原液2 mL 与冷至45℃左右的 PDA培养基18 mL加入无菌培养皿内,混匀制成含发酵液的平板,在平板中央接入苹果树腐烂病菌菌饼(d=5 mm) ,每处理3个重复,以加入无菌水的PDA作对照,28℃下恒温培养,待对照将铺满整个平板时,用十字交叉法测量菌落生长直径,计算生长抑制率。
生长抑制率(%)=(对照菌落直径-处理菌落直径)/
(对照菌落直径-5)×100
1.2.5 耐药菌株传代稳定性测定 将筛选出的突变菌株孢子悬浮液分别涂布于含致死浓度甲基硫菌灵和不含甲基硫菌灵的高氏一号培养基上,于 28℃恒温培养,每 5 d 转接 1 次, 连续转接10次,每处理3个重复。观察菌株每次转接后的生长状况,统计菌落数,并计算甲基硫菌灵对突变菌株的生长抑制率。
甲基硫菌灵对突变菌株的生长抑制率(%)=
(S1-S2)/S1×100
式中,S1为突变菌株在不含甲基硫菌灵的平板上长出的菌落数;S2为突变菌株在含致死浓度甲基硫菌灵的平板上长出的菌落数。
1.2.6 耐药性菌株与甲基硫菌灵协调作用离体枝条测定 采用烫伤接种法[13],截取10 cm长的离体枝条,先用自来水冲洗干净,后用75%乙醇消毒15 s,再用无菌水冲洗,置于超净工作台晾干,以备试验用。用铁钉钉帽(d=5 mm)烫伤枝条,将耐药性菌株活菌液与甲基硫菌灵药液分别按9∶1、8∶2、7∶3的比例以及耐药性放线菌活菌液和甲基硫菌灵单独处理涂抹于伤口及周围,晾干后接种培养5 d的苹果树腐烂病菌饼(d=5 mm)。共5个处理,每个处理接种6个枝条,每个枝条1个接种点,以先涂抹无菌水后接种病原菌为对照。25℃保湿培养10 d后用“十”字交叉法测量病疤长度,并计算病疤面积和防效。

防治效果(%)=(对照病疤面积-处理病疤面积)/对照病疤面积×100,式中病疤面积单位为mm。
2 结果与分析
2.1 甲基硫菌灵对出发菌株孢子致死浓度的确定
通过甲基硫菌灵对出发菌株孢子致死浓度的测定,结果表明(表1),出发菌株孢子致死率随着甲基硫菌灵的浓度增加而升高,当甲基硫菌灵的浓度达到70 μg·mL-1时,出发菌株孢子致死率为100%,因此当甲基硫菌灵浓度为70 μg·mL-1时为耐药菌株致死突变标志。
2.2 微波诱变剂量的确定
通过微波对菌株ZZ-9孢子的致死作用和诱变作用测定,结果表明(表2),随着微波时间的增加,菌株ZZ-9孢子存活率下降,致死率逐渐上升,当剂量达到75 s时,存活率为0%,致死率达100%。突变率随着诱变剂量的增加,呈现先增大后减小的趋势。当微波诱变30 s时,突变率最高,达23.62%,以此作为最佳诱变条件。

表1 甲基硫菌灵不同剂量对菌株ZZ-9孢子的处理效果
注:同列数据后不同字母表示在P<0.05水平上差异显著。下同。
Note: Data in the same column followed by different letters are significantly different atP<0.05. The same below.
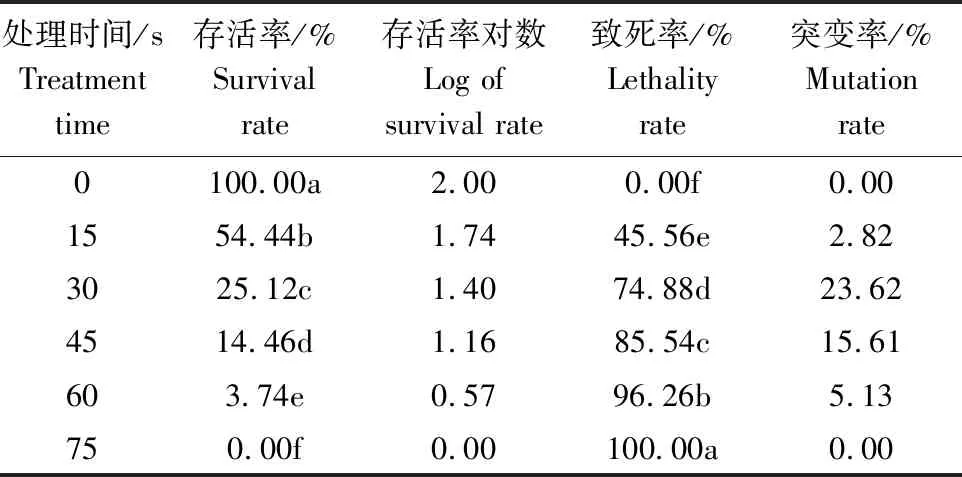
表2 不同时间微波处理对菌株ZZ-9孢子的致死率与突变率
2.3 耐药菌株的筛选
2.3.1 耐药菌株的初筛结果 通过微波诱变,获得了4株耐药菌株,分别为ZZ-9A、ZZ-9B、ZZ-9C、ZZ-9D。将4株耐药菌株与苹果树腐烂病进行平板对峙,结果表明(表3),4株耐药菌株对苹果树腐烂病菌均有一定的抑制作用(图1),其中菌株ZZ-9B的抑制作用最佳,为77.06%,与亲本菌株ZZ-9抑制率相近,仅相差0.81%;菌株ZZ-9C次之,为73.04%;菌株ZZ-9D与ZZ-9A抑制率较低,分别为58.31%、50.12%。
2.3.2 耐药菌株复筛结果 通过用菌丝生长速率法对各耐药菌株进行复筛,结果表明(表4),4株耐药菌株无菌滤液对苹果树腐烂病菌均有一定的抑制作用(图2),其中耐药菌株ZZ-9B抑制率最高,为91.75%,与亲本菌株ZZ-9抑制率接近,仅相差2.41%,且显著高于其他耐药性菌株;耐药菌株ZZ-9C与ZZ-9D抑制率次之,分别为83.90%、82.29%;菌株ZZ-9A抑制率较低,为79.48%。
2.4 耐药菌株的传代稳定性测定
通过将上述筛选出的耐药性菌株连续10次转接后发现(表5),甲基硫菌灵对各耐药性菌株生长抑制率的影响基本保持稳定,表明突变菌株的耐药性没有随着传代培养而消失。其中ZZ-9B的生长抑制率仍保持最低。因此,将耐药菌株ZZ-9B确定为最佳耐药菌株,用于后续试验。
2.5 耐药性菌株与甲基硫菌灵协同作用对苹果树腐烂病的防效
通过协同作用离体枝条测定,结果表明(表6,图3),耐药性菌株ZZ-9B 与70 μg·mL-1甲基硫菌灵按3种比例混配后,在离体枝条上对苹果树腐烂病的防效达82.01%~89.42%,均显著高于单独使用耐药菌株和甲基硫菌灵药剂。其中当菌株ZZ-9B和甲基硫菌灵的配比为8∶2时,病疤扩展面积最小,为50.44 mm2,显著小于对照,防效高达89.42%,而单独使用耐药性菌株ZZ-9B和甲基硫菌灵时,病疤扩展面积分别为114.22、98.84 mm2,防效分别为75.97%和79.24%。
3 结论与讨论
微波诱变作为一种新型诱变手段,因其能够在短时间内得到优良高效、性质稳定的突变株,且与传统的诱变育种方法相比,能够大幅提高菌株突变率,减少突变谱窄等弊端,目前在微生物菌种改良方面已广泛应用[14]。本试验微波辐照30 s条件下,菌株ZZ-9致死率为74.88%,突变率为23.62%,且能够耐70 μg·mL-1甲基硫菌灵,多代遗传后耐药性仍保持稳定,且其抑菌率接近原始菌株,与前期研究结果基本一致。李剑峰等[8]研究发现在微波辐照30 s条件下,诱变获得一株耐80 mg·L-1卡那霉素和300 mg·L-1青霉素的双抗菌株,且多代转接后,遗传稳定性良好。涂璇[15]等研究报道,在微波辐照30 s下,获得一株耐4 μg·mL-1庆大霉素的菌株。因此,利用微波诱变对放线菌ZZ-9 耐药菌株进行选育具有可行性。
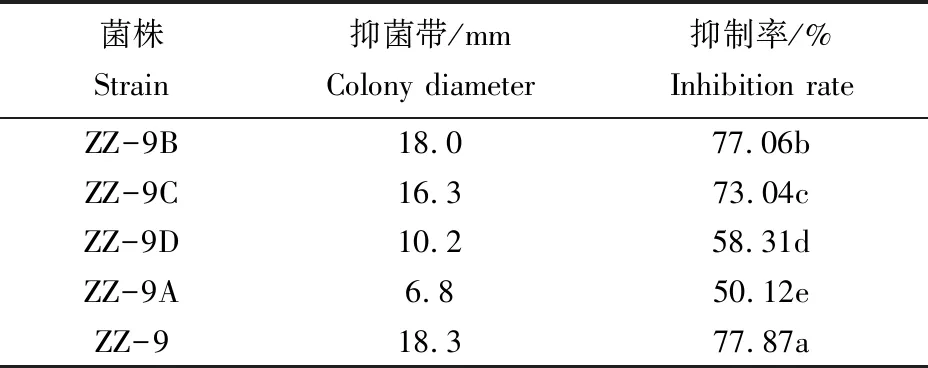
表3 耐药性菌株对苹果树腐烂病菌的抑制作用初筛结果
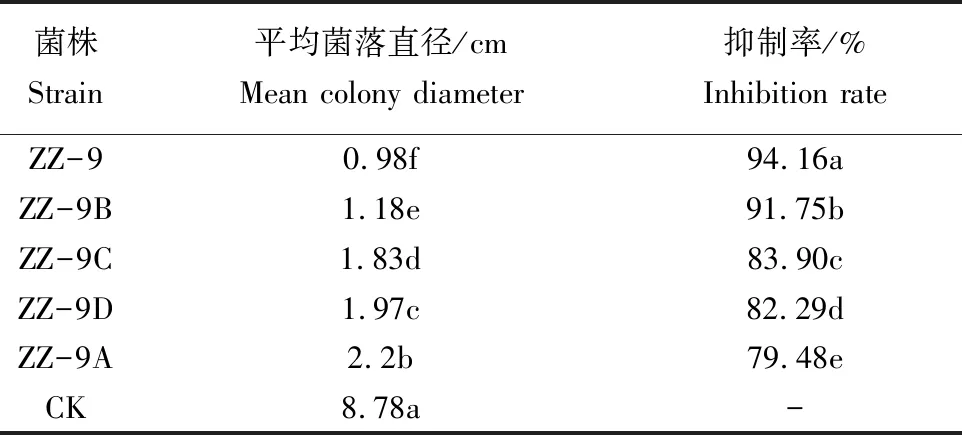
表4 耐药性菌株对苹果树腐烂病菌的抑制作用复筛结果
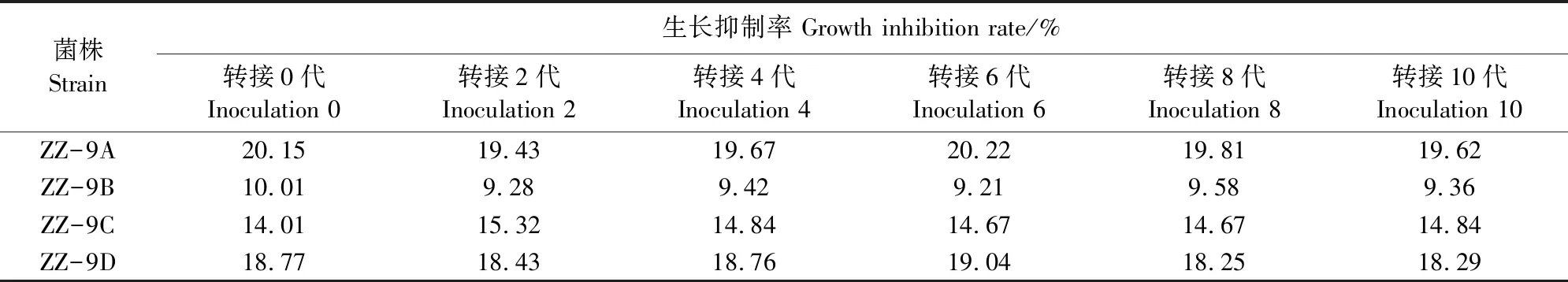
表5 甲基硫菌灵对转接后各耐药性菌株的生长抑制率测定
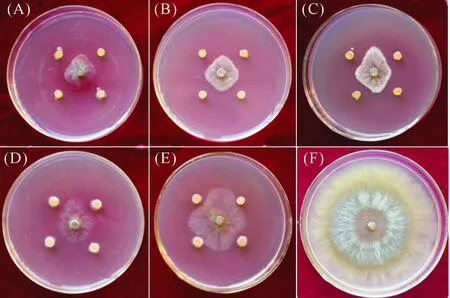
注 Note:(A)ZZ-9;(B)ZZ-9B;(C)ZZ-9C;(D)ZZ-9D;(E)ZZ-9A;(F)对照 Control。图1 耐药性菌株对苹果树腐烂病菌的抑制作用初筛结果Fig.1 First screening results of inhibition effect of chemical-resistant strains to Cytospora sp.
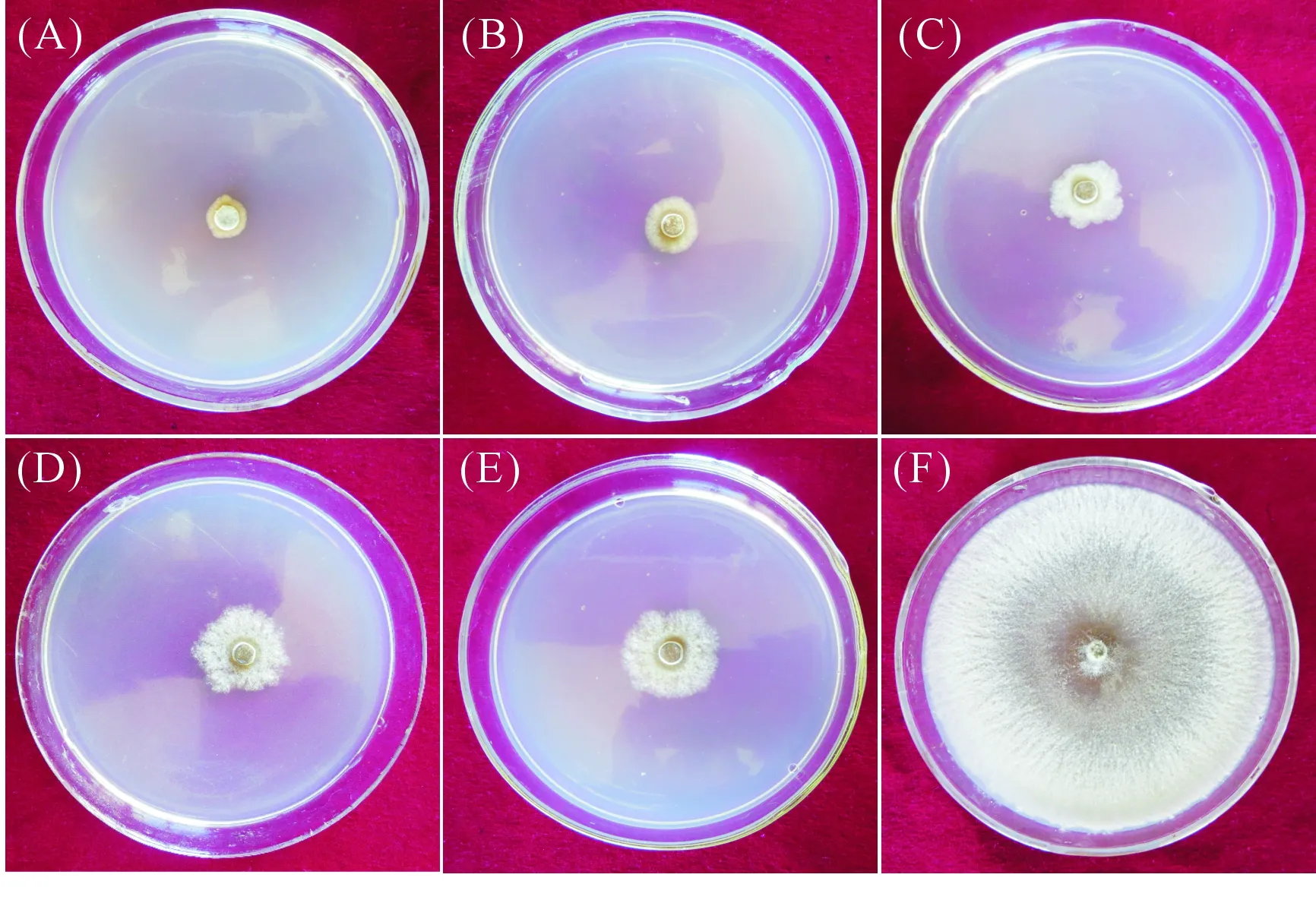
注 Note:(A)ZZ-9;(B)ZZ-9B;(C)ZZ-9C;(D)ZZ-9D;(E)ZZ-9A;(F)对照 Control。图2 耐药性菌株对苹果树腐烂病菌的抑制作用复筛结果Fig.2 Second screening results of inhibition effect of chemical-resistant strains to Cytospora sp.
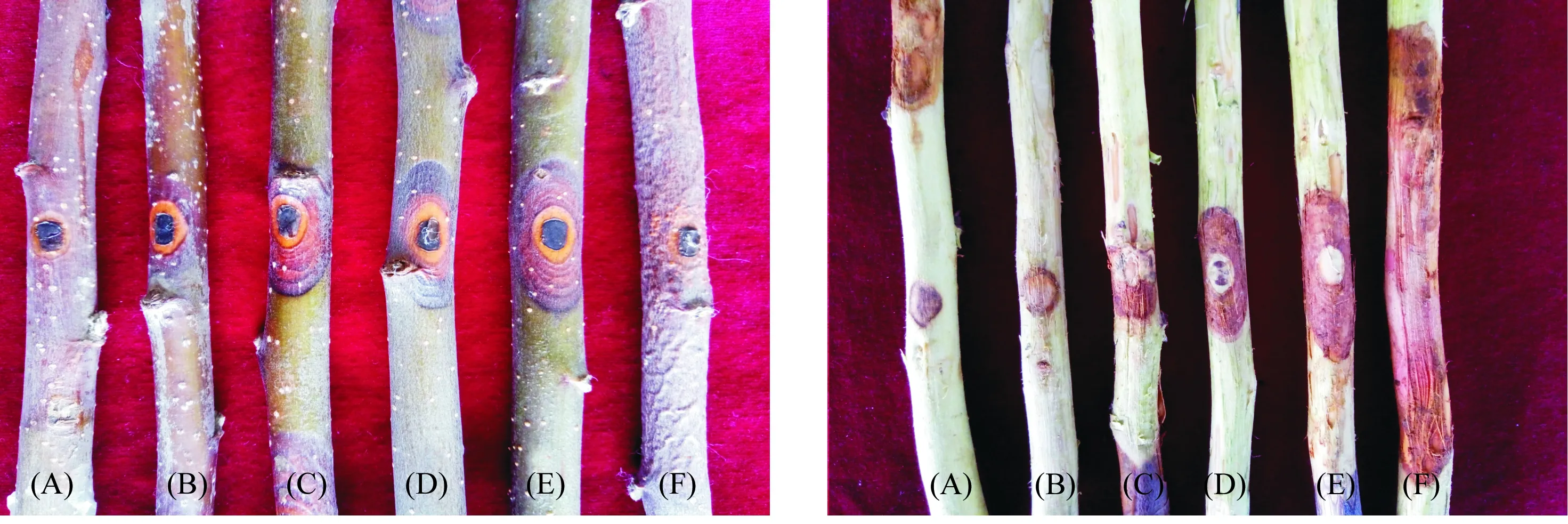
注:左图为未去表皮枝条的病疤;右图为去表皮后枝条的病疤;(A)ZZ-9B∶甲基硫菌灵为8∶2;(B)ZZ-9B∶甲基硫菌灵为7∶3;(C)ZZ-9B∶甲基硫菌灵为9∶1;(D)单独使用甲基硫菌灵;(E)单独使用菌株ZZ-9B;(F)空白对照。Note: Left chart shows scar of branches with epidermis; right chart shows scar of branches without the epidermis; (A)Strain ZZ-9B to thiophanate-methyl is 8∶2; (B)Strain ZZ-9B to thiophanate-methyl is 7∶3; (C)Strain ZZ-9B to thiophanate-methyl is 9∶1; (D)Single use thiophanate-methyl;(E)Single use strain ZZ-9B; (F) Control.图3 耐药菌株与甲基硫菌灵协同作用对苹果树腐烂病防效Fig.3 The control efficiency of synergistic action of chemical-resistant strains and thiophanate-methyl to Cytospora sp.
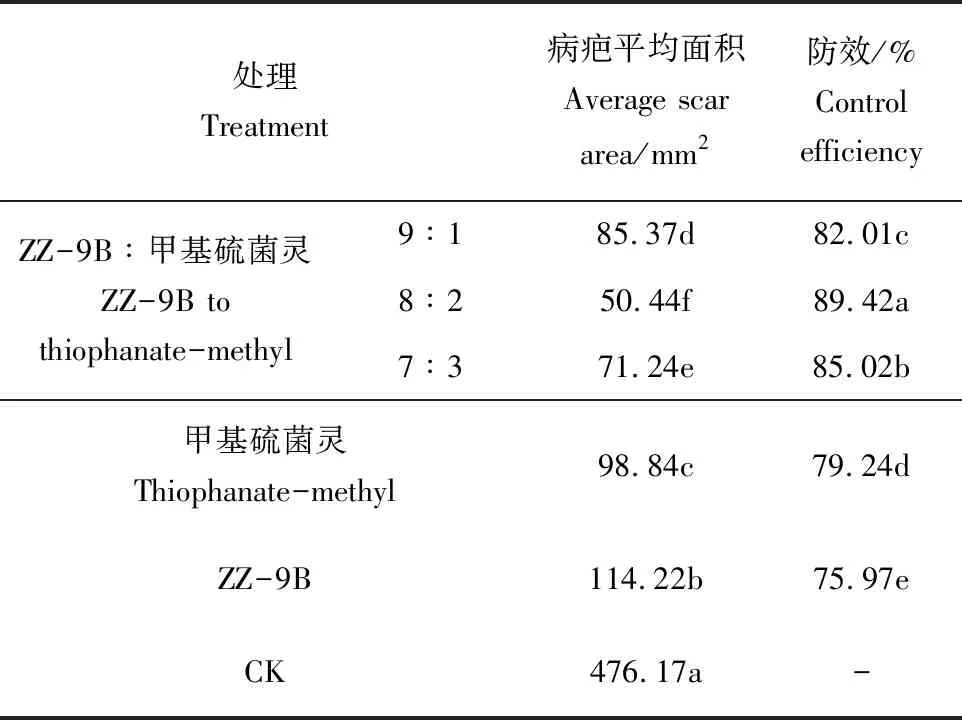
表6 耐药菌株与甲基硫菌灵协同作用对苹果树腐烂病的防效
本试验中当耐药菌株ZZ-9B与甲基硫菌灵配比为8∶2时,在离体枝条上对苹果树腐烂病的协同防效为89.42%,明显高于单独使用突变菌株和甲基硫菌灵的防效。目前,国内利用甲基硫菌灵与生防菌株混合对植物协同作用方面的研究已有报道。刘淑娟等[16]报道,利用0.001 mg·mL-1甲基硫菌灵与4种生防芽孢杆菌混配对茄腐镰刀菌的抑制作用可达78.21%~80.93%,均高于二者单独使用时的抑制率。周勇等[17]研究报道利用耐药性木霉与1 500倍的甲基硫菌灵混配,对番茄灰霉病的防效为85.90%,显著高于二者单独使用时的防效。但是有关甲基硫菌灵与放线菌混配来防治苹果树腐烂病的研究报道较少。
利用生防菌与化学药剂按适当的浓度混配,既发挥了农药杀菌速度快、防效稳定的优点,也提高了生防菌的抑菌效果,达到了两者优势互补、用量减少、防效提高的目的[18]。本研究目前仅限于室内试验,对于该菌株与其化学杀菌剂混配效果及大田应用等问题,有待于进一步研究。

