利用隶属函数法评价马铃薯组培苗的抗旱性
谢 婉,杨喜珍,杨 利,刘 磊,覃 亚,郑维列
(1.西藏大学农牧学院,西藏 林芝 860000;2.西藏日喀则市农业科学研究所,西藏 日喀则 857000)
马铃薯对水分的亏缺非常敏感[1],干旱是马铃薯生产的重要限制因素[2]。减少干旱对马铃薯的影响,筛选抗旱育种材料,选育具有综合优良性状的抗旱品种,对马铃薯产业化发展具有重大意义。马铃薯抗旱性评价的不同方法具有不同的优缺点[3]。通过渗透调节物质模拟干旱对马铃薯组培苗进行胁迫鉴定的方法相对稳定且易控制[4]。研究表明,用聚乙二醇(Polyethylene glycol,PEG)诱导水分逆境达到的效果与将土壤逐步干旱的效果一致[5]。中国已有多位学者开展了PEG 模拟根际水分胁迫法,对马铃薯试管苗进行水分胁迫处理[6-9]。目前,马铃薯抗旱性鉴定多利用干旱胁迫下马铃薯形态、生理生化指标变化的差异确定品种的抗旱性。一般认为,抗旱性品种受干旱胁迫影响较小,干旱胁迫下产量降幅、株高降幅、相对含水量的降幅、叶片质膜相对透性升高幅度小的品种抗旱性强,丙二醛(MDA)含量增幅低的品种抗旱性强[9]。
本试验采用不同浓度PEG-8000 模拟干旱胁迫,研究不同马铃薯品种(系)组培苗生长生理指标的变化,利用隶属函数法和因子分析对各指标进行综合评价,旨在探索适于马铃薯组培苗抗旱性鉴定的评价体系,为马铃薯抗旱机制的研究及抗旱品种筛选提供理论依据。
1 材料与方法
1.1 试验材料
试验于2015 年8~12 月在西藏自治区马铃薯工程研究中心完成。供试马铃薯品种(系)为‘渭薯1号’、‘东农303’、‘青薯9 号’、‘春薯2 号’、‘D613’和‘200902’共6 个品种(系)的脱毒组培苗。‘D613’为中国农业科学院蔬菜花卉研究所提供的彩色马铃薯高代品系,‘200902’为西藏自治区薯类脱毒中心提供的系统选育品系,部分研究者以产量和生理指标等计算抗旱系数进行抗旱性综合评价,认为‘青薯9 号’抗旱性较强[10,11],而‘东农303’抗旱性较弱[7,12]。其他品种(系)的抗旱性不确定。各品种特性见表1。
PEG-8000 购于Amresco 公司,化学式为HO(CH2CH2O)nH,n=108~125,纯度99.9%。
1.2 试验方法
1.2.1 PEG培养基制作
参考邓珍等[8]的方法,配制0,5%,10%,15%和20%(W/V)的PEG 溶液(含2 mmol/L MES 缓冲液),pH 调至5.8±1,高压灭菌。之后等体积倒入已灭菌凝固的MS培养基(琼脂7 g/L、蔗糖30 g/L)中,平衡72 h后,在无菌工作台上把上层液体从培养瓶中倒掉。所得的固体培养基即为含PEG 固体培养基。其中0处理不添加PEG,设为对照。
1.2.2 试验处理
将在常规培养基中预培养至长势一致的马铃薯脱毒苗按单节茎段剪切到PEG 培养基中进行培养。每瓶接入12 个茎段,每个处理80 瓶。培养瓶直径0.65 cm,内装40 mL 培养基。培养温度(23±2)℃,光强3 000 lx,每天光照16 h。培养50 d 后测定各指标,每次取3个重复,每个重复3瓶。
1.2.3 生长指标测定
用无菌水将组培苗根部培养基清洗干净,用吸水纸吸去附着在植物上的水分,将根与茎叶部分从根基部剪开,去掉原接种的单节茎段,测量最大株高和茎粗。分别称取茎叶和根两部分鲜重,将鲜样置于80 ℃烘箱内烘干72 h 至恒重,称取干重。

表1 品种(系)特性Table 1 Characteristics of varieties (lines)
1.2.4 生化指标测定
取组培苗的地上茎叶部分鲜样,丙二醛含量测定采用硫代巴比妥酸法[13],脯氨酸含量测定采用磺基水杨酸法[14],可溶性蛋白含量测定采用考马斯亮蓝G-250 法[15],可溶性糖含量测定采用蒽酮-硫酸法[16]。
1.3 数据分析
数据统计和作图采用Excel 2013 进行。方差分析、邓肯氏多重比较和因子分析采用SPSS 20。采用平均隶属函数法进行综合分析。隶属函数值公式为:
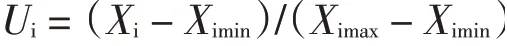
式中:Ui为第i 个指标的隶属函数值;Xi为第i 个指标的原始数据;Ximax、Ximin为样品组中第i 个指标的最大值与最小值[17]。
2 结果与分析
2.1 不同浓度PEG 胁迫对马铃薯组培苗茎长的影响
在0~20%,随着PEG 浓度的升高,各品种(系)的马铃薯组培苗茎长表现出逐渐降低的趋势(表2),在不含PEG 的培养基中马铃薯组培苗生长最好,在5%PEG 下,各品种(系)茎长相比对照的茎长已显著降低(P<0.05)。在20%PEG 下,马铃薯组培苗仍能生长但生长很差,说明PEG 浓度越高,马铃薯受干旱胁迫越严重。在10%PEG浓度下,‘渭薯1 号’、‘东农303’、‘青薯9 号’、‘200902’、‘D613’和‘春薯2号’的茎长相对CK分别降低了4.42,11.71,6.64,6.15,5.92 和6.50 cm。随着PEG 浓度的升高,茎长下降趋势减缓,其中‘青薯9号’在15%PEG下与10%PEG下的茎长已不具有显著差异,‘东农303’、‘200902’、‘D613’在20%PEG 下与15%PEG 下的茎长已不具有显著差异。茎长变异系数最大的是‘东农303’,最小为‘渭薯1号’,说明‘东农303’茎长受PEG影响较大,‘渭薯1号’茎长受影响较小。
2.2 不同浓度PEG胁迫对马铃薯组培苗根长的影响
在0~20%,随着PEG 浓度的升高,各品种(系)的马铃薯组培苗根长表现出逐渐降低的趋势(表3),在不含PEG的培养基中马铃薯组培苗生长最好,在5%PEG下,除‘渭薯1号’和‘青薯9号’,其他各品种(系)的马铃薯组培苗根长较对照具有显著差异(P<0.05),在20%PEG下,马铃薯组培苗仍能生长但生长很差。变异系数最大为‘D613’,最小为‘渭薯1号’。

表2 不同浓度PEG下马铃薯组培苗茎长(cm)Table 2 Stem length of potato plantlets in vitro under different PEG concentrations
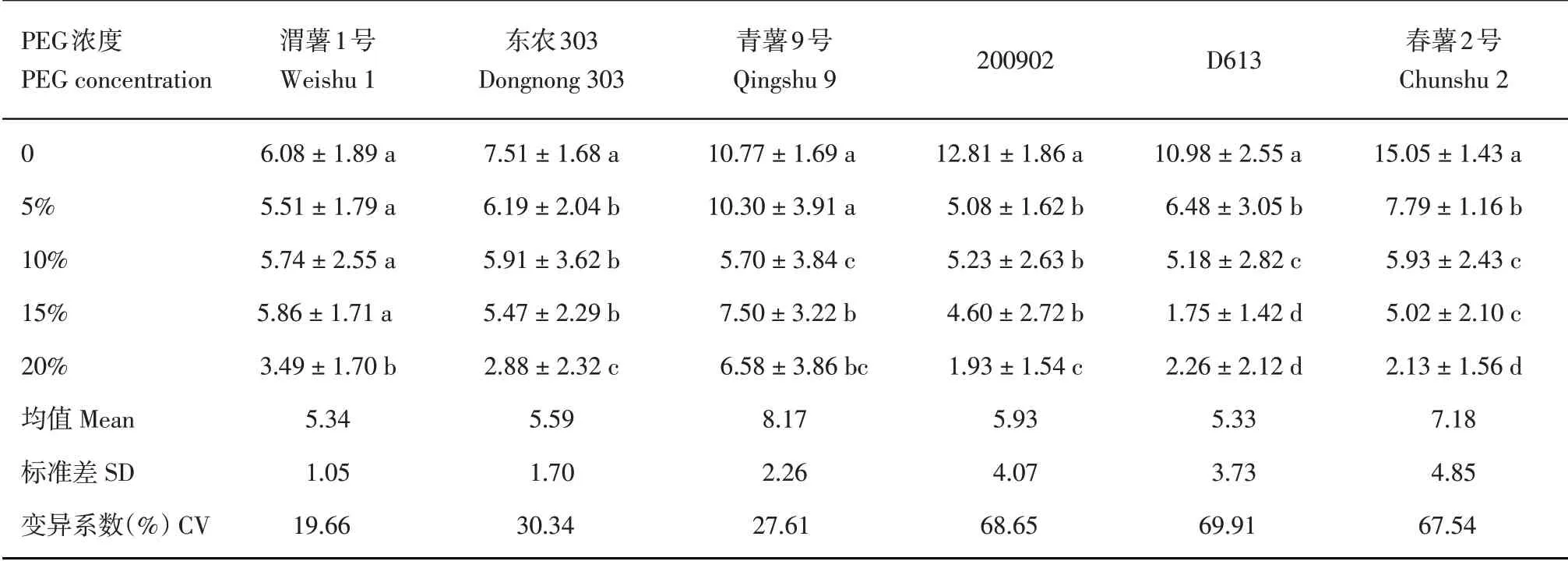
表3 不同浓度PEG下马铃薯组培苗根长(cm)Table 3 Root length of potato plantlets in vitro under different PEG concentrations
2.3 不同浓度PEG 胁迫对马铃薯组培苗茎叶鲜重的影响
在0~20%,随着PEG 浓度的升高,各品种(系)的马铃薯组培苗茎叶鲜重表现出逐渐降低的趋势(表4),说明PEG 浓度越高,马铃薯组培苗受干旱胁迫越严重。在不含PEG 的培养基中马铃薯组培苗生长最好,在5%PEG 下各品种(系)(除了‘200902’)的茎叶鲜重与CK 相比已具有显著性降低(P<0.05),同时,随着PEG浓度的升高,茎叶鲜重下降趋势减缓,除‘渭薯1号’,其他各品种(系)在20%PEG下与15%PEG下的茎叶鲜重已不具有显著差异。变异系数最大为‘200902’,最小为‘东农303’。
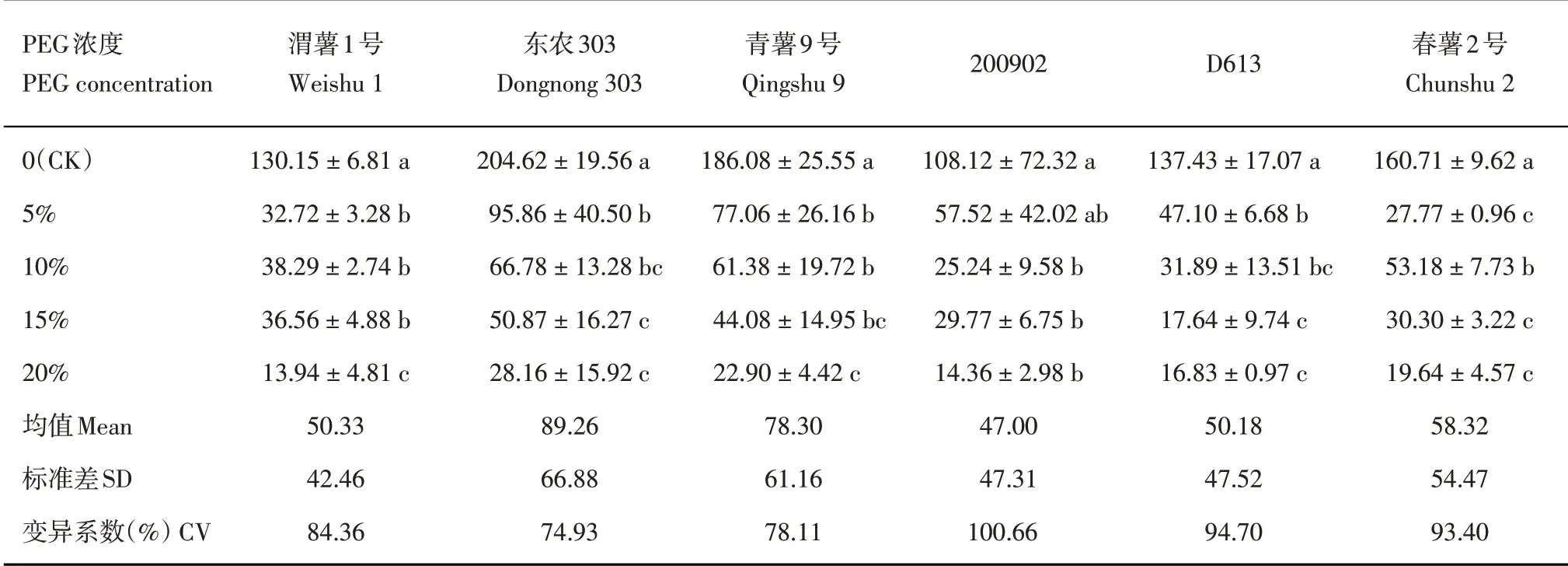
表4 不同浓度PEG下马铃薯组培苗茎叶鲜重(mg)Table 4 Stem and leaf fresh weight of potato plantlets in vitro under different PEG concentrations
2.4 不同浓度PEG 胁迫对马铃薯组培苗根鲜重的影响
在0~20%,随着PEG 浓度的升高,各品种(系)的马铃薯组培苗根鲜重表现出逐渐降低的趋势(表5),且根鲜重降低的趋势随着PEG浓度的升高逐渐减缓。在5%PEG下,除‘青薯9号’,其他各品种(系)的根鲜重与CK 相比显著降低(P<0.05)。除‘春薯2 号’,其他各品种(系)组培苗根鲜重在15%与20%PEG 下无显著差异。变异系数最大为‘D613’,最小为‘青薯9号’。

表5 不同浓度PEG下马铃薯组培苗根鲜重(mg)Table 5 Root fresh weight of potato plantlets in vitro under different PEG concentrations
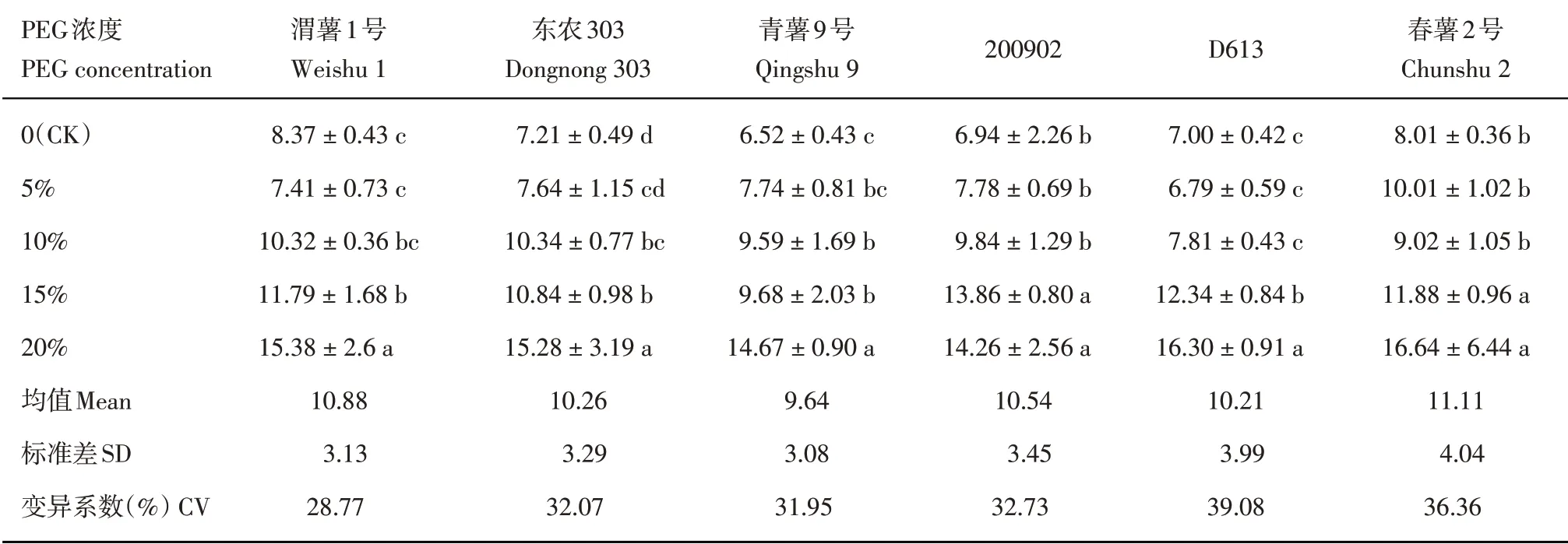
表6 不同浓度PEG下马铃薯组培苗茎叶干物质含量(%)Table 6 Stem and leaf dry matter contents of potato plantlets in vitro under different PEG concentrations
2.5 不同浓度PEG胁迫对马铃薯组培苗茎叶干物质含量的影响
在不同的PEG 浓度下,各品种(系)的茎叶干物质含量具有显著差异(P<0.05)。在0~20%,随着PEG 浓度的升高,各品种(系)的马铃薯组培苗茎叶干物质含量表现出逐渐升高的趋势(表6),在低浓度PEG 下变化不显著,在高浓度下显著升高。变异系数最大的品种为‘D613’,最小的为‘渭薯1号’。
2.6 不同浓度PEG胁迫对马铃薯组培苗根干物质含量的影响
在不同的PEG 浓度下,各品种(系)的根干物质含量具有显著差异(P<0.05)。在0~20%,随着PEG浓度的升高,各品种(系)的马铃薯组培苗根干物质含量表现出逐渐升高的趋势(表7)。变异系数最大的为‘200902’,最小为‘春薯2号’。
2.7 不同浓度PEG胁迫对马铃薯组培苗脯氨酸含量的影响
在0~20%,随着PEG 浓度的升高,各品种(系)的马铃薯组培苗脯氨酸含量表现出逐渐升高的趋势(表8),说明干旱会导致马铃薯植株脯氨酸的积累,是其抵御干旱的一种积极调节机制。其中‘200902’和‘渭薯1 号’在20%PEG 下略微下降。‘青薯9 号’的脯氨酸涨幅最大,其次是‘东农303’,‘200902’的涨幅最小,20%PEG 下脯氨酸的含量分别为对照的10.06,9.88和1.50倍。

表7 不同浓度PEG下马铃薯组培苗根干物质含量(%)Table 7 Root dry matter contents of potato plantlets in vitro under different PEG concentrations

表8 不同浓度PEG胁迫对马铃薯组培苗脯氨酸含量的影响(μg/g FW)Table 8 Effect of different concentrations of PEG stress on proline contents of potato plantlets in vitro
2.8 不同浓度PEG 胁迫对马铃薯组培苗可溶性蛋白含量的影响
在0~20%,随着PEG 浓度的升高,各品种(系)的马铃薯组培苗可溶性蛋白含量表现出逐渐升高的趋势(表9)。其中增幅最大的是‘青薯9 号’,增幅最小的为‘东农303’,在20%PEG 下分别为CK 的11.52 和2.29 倍。说明干旱会导致植株可溶性蛋白的积累,是其抵御干旱的一种积极调节机制。
2.9 不同浓度PEG 胁迫对马铃薯组培苗丙二醛含量的影响
‘D613’丙二醛浓度最高,呈现先降低后升高的趋势,‘东农303’在5%PEG 浓度下丙二醛浓度略降低,之后持续升高,其他各品种(系)丙二醛含量整体表现为上升趋势,其中‘春薯2 号’的变幅最小,‘东农303’和‘200902’变幅较大(表10)。‘东农303’的变异系数大于‘青薯9号’。
2.10 不同浓度PEG 胁迫对马铃薯组培苗可溶性糖含量的影响
‘D613’在5%PEG 浓度下可溶性糖含量比对照降低,之后持续升高,其他各品种(系)的马铃薯组培苗可溶性糖含量随着PEG 浓度的升高表现出逐渐升高的趋势(表11)。在20%PEG 下,‘渭薯1号’升高的幅度最大,其次是‘青薯9 号’,最低的是‘春薯2 号’,分别是对照的4.16,3.44 和1.93倍。‘春薯2 号’和‘200902’在5%PEG 后可溶性糖含量增高的幅度很小,而‘渭薯1 号’和‘D613’一直以较大的增长幅度增长。

表9 不同浓度PEG胁迫对马铃薯组培苗可溶性蛋白含量的影响(mg/g FW)Table 9 Effect of different concentrations of PEG stress on soluble protein contents of potato plantlets in vitro
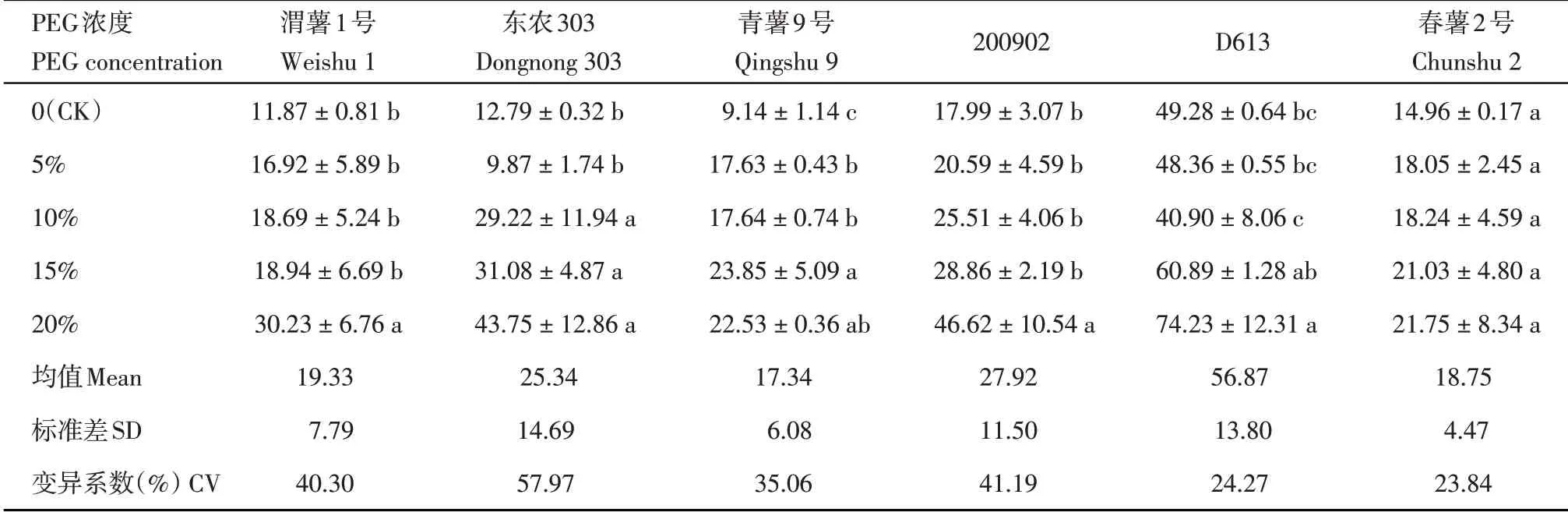
表10 不同浓度PEG胁迫对马铃薯组培苗丙二醛含量的影响(μmol/g FW)Table 10 Effect of different concentrations of PEG stress on malondialdehyde(MDA)contents of potato plantlets in vitro

表11 不同浓度PEG胁迫对马铃薯组培苗可溶性糖含量的影响(mg/g FW)Table 11 Effect of different concentrations of PEG stress on soluble sugar contents of potato plantlets in vitro
2.11 马铃薯组培苗各生长指标在不同浓度PEG胁迫下变异分析
为筛选鉴定不同品种马铃薯组培苗对干旱胁迫反应的最佳PEG 浓度,计算分析了不同浓度PEG 下各指标在不同品种间的变异系数(表12)。各指标在不同PEG 浓度下的变异系数不同,茎长变异系数在15%PEG 下最大,5%PEG 下最小;根长变异系数在20%PEG 下最大,为54.39%,在10%PEG 下最小。为综合考虑相同PEG 浓度下各指标的变异性,采用隶属函数法对各指标的变异系数进行转换,分别计算各指标的隶属函数值,比较平均隶属函数值,值越大,说明变异越大。从结果可以看出,5%PEG 胁迫下的平均隶属函数值比其他处理值高,表明在5%PEG 胁迫下品种之间测得的指标值差异较大,能更好地反应不同品种受PEG 模拟的干旱胁迫后各品种之间的差异。各指标的变异系数比较,脯氨酸、丙二醛和根鲜重的变异系数较大,说明这几个指标对干旱较敏感,而茎叶干物质含量变异系数较小,说明该指标在干旱胁迫下可以保持一定的稳定性。

表12 不同浓度PEG下品种间各指标的变异系数(%)Table 12 Coefficient of variation of various indexes under different PEG concentrations
2.12 马铃薯组培苗各生长指标在不同浓度PEG胁迫下变异分析
根据前面数据分析结果,不同品种(系)在不同PEG浓度胁迫下各指标发生了不同变化,计算各品种(系)指标在不同浓度PEG间变异系数的隶属函数值(表13)。在0~20%5个PEG浓度梯度,各指标的变异系数不同,茎长变异系数‘东农303’最大,‘渭薯1号’最小,根长变异系数‘D613’最大,‘渭薯1号’最小。采用平均隶属函数值法对各品种(系)的指标变异系数进行综合分析,变异系数从大到小依次为‘D613’、‘东农303’、‘200902’、‘春薯2 号’、‘青薯9号’和‘渭薯1号’。平均隶属函数值越大,说明该品种(系)受胁迫影响导致的生理生长变化越大。
2.13 马铃薯组培苗抗旱性综合评价
植物通过合成渗透调节物质,如脯氨酸、可溶性糖等调节渗透压,或者提高叶绿素含量,诱导合成干旱蛋白等,各种不同的机制共同作用,其最终目的都是减少干旱对植株的伤害,维持植株的正常生理代谢和能量供需平衡以维持植株的正常生长,所以植株生长指标所受影响应该是一个最直观的综合性评价指标,而MDA 是干旱对植株造成的伤害的代表性生理指标。根据分析,抗旱性强的品种茎长、根长、茎叶鲜重、根鲜重、茎叶干物质含量、根干物质含量受干旱影响相对较小,变幅较小,MDA 含量增幅小。因此,以茎长、根长、茎叶鲜重、根鲜重、茎叶干物质含量、根干物质含量、MDA 含量的变异系数为负相关指标,采用隶属函数法综合评价品种的抗旱性,分别计算各指标的隶属函数值,比较平均隶属函数值,值越大,说明抗旱性越强。

表13 不同品种(系)各指标变异系数的隶属函数值Table 13 Subordinate function values of coefficient of variation of various indexes under different PEG concentrations
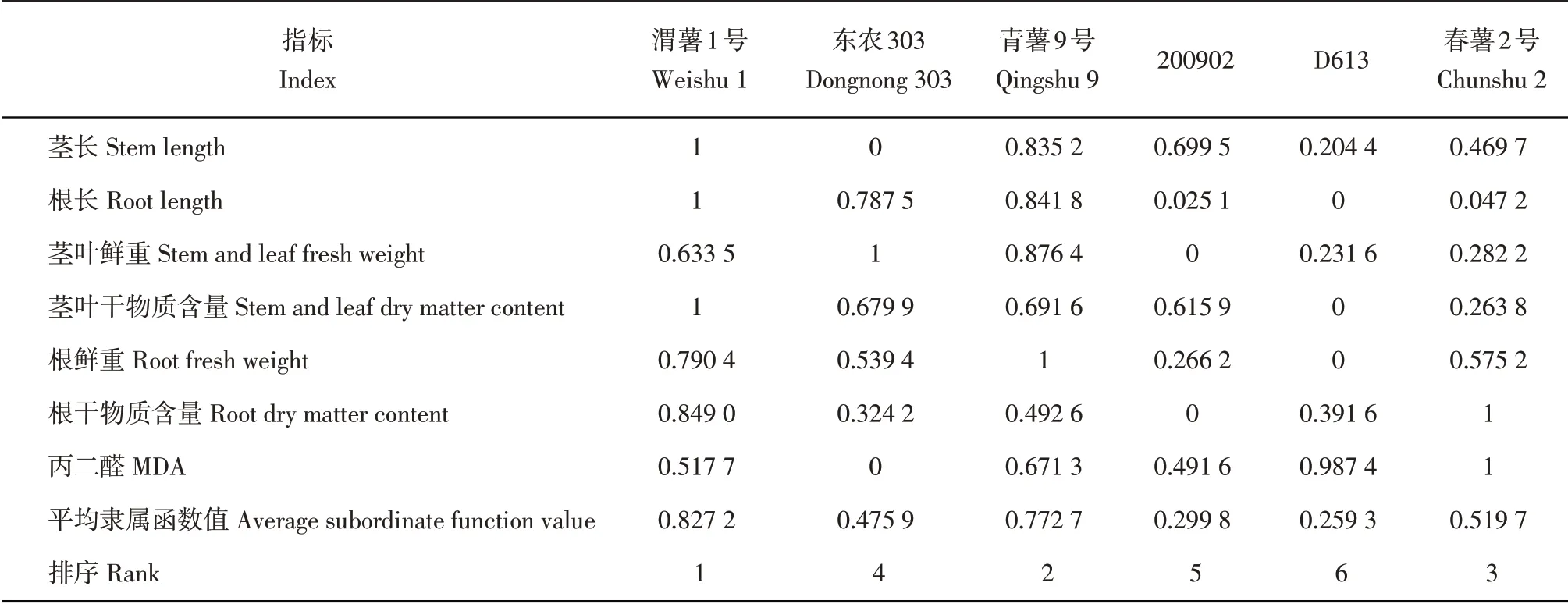
表14 抗旱性综合评价相关指标的隶属函数值Table 14 Subordinate function values of indexes related to comprehensive evaluation of drought resistance
由表14可以看出,得分最高的是‘渭薯1号’,最低的是‘D613’,因此抗旱性从强到弱依次为:‘渭薯1号’>‘青薯9号’>‘春薯2号’>‘东农303’>‘200902’>‘D613’,与实际生产基本一致。
3 讨 论
隶属函数法是植物抗逆生理实验中常用的一种方法,常用于抗旱、品质评价等需涉及多个综合指标的评价体系中,避免了使用单一指标进行评价的片面性,使评价结果更科学准确。马铃薯品种抗旱性评价目前仍无统一标准,实际生产中主要采用以产量为基础的耐旱系数为标准[18],在实际农业生产中,产量确实是耐旱的最终体现,但是该评价方法受季节限制,年际间重复结果可比性差,而且很可能会淘汰本身产量低但抗旱性很强的育种资源。很多学者采用人工气候鉴定、组培苗胁迫鉴定以及自然失水胁迫鉴定等方法以生长指标和生理生化指标评价马铃薯耐旱性[3]。采用马铃薯组培苗胁迫鉴定可以克服大田试验重复性差等弊端,是相对稳定且易控制的模拟系统。本试验采用隶属函数法对马铃薯组培苗生长指标和MDA指标的变异系数进行抗旱性综合评价,得出‘渭薯1号’和‘青薯9号’抗旱性较强,与实际生产基本相符。
供试材料马铃薯组培苗茎长、根长、茎叶鲜重、根鲜重随着PEG 浓度的升高呈下降趋势,说明随着PEG 浓度的升高马铃薯组培苗植株生长受干旱胁迫越严重,在不含PEG 的培养基中生长最好,与邓珍等[8]的研究结果一致。抗旱性强的品种受干旱影响小,茎长、根长、茎叶鲜重、根鲜重指标变幅较小。同时,随着PEG 浓度的升高,各生长指标的下降趋势渐缓,即在高浓度PEG 的环境中,马铃薯组培苗生长极其缓慢或者不生长,越接近最适生长环境植株生长的越快。
在0~20%,随着PEG 浓度的升高,各品种(系)的马铃薯组培苗茎叶干物质含量、根干物质含量表现出逐渐升高的趋势,除‘春薯2 号’,其他各品种(系)的根干物质含量的变异系数高于茎叶干物质含量的变异系数,说明根干物质含量较茎叶干物质含量对干旱的反应更为敏感。在PEG 模拟的低强度干旱环境下,马铃薯组培苗植株的茎叶干物质含量及根干物质含量变化不大,分析原因可能为组培苗在低强度干旱环境下通过自我调节机制维持组织的含水量以有效减轻干旱对自身生理活动的影响,随着干旱强度的加大,组培苗的干物质含量升高速度加快,组织的含水量快速降低,说明此时的干旱胁迫对植株已产生了严重影响。抗旱性强的品种茎叶干物质含量、根干物质含量受干旱影响相对较小,变幅较小。
目前,部分研究认为水分胁迫下脯氨酸积累与抗旱性成正相关[19-21],另一部分研究认为脯氨酸累积是逆境胁迫产生的结果,与品种的抗旱性无关[22-24]。一部分研究认为干旱胁迫下游离脯氨酸含量的变化可作为衡量马铃薯抗旱能力的指标,抗性强的品种脯氨酸含量增加的幅度较小[25]。还有一部分研究认为旱性强的品种增幅较大[26-29]。因此脯氨酸与植物抗性的关系还有待进一步研究。
植物在受到非致死干旱胁迫时能够诱导合成干旱诱导蛋白,具有保护细胞结构,增强耐脱水能力,参与渗透调节,制约离子吸收等作用[30]。本文在0~20%,随着PEG 浓度的升高,各品种(系)的马铃薯组培苗可溶性蛋白含量表现出逐渐升高的趋势。岳勇丽[31]在研究杨梅(Myrica rubra Sieb.et Zucc.)发现部分品种可溶性蛋白含量随着干旱胁迫程度的加剧而增加,部分品种可溶性蛋白含量的变化呈现先上升后下降的变化趋势,与侯栋等[32]、李志燕[26]研究结果一致。因此可溶性蛋白的变化趋势有待进一步研究。
丙二醛是膜脂过氧化的主要产物之一,反映了植物细胞受伤害的程度,可用于表示细胞内氧自由基积累导致的膜脂过氧化程度的强弱[33,34]。大部分研究发现,植物在干旱胁迫下丙二醛含量会增加,抗旱性强的品种受干旱胁迫伤害相对较小,MDA 的含量增加较小[25,28,35]。大部分研究认为MDA 可作为马铃薯重要的抗旱鉴定指标,抗旱性强的品种膜质过氧化作用小,抗旱性较强的品种含量增幅低于抗旱性较弱的品种[3],与本文研究结果一致。
可溶性糖是一种重要的渗透调节物质[36]。干旱胁迫下,作物体内常常积累大量的可溶性糖以提高细胞渗透势,降低细胞的水势,减少水分的流失;某些可溶性糖能直接与细胞组分分子相连接,对细胞膜与酶起到稳定作用[37]。本研究中可溶性糖含量随着PEG浓度的升高表现出逐渐升高的趋势,与焦志丽等[38]的研究结果一致。而贾琼[39]研究中马铃薯在苗期一定的水分胁迫范围内可溶性糖含量增加,但是随着胁迫的加剧,可溶性糖含量变化不一,这些差异可能是由于不同品种对干旱的应对机制不同所致,因此可溶性糖含量作为抗旱指标还有待进一步研究。
邓珍等[8]研究认为固体培养下15%PEG-8000浓度下品种间差异最大,是鉴定马铃薯品种组培苗对干旱胁迫反应的最佳浓度。李志燕[26]认为固体培养条件下8%PEG-6000 浓度为鉴定和评价不同马铃薯品种之间耐旱性强弱的最佳浓度。王谧[9]研究认为浓度为5%的PEG-6000 下马铃薯生长指标变化达到显著差异。本次研究结果为固体培养下5%PEG-8000 胁迫下培养50 d 能更好地反应马铃薯组培苗受PEG 模拟的干旱胁迫后各品种之间的差异。由于各品种耐旱性不同,抗旱性差的品种可能在低浓度的PEG 下,或者在短期的高浓度PEG 胁迫下各生理指标表现出较大的变化,而抗旱性强的品种可能在高浓度的PEG 下或者在长时间的低浓度PEG 胁迫下才表现出较大的变化,而从不同的指标来看,对干旱敏感的指标,可能在低浓度PEG 下就表现出较大的变化,对干旱不敏感的指标,可能在高浓度的PEG 胁迫下或者长时间低浓度的PEG 胁迫下才表现出较大的变化,因此在考虑最适PEG 胁迫浓度时,应结合品种、胁迫时间等因素。而且由于不同的品种抗旱机制不同,有些品种对干旱敏感,在低强度的干旱胁迫下就表现出强烈的变化,随即诱导相应抗旱机制的启动,以减轻干旱对植株的伤害,而某些品种忍耐能力强,在低强度的干旱胁迫下不受影响,在高强度的干旱胁迫下才启动相应的抗旱机制,因此单采用某一个强度的干旱胁迫或许并不能完全反映植物的全部抗旱机制,不能对抗旱性进行准确的判断。
不同品种受干旱影响后各指标的变异系数不同,‘渭薯1 号’的变异主要受可溶性糖含量的影响,而‘东农303’的变异主要受丙二醛含量的影响,可能与不同品种抗旱机制不同有关。‘青薯9号’和‘东农303’的干旱下脯氨酸含量增幅大,这2 个品种可能利用渗透调节的机制更多,‘渭薯1号’在干旱下可溶性糖含量增幅大,或许其利用增加可溶性糖含量来应对逆境的机制更发达。因此,在干旱条件下,不同品种可能有不同的主导抗旱机制,可能某些品种主要通过合成大量可溶性糖来减缓光合效率降低的速度,而某些品种主要通过合成大量的干旱诱导蛋白来抵抗干旱带来的伤害,而某些品种各种抗旱机制所发挥的作用差不多,所以对植株进行抗旱评价时如果单采用某一个或者几个具体指标,如单用可溶性糖或可溶性蛋白,或者脯氨酸等指标,并不能全面综合反映出植株的抗旱性。
马铃薯干旱胁迫下生理变化过程复杂,简单的用某项或者几项生理变化值作为抗旱性鉴定指标缺乏准确性。马铃薯对干旱的响应机制,随着胁迫强度和历时的变化而变化,这是一个渐进的系列变化,各种生理变化之间的内在联系缺乏深入研究,如何确定起主导作用的变化过程是研究瓶颈。因此今后抗旱鉴定工作的重点应从分子水平上阐明马铃薯抗旱机制,选用正确的综合性抗旱评价方法,提高马铃薯抗旱性鉴定的科学性和准确性。

