猴T淋巴细胞趋向性病毒l型RPA和荧光RPA检测方法的建立*
熊 炜 林颖峥 魏晓锋 陈鸿军 张 强 王 艳 李 健
(1. 上海出入境检验检疫局,上海 200135)(2. 上海实验动物研究中心,上海 201203)(3.中国农业科学院上海兽医研究所,上海 200241)
猴T淋巴细胞趋向性病毒(Simian T-cell 1ymphotropic virus,STLV)为逆转录病毒,其基因组为单链RNA,它与人T淋巴细胞趋向性病毒(Human T- cell lymphotropic virus,HTLV)同属于灵长类嗜T淋巴细胞病毒,是进出境实验用猴筛查的重要病原之一[1-2]。1982年STLV首次在日本猕猴体内发现,之后在亚洲和非洲超过30种非人灵长类动物中发现了STLV;根据核酸序列和血清学特性,STLV可分为三个亚型,即STLV-1、STLV-2、STLV-3,其中亚洲非人灵长类动物主要感染STLV-1[3-4]。STLV-l主要侵害猴的免疫系统,与恶性淋巴瘤、淋巴组织增生等疾病密切相关;通常猕猴感染STLV-l后,可较长时间不呈现明显临床症状,期间它作为携带者可将病毒传给其它易感猴,对猴的健康造成影响,干扰实验结果[5]。目前报道的STLV-1的检测方法主要有免疫荧光、中和试验、蛋白印迹和ELISA等血清学方法,RT-PCR是STLV-1最常用的核酸检测方法[6-8]。重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA),是一种新型的,可以替代PCR的核酸检测技术,它能够在20 min内进行常温下的单分子核酸检测[9-10]。该技术对硬件设备的要求很低,特别适合野外及检疫现场使用。为了提高口岸对进出境野生及实验用灵长类动物STLV-1感染情况的监测和流行病学调查,本研究建立了RPA和荧光RPA检测STLV-1的方法,并对方法的特异性、敏感性和稳定性进行了验证。
1 材料与方法
1.1 主要试剂
TRIzol购自Invitrogen公司,Taq酶、AMV逆转录酶、RNA酶抑制剂、dNTP、随机引物、DNA Marker(DL2000)购自Takara公司;RPA检测试剂购至英国TwistDx Inc公司。
1.2 病毒样品来源及处理
STLV-1阳性组织和血清样为本室保存。阳性组织样品加等体积生理盐水研磨匀浆,3 000 g离心15 min,收集上清液待检。本研究使用的其他病毒和细菌核酸,如猴D型逆转录病毒(Simian type-D retrovirus,SRV)、猴免疫缺陷病毒(Simian immunodeficiency virus,SIV)、猴B病毒(Simian B virus,BV)、沙门氏菌、志贺氏菌样本,由本室保存。
1.3 RNA抽提及cDNA模板制备
取100 μL待检上清液或血清,加1 mL TRIzol试剂,吹打20次,加入200 μL氯仿,涡旋震荡30 s混匀;12 000 r/min离心15 min;取上层水相,加500 μL异丙醇,颠倒混匀,-20 ℃放置20 min;12 000 r/min离心10 min;弃上清,沉淀用1 mL DEPC水配制的75%乙醇清洗;7 500 r/min离心10 min;弃上清,沉淀室温干燥10 min;加30 μL DEPC水溶解RNA沉淀。取11 μL RNA溶液,加5倍逆转录酶浓缩缓冲液4 μL、dNTP 1 μL、随机引物1 μL、RNA酶抑制剂1 μL、AMV逆转录酶2 μL,置PCR仪上42 ℃反应60 min,即得cDNA模板。
1.4 RT-PCR检测
引物针对STLV-1的gag蛋白基因(gag polyprotein)设计,扩增基因片段大小为348 bp,其上游引物为:5‘ GCT CAT CAC TGG CTT AAC TTC CTC C 3’,下游引物为:5‘ ATG TGG ATG CAT GAC TGG AAG GAC 3’。在PCR薄壁管中,加cDNA模板2 μL、10倍Taq酶浓缩缓冲液2.5 μL、dNTP 0.5 μL、上下游引物各0.25 μL、Taq酶0.25 μL,加水补足总体积至25 μL。将PCR管置PCR仪上,按如下程序扩增:首先94 ℃ 3 min;然后94 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,35个循环;最后72 ℃ 3 min。PCR产物经琼脂糖凝胶电泳后,用凝胶成像系统拍摄。
1.5 RPA引物和探针
使用Vector NTI Suite软件分析不同国家和地区分离的STLV-1的gag蛋白(gag polyprotein)基因的保守序列,用Primer Express软件设计RPA引物和探针。RPA正向引物(RPA-STLV1F)序列为5‘ ACA CCG GCT TGG ATC TGT CCC ATT AAC TAC TC 3’, 反向引物(RPA-STLV1R)序列为5‘ CCA TGT GGA TGC ATG ACT GGA AGG ACT TGA GG 3’。 荧光RPA检测的上游引物(RPAY-STLV1F)序列为:5‘ TGC CAA AGA CCT CCA AGA CCT CCT ACA GTA CC 3’,下游引物(RPAY-STLV1R)序列为:5‘ GAC CGG CTA AGG GGT TAT AAC CTG TAA TAC CTC 3’, RPA探针(RPAY-STLV1P)序列为:5’ CTC CCT CCA TCA CCA GCA GCT AGA TAG CCT TA(FAM-dt)(THF)(BHQ1-dt)AGA GGC CGA A-C3 3’。引物和探针由上海辉睿生物科技有限公司合成。
1.6 RPA检测
采用GENIE Ⅱ恒温扩增PCR仪。反应体系为:25 μL 2倍反应缓冲液、8.2 μL dNTP、5 μL 10倍基酶混合物、上下游引物(RPA-STLV1F、RPA-STLV1R)各2.4 μL;混匀后,再加入2.5 μL 20倍核心反应液、1 μL 50倍RT反应液;混匀后,最后加入2.5μL 280 mmol/L醋酸镁、1 μL待检核酸溶液。反应条件为:39 ℃孵育20 min。反应结束后,凝胶电泳分析扩增产物,结果判定。
1.7 荧光RPA检测
采用GENIE Ⅱ恒温扩增PCR仪。反应体系为:25 μL 2倍反应缓冲液、7.2 μL dNTP、5 μL 10倍探针酶混合物、上下游引物(RPA-STLV1F、RPA-STLV1R)各2.1 μL、10 μmol/L荧光探针0.6 μL;混匀后,再加入2.5 μL 20倍核心反应液、1 μL 50倍RT反应液、1 μL 50倍Exo反应液;混匀后,最后加入2.5 μL 280 mmol/L醋酸镁、1 μL待检核酸溶液。反应条件为:39 ℃孵育25 min。反应结束后,查看荧光扩增曲线进行结果判定。
2 结果
2.1 RPA和荧光RPA检测STLV-1的特异性试验
分析STLV-1 gag蛋白基因序列,设计引物及探针,分别建立STLV-1的 RPA和荧光RPA方法,并分别使用猴的其它病毒(如SIV、BV、SRV)作为对照,同时与PCR方法进行对比,确认所建立方法的特异性。结果显示,经RPA、PCR检测,仅有STLV-1阳性样品出现特异性扩增,其它对照病毒样品均呈阴性(图1、图2);经荧光RPA检测,STLV-1阳性样品在反应15~20 min后荧光信号出现显著增强,而对照病毒样品检测到荧光信号(图3)。
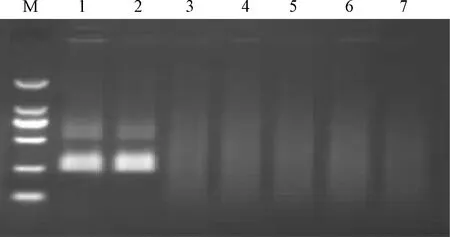
图1 RPA检测STLV-1的特异性注:M:DNA Marker DL2000;1:STLV-1阳性样品1;2:STLV-1阳性样品2;3:SRV;4:SIV;5:沙门氏菌; 6:志贺氏菌;7:空白对照Fig.1 Specificity test of STLV-1 by RPANote:M:DNA Marker DL2000;1:STLV-1 positive sample 1;2:STLV-1 positive sample 2;3:SRV; 4:SIV;5:Salmonella;6:Shigella;7:Blank control

图2 RT-PCR检测STLV-1的特异性注:M:DNA Marker DL2000;1:STLV-1阳性样品1;2:STLV-1阳性样品2;3:SRV;4:SIV;5:沙门氏菌; 6:志贺氏菌;7:空白对照Fig.2 Specificity test of STLV-1 by RT-PCRNote:M:DNA Marker DL2000;1:STLV-1 positive sample 1;2:STLV-1 positive sample 2;3:SRV; 4:SIV; 5:Salmonella;6:Shigella;7:Blank control

图3 荧光RPA检测STLV-1的特异性注:M:DNA Marker DL2000;1:STLV-1阳性样品1;2:STLV-1阳性样品2;3:SRV;4:SIV;5:沙门氏菌;6:志贺氏菌;7:空白对照Fig.3 Specificity test of STLV-1 by fluorescent RPANote:M:DNA Marker DL2000;1:STLV-1 positive sample 1;2:STLV-1 positive sample 2;3:SRV;4:SIV;5:Salmonella;6:Shigella;7:Blank control
2.2 RPA和荧光RPA检测STLV-1的敏感性试验
为测试所建立的RPA和荧光RPA方法的敏感性,将STLV-1阳性样品cDNA进行定量并梯度稀释,制备浓度分别为10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL的模板,再分别用建立的两种方法和RT-PCR方法进行检测。结果证实,RPA和荧光RPA方法的检测下限与RT-PCR相同,均为1 pg/μL ~100 fg/μL(图4~图6)。
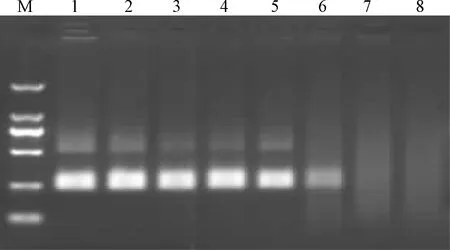
图4 RPA检测STLV-1的敏感性试验注:M:DNA Marker DL2000;1~8:STLV-1 cDNA模板量分别为10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL和1 fg/μLFig.4 Sensitivity test of STLV-1 by RPANote:M:DNA Marker DL2000;1~8:The amount of STLV-1 cDNA was 10 ng/μL, 1 ng/μL, 100 pg/μL, 10 pg/μL, 1 pg/μL, 100 fg/μL, 10 fg/μL and 1 fg/μL
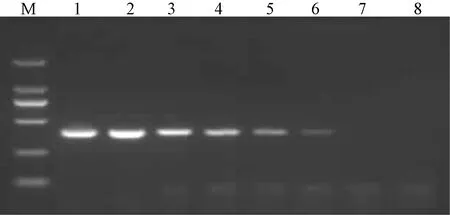
图5 RT-PCR检测STLV-1的敏感性试验注:M:DNA Marker DL2000;1~8:STLV-1 cDNA模板量分别为10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL和1 fg/μLFig.5 Sensitivity test of STLV-1 by RT-PCRNote:M:DNA Marker DL2000;1~8:The amount of STLV-1 cDNA was10 ng/μL, 1 ng/μL, 100 pg/μL, 10 pg/μL, 1 pg/μL, 100 fg/μL, 10 fg/μL and 1 fg/μL
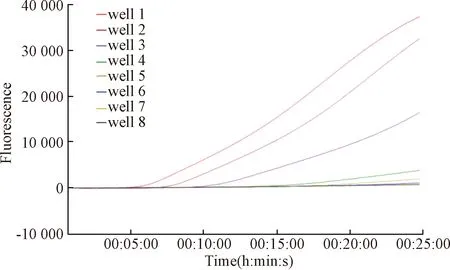
图6 荧光RPA检测STLV-1的敏感性试验注:扩增曲线从左至右分别为10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL的STLV-1 cDNA模板Fig.6 Sensitivity test of STLV-1 by fluorescent RPANote:The amplification curve from left to right is the amount of STLV-1 cDNA from 10 ng/μL, 1 ng/μL, 100 pg/μL, 10 pg/μL, 1 pg/μL, 100 fg/μL, 10 fg/μL to 1fg/μL
2.3 RPA和荧光RPA检测STVL-1的可靠性试验
为进一步验证建立核酸检测方法的的可靠性,对将本室保存的经RT-PCR确认的7份STLV-1阳性核酸样本及23份STLV-1阴性猴血清分别用RPA和荧光RPA 进行检测,每份样同一方法重复3次。结果显示,7份阳性核酸样本经上述三种方法检测均得到了阳性结果,而阴性样本均未出现特异性扩增,与实际样本的符合率为100%(图7、图8)。

图7 RPA检测7份不同时期分离的STLV-1阳性样品注:M:DNA Marker DL2000;1~7:7份STLV-1阳性样品;8:空白对照Fig.7 RPA Detection of seven positive samplesof STLV-1 seperated at different timeNote:M:DNA Marker DL2000;1~7:7 positive samples of STLV-1;8:Blank control
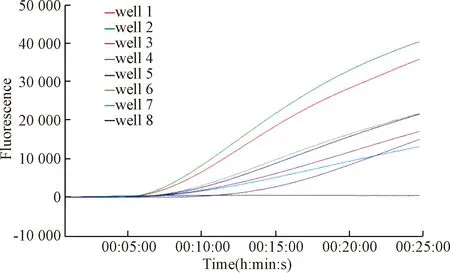
图8 荧光RPA检测7份不同时期分离的STLV-1阳性样品注:扩增曲线为7份不同时期分离的STLV-1阳性样品Fig.8 Fluorescent RPA Detection of seven positive samplesof STLV-1 seperated at different timeNote:The amplification curve shows seven positive samples of STLV-1 seperated at different time.
3 讨论
由于猴在形态、生理、生化、代谢等诸多方面与人类非常相似,因而作为理想的实验动物模型被应用于生物医药研究领域。国际上对无特定病原体(SPF)猴的定义主要指体内不含STLV、SIV、SRV、猴B病毒(BV)、沙门氏菌、志贺氏菌等特定病原微生物。由于实验用猴进出口贸易的不断扩大,缩短检疫周期,研发简便、快速、特异、敏感的新型检测方法,对提高猴特定病原体筛查的效率,保证进出境实验用猴的健康和质量具有重要意义。
本研究建立了RPA和荧光RPA快速检测STLV-1的方法,通过将猴其它特定病原体与STLV-1对比检测,证实建立的检测方法具有良好的特异性。经灵敏度试验证实,本研究建立的两种STLV-1核酸检测方法,与传统PCR检测方法一样,均具有很高的敏感性。通过对30份STLV-1阳性核酸样本及阴性猴血清样本的重复检测,证实建立的RPA和荧光RPA,具有PCR方法一样的稳定性和可靠性。但是与PCR方法相比,RPA检测方法的优势在于检测周期极短(仅需20 min)、操作简单(只需将核酸与检测体系混合放于恒温设备中即可,RNA检测不需逆转录过程)、检测设备便携(笔记本大小,一次充电可运行12 h)、结果判定简便直观,适合于现场及野外操作。

