预水解发酵碳源对铜绿假单胞菌NY3产 鼠李糖脂特性及应用效能的影响研究
秦兵维, 聂麦茜,2*, 郭永华, 朱洪胜, 聂红云, 刘 畅, 严 寒
(1.西安建筑科技大学 环境与市政工程学院,陕西 西安 710055;2.陕西省膜分离技术研究院,陕西 西安 710055)
鼠李糖脂是一种由微生物发酵产生的两亲性的表面活性物质[1],具有活性高、生物相容性好、易被生物降解等特点,加之在强碱、高温、高pH等极端条件下有良好的应用效果,因而备受关注[2-3]。目前国内外研究大多集中于以各种植物油为发酵碳源,通过诱变菌株、优化发酵温度、pH、氮源等条件来提高鼠李糖脂的产量[4-5]。根据Burger等[6]的报道,在鼠李糖脂的合成途径中,需要大量的脂肪酸作为前体物质。而发酵碳源-油脂是由C16-C18各种脂肪酸和甘油组成,水解油脂可产生所需脂肪酸。然而,现有的关于油脂水解条件及其水解程度对鼠李糖脂的产量及其结构的影响研究报道[7-9]较少。为降低发酵成本,本研究以铜绿假单胞菌NY3为供试菌株,选择废弃的动物油为发酵碳源,研究油脂水解方法、水解程度等对鼠李糖脂的产量、结构的影响,同时将不同预水解条件下发酵所产鼠李糖脂应用于石化企业所产生的固体油污泥的处理中,探究鼠李糖脂对NY3菌去除石化企业油污中石油烃效能的影响,为扩大鼠李糖脂的生产和实际应用规模提供参考。
1 材料与方法
1.1 材料
1.1.1 供试材料 菌种:铜绿假单胞菌NY3(PseudomonasaeruginosaNY3),本实验室分离并鉴定[10]。动物油:西安市区收集废弃动物油,常温下为半固态。
1.1.2 培养基 无机盐(发酵)培养基:NH4NO31.0 g,微量元素 1 mL[11],1 moL/L MgSO4·7H2O溶液 0.5 mL,1 mol/L CaCl2·2H2O溶液 0.1 mL,磷酸盐缓冲液(K2HPO442 g, NaH2PO428 g) 25 mL,pH 7.8,蒸馏水定容至1 000 mL。121 ℃高压蒸汽灭菌30 min,备用。无机盐/淀粉(降解)培养基:NH4NO3100 g,NaH2PO456 g,K2HPO484 g,微量元素26 mL,MgSO4·7H2O溶液15 mL(246.4 g/L),CaCl2·2H2O溶液2.6 mL(147.2 g/L),沸水完全溶解的淀粉溶液 100 mL,定容至1 000 mL。LB培养基[12]、LB固体培养基[12]。
1.1.3 主要仪器和试剂 液相色谱-离子阱-飞行时间质谱联用仪(LCMS-IT-TOF),日本SHIMADZU公司,色谱柱为VP-ODS柱(C8, 250 mm×2.0 mm, 4.6 μm);7000B三重四级杆气相色谱-质谱联用仪(GC-MS),美国Agilent公司,色谱柱为HP-5(30 m×0.25 mm×0.25 μm);6890N气相色谱仪,美国安捷伦公司;脂肪酶,美国Sigma L3126 Type II型;实验试剂除正己烷、乙腈、甲酸、乙酸乙酯为色谱纯外,其余均为分析纯。
1.2 方法
1.2.1 动物油的预水解 动物油碱水解(方法参考文献[13]并改进):50 mL锥形瓶中加入8.0 g动物油,加入20 mL蒸馏水,40 ℃(动物油的熔点为40 ℃)恒温水浴1.5 h,将溶液转移至离心管,8 000 r/min 离心8 min,取上层。按上述方法将上层用蒸馏水再洗涤一次,取上层。将上层溶液转移至另一50 mL锥形瓶中,加入20 mL 0.1 mol/L NaOH溶液,150 r/min、70 ℃恒温水解12 h,加HCl调pH至3~4释放游离脂肪酸。动物油酶水解(方法参考文献[14]并改进):50 mL锥形瓶中加入8.0 g动物油,加入20 mL蒸馏水,40 ℃水浴恒温1.5 h,将溶液转移至离心管,8 000 r/min 离心8 min,取上层。按上述方法将上层用蒸馏水再洗涤一次,取上层。将上层溶液转移至另一50 mL锥形瓶中,加入20 mL 500 mg/L 脂肪酶/磷缓溶液,150 r/min、50 ℃水解6 h,加HCl调pH至3~4释放游离脂肪酸。
1.2.2 动物油的酸值与脂解率测定 酸值的测定:将释放游离脂肪酸后的水解样品于8 000 r/min离心8 min后取上层,参照GB 5009.229-2016[15]测定其酸值。脂解率的测定:脂解率按公式计算:Y(%)=S/S0×100%,式中:Y:油脂水解率,%;S:酸值实测值,mg/g;S0:酸值理论值,mg/g,酸值理论值以油脂完全水解为油酸C18H34O2计。
1.2.3 动物油预水解后脂肪酸成分与相对含量的气-质联用分析 将水解所得脂肪酸溶于色谱级乙酸乙酯,0.2 mL N,O-双(三甲基硅烷基)乙酰胺60 ℃衍生45 min后过0.22 μm微孔滤膜上样。气相色谱条件根据文献[16]进行改进:HP-5毛细管柱(30 m×0.25 mm×0.25 μm),进样温度300 ℃,检测器温度300 ℃,以氦气为载气,升温程序为100 ℃保持2 min,以5 ℃/min升温至300 ℃,保持5 min,进样量1 μL。质谱条件:70 eV电子能量,灯丝发射电流200 μA,离子源温度230 ℃,接口温度300 ℃。
1.2.4 NY3菌种子液的制备 参考文献[17],将NY3菌接种于LB培养基中,31 ℃、150 r/min好氧培养24 h至OD600达到(1.6±0.05),备用。
1.2.5 鼠李糖脂的发酵与提纯 NY3菌分别以未预水解、碱预水解和酶预水解后动物油为碳源,于31 ℃、150 r/min条件下摇床培养72 h发酵鼠李糖脂[18]。根据文献[19]方法萃取提纯鼠李糖脂。
1.2.6 鼠李糖脂的液相色谱-飞行时间质谱(LCMS-IT-TOF)测定 将鼠李糖脂样品溶于色谱级乙腈,用0.22 μm微孔滤膜过滤后注入样品瓶,待测。测定方法参考文献[18]。
1.2.7 NY3菌中试处理高浓度石化企业油污泥 在容量为40 L的反应器中依次加入含油泥6 kg的经分散预处理后的油泥∶木屑=7∶1[20](质量比)的混合物,10 L NY3菌种子液,1 L无机盐/淀粉(降解)培养基,300 mg/L碱、酶预水解条件下发酵所产鼠李糖脂,并以不加鼠李糖脂的反应体系作为空白对照组,在31.5 ℃、搅拌速度为150 r/min、曝气速率为20 L/min的条件下反应9 d。每24 h取样,样品于8 000 r/min、4 ℃条件下石油醚(沸程60~90 ℃)离心20 min进行3次萃取,合并萃取液,待石油醚挥发干后备用。
1.2.8 气相色谱法测定油污泥中石油烃的去除率 将待测样品溶于色谱级正己烷,用0.22 μm微孔滤膜过滤后注入样品瓶,待测。测定方法参考文献[21]。
2 结果与分析
2.1 预水解对动物油酸值及所得脂肪酸组分的影响
2.1.1 预水解对动物油酸值和脂解率的影响 大量普遍存在的动物油是由甘油三酯组成[22],其水解后可产生大量相应脂肪酸和甘油,使油脂的酸值变大,而这些水解产物恰是NY3菌产鼠李糖脂的前体物质。据文献[23-27]报道,在适当条件下对油脂进行碱性水解或脂肪酶水解,可提升油脂酸值。动物油预水解前和经碱、酶预水解后其酸值与脂解率结果如表1所示。
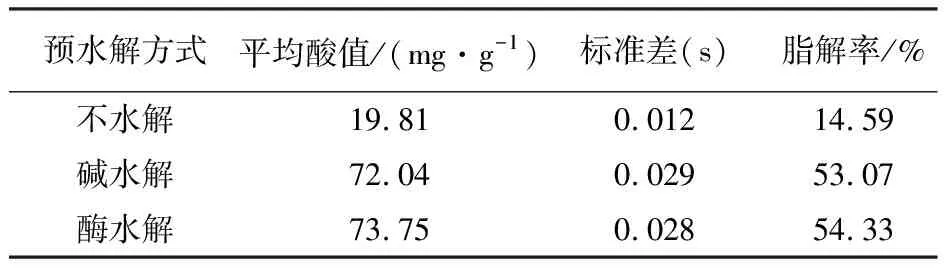
表1 动物油在不同水解条件下的酸值与脂解率
从表1结果看出,动物油未水解,其酸值仅为19.81 mg/g,经碱、酶水解后,酸值分别达到72.04和73.75 mg/g,说明碱、酶预水解均能使动物油释放脂肪酸,提高其酸值。3种预水解方式所得酸值平方差分别为0.012、0.029、0.028,离散程度较低,表明动物油经碱、酶预水解所得酸值较为稳定,相对于不水解,碱、酶水解可将动物油脂解率分别提高38.5%和39.7%。表1为本研究实验条件下的最高水解程度,与文献[13,24-25]报道的水解程度有一定差距,说明该动物油中可能含有大量在此条件下不被水解的杂质。
2.1.2 动物油预水解后脂肪酸成分与相对含量分析 利用GC-MS检测动物油经碱、酶水预解后的水解产物,两种预水解方式下均鉴定出7种脂肪酸,经面积归一法确定它们的含量,结果如表2所示。
由表2可知,动物油作为发酵碳源,经碱、酶预水解后,所得脂肪酸在种类和相对含量上无明显差异,两种预水解条件下均产生7种不同游离脂肪酸,含量高低次序依次为油酸>十六酸>十八酸>亚油酸> 9-十六碳烯酸>十四酸>十七酸,说明预水解方式对动物油水解产物种类并无明显影响。

表2 动物油预水解所产脂肪酸组分的 GC-MS鉴定结果及其相对含量Table 2 The results of GC-MS identification and relative content of fatty acid composition produced from the prehydrolysis of animal oil
2.2 动物油预水解对NY3菌发酵鼠李糖脂产量及结构的影响
2.2.1 动物油预水解对NY3菌发酵鼠李糖脂产量的影响 由表3可知,动物油未预水解,NY3菌发酵鼠李糖脂产量为8.28 g/L,碳源转化率为20.70%;经碱、酶预水解后,鼠李糖脂产量和碳源转化率分别提高至15.35、17.63 g/L和38.38%、44.08%,标准差不超过1.640,产量离散程度较低,在实验方法接受范围内。结果表明,相对于动物油未预水解时所得产量,碱、酶预水解后鼠李糖脂的产量分别提高85.39%和112.92%,说明碱、酶预水解可使碳源释放游离脂肪酸,进而促进NY3菌分泌鼠李糖脂,且相对于碱预水解,酶预水解可使NY3菌高产14.85%的鼠李糖脂,说明酶预水解对碳源的水解程度和鼠李糖脂产量的促进作用更为显著。

表3 动物油预水解对NY3菌发酵 鼠李糖脂产量与碳源转化率的影响Table 3 Effect of prehydrolysis of animal oil on the production of rhamnolipids produced by strainP.aeruginosaNY3 and conversion rate of carbon source
2.2.2 动物油预水解对NY3菌发酵产鼠李糖脂结构特征的影响 利用液相色谱-离子阱-飞行时间质谱检测不同预水解方式下发酵所产鼠李糖脂并分析,结果分别见表4、5、6。
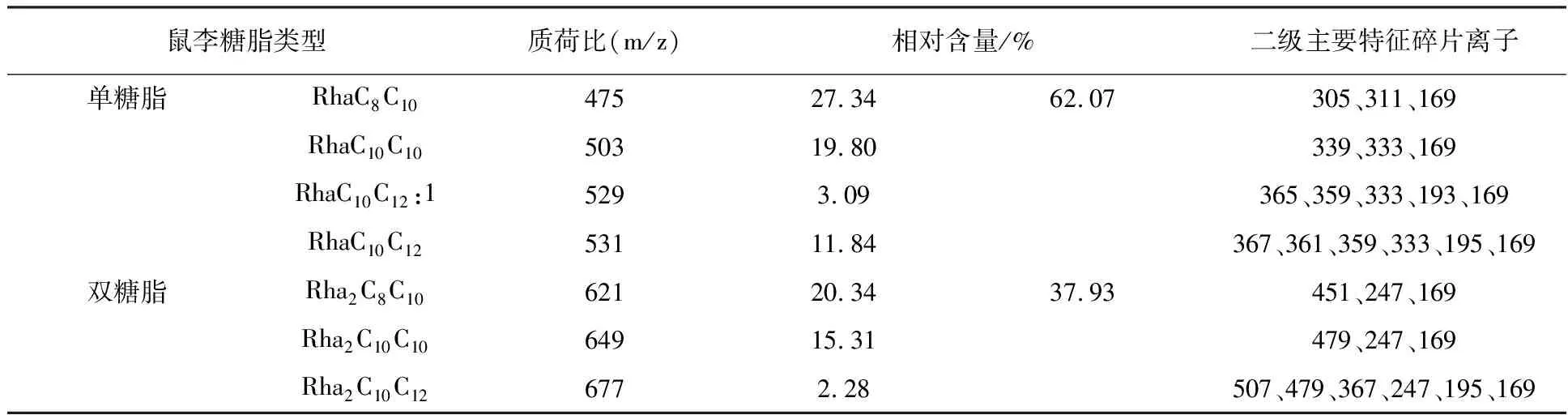
表4 动物油未预水解NY3菌发酵所产鼠李糖脂的组成及相对含量
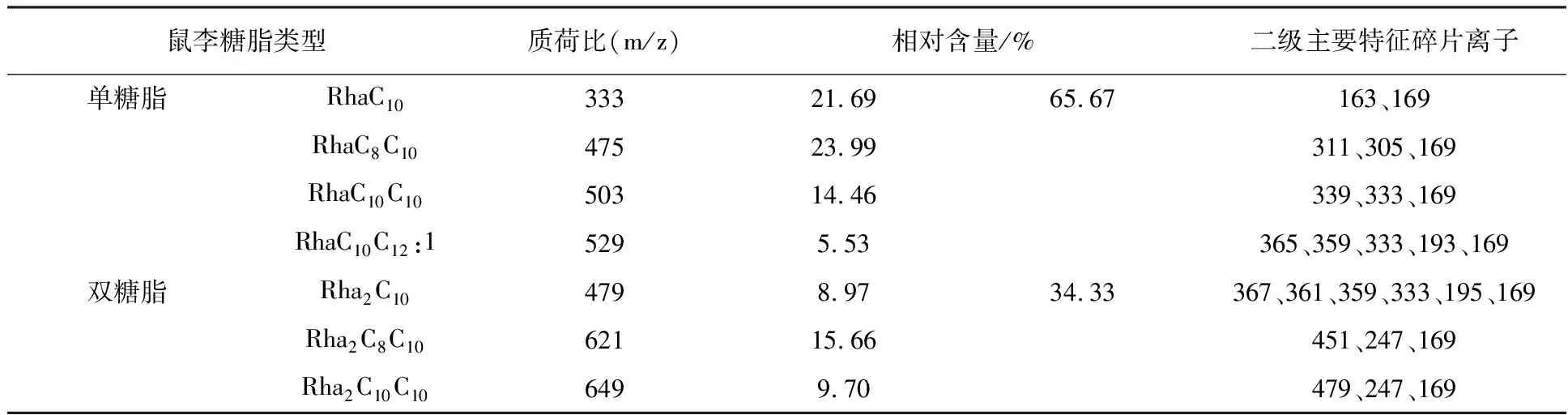
表5 动物油经碱预水解NY3菌发酵所产鼠李糖脂的组成及相对含量
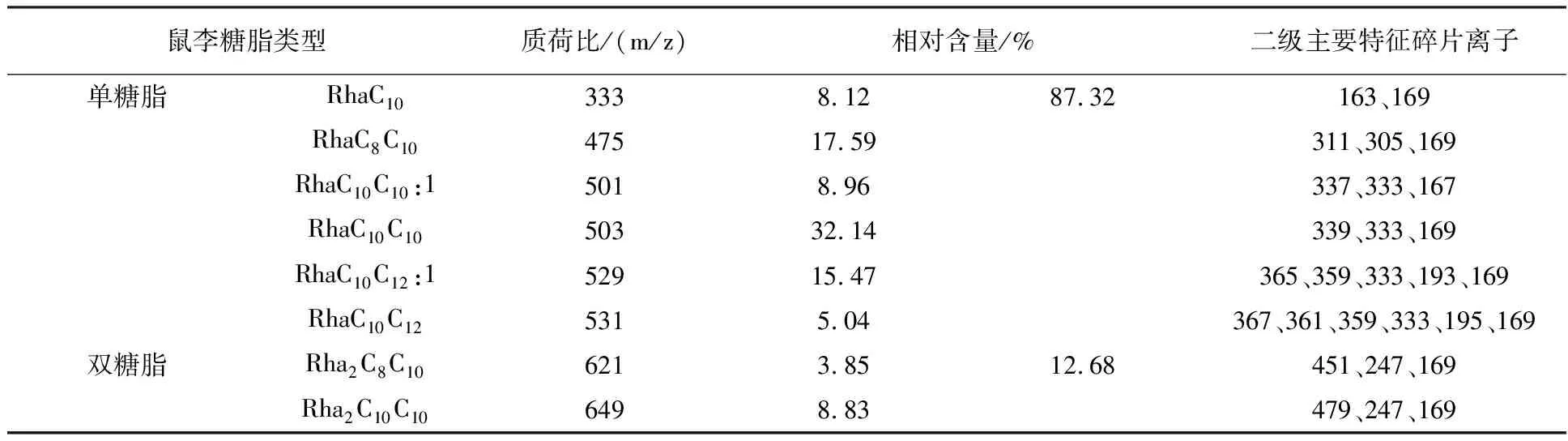
表6 动物油经酶预水解NY3菌发酵所产鼠李糖脂的组成及相对含量
由表4、5、6可知,3种预水解条件下发酵所得鼠李糖脂中,均存在质荷比为475、503、529、621、649的鼠李糖脂组分,5种组分在各鼠李糖脂中相对含量之和分别为85.88%、69.34%、77.88%,说明预水解方式对NY3菌发酵所产鼠李糖脂主要组分种类并无明显影响。从鼠李糖脂的单、双糖脂含量来看,3种预水解条件下发酵所得鼠李糖脂单糖脂含量均高于双糖脂含量,但相对于碳源未预水解发酵所得鼠李糖脂,碳源预碱水解、预酶水解后发酵所得鼠李糖脂中单糖脂含量显然更高,其中碳源预酶水解发酵所得鼠李糖脂单糖脂含量高达87.32%。说明碱、酶预水解发酵碳源均能提高NY3菌发酵所产鼠李糖脂中单糖脂的含量,且相对于碱预水解,酶预水解发酵碳源对所产鼠李糖脂中单糖脂含量的提高作用更明显,最高可将鼠李糖脂单糖脂含量提高25.25%。
2.3 鼠李糖脂促进NY3菌去除石化企业油污泥中石油烃的效能分析
按照1.2.7中的方法进行NY3菌中试处理石化企业油污泥的实验,根据1.2.8对所得样品进行气相色谱测定,反应1~9 d石油烃去除率如图1所示。由图1可知,反应24 h,4种体系油污泥中石油烃的去除率分别为15.62%、42.10%、39.32%、36.33%,投加了鼠李糖脂的反应体系石油烃去除率均超过30%,说明反应24 h内鼠李糖脂能够促进菌株的生长,缩短NY3菌接入到反应器后的适应期。反应9 d,4种反应体系的石油烃去除率分别为55.16%、85.99%、85.70%、76.94%,在整个反应周期内,不投加鼠李糖脂的反应体系石油烃去除率始终低于其余体系,说明当鼠李糖脂存在于反应体系中时,NY3菌对石油烃具有更强的去除能力,表明鼠李糖脂能够促进NY3菌去除油污泥中的石油烃。从投加了鼠李糖脂的3种反应体系石油烃的去除率来看,反应1~9 d,3种体系中石油烃的去除率高低次序始终为投加未预水解产Rha的体系>投加碱预水解产Rha的体系>投加酶预水解产Rha的体系,说明3种鼠李糖脂对NY3菌去除油污泥中石油烃的促进作用强弱顺序为未预水解产Rha>碱预水解产Rha>酶预水解产Rha,这一顺序与此3种鼠李糖脂中双糖脂的含量高低次序恰好一致,由于3种鼠李糖脂在主要组分上无明显差异,可知双糖脂含量高的鼠李糖脂对NY3菌去除油污泥中石油烃的促进作用更为显著。

图1 中试条件下鼠李糖脂对NY3菌去除 石化企业油污泥中石油烃的影响Fig.1 Effect of rhamnolipids on promotingP.aeruginosaNY3 to remove petroleum hydrocarbon from petrochemical industry oily sludge under pilot test
3 讨 论
在NY3菌发酵产鼠李糖脂前,对发酵碳源动物油分别进行了碱、酶预水解,为判断碳源的水解程度并确定其水解产物,对预水解前后的碳源进行了酸值测定,并对水解所得有机酸进行了GC-MS检测,发现碱、酶预水解均能释放动物油中的脂肪酸而使其酸值增大,两种预水解方式所得水解产物中均含油酸、十六酸、十八酸、亚油酸、 9-十六碳烯酸、十四酸、十七酸等脂肪酸,且含量依次降低。
碳源经碱、酶预水解后,NY3菌发酵鼠李糖脂的产量和碳源转化率均明显提高,结果表明,脂肪酸能作为NY3菌发酵产鼠李糖脂的前体物质,从油脂中提前释放它们,有利于提高鼠李糖脂产量。LCMS-IT-TOF检测结果表明,3种预水解方式下发酵所产鼠李糖脂的主要组分无明显差异,且单糖脂含量均高于双糖脂含量,相对于未预水解碳源,发酵碱、酶预水解碳源所产鼠李糖脂中单糖脂含量更高。
高浓度石化企业油污泥的中试处理实验结果表明,整个处理周期内,鼠李糖脂对油污泥处理效率有明显促进作用,尽管碱、酶预水解碳源可提高鼠李糖脂的产量,但却使鼠李糖脂中双糖脂含量较低,导致其对NY3菌去除油污泥中石油烃的促进效率低于未预水解碳源所产鼠李糖脂。后期可在预水解碳源提高鼠李糖脂产量的基础上,对NY3菌定向发酵以特定产鼠李单糖脂或鼠李双糖脂展开进一步研究。

