大鼠单核细胞趋化蛋白-1基因的生物信息学分析
吴桂梅 赵小峰 汪瑶 金磊 贺玲
摘要[目的]对大鼠单核细胞趋化蛋白-1(MCP-1)基因编码的蛋白质进行结构和性质分析。[方法]利用生物信息学方法对大鼠MCP-1基因编码的蛋白质的理化性质和结构进行分析,并分析该基因与其他物种的生物进化关系。[结果]大鼠MCP-1基因与小鼠的亲缘关系最近;大鼠MCP-1蛋白是一个稳定的亲水性碱性蛋白,分子式为C721H1175N197O223S9,理论等电点为9.20,由8.78%的α-螺旋、35.81%的折叠延伸链、55.41%的无规则卷曲组成,有1个SCY结构域;该蛋白可能的信号肽剪切位点在第17位点处。[结论]MCP-1蛋白是一个稳定的亲水性分泌蛋白。该研究结果可为MCP-1的进一步研究提供理论依据。
关键词单核细胞趋化蛋白-1;生物信息学分析;大鼠;基因
中图分类号Q343.1文献标识码A
文章编号0517-6611(2019)01-0093-03
doi:10.3969/j.issn.0517-6611.2019.01.029
开放科学(资源服务)标识码(OSID):
单核细胞趋化蛋白-1(monocytechemotacticprotein-1,MCP-1/CCL2)是趋化细胞因子CC亚家族中的一员[1]。MCP-1由多种类型细胞生成,包括上皮、内皮、平滑肌、成纤维细胞、星形胶质细胞、单核细胞和小胶质细胞,并且它能募集单核细胞、记忆T细胞、树突状细胞至损伤和感染的组织,这些细胞对末梢循环和组织中的抗病毒免疫应答起着非常重要的作用。由此可见,MCP-1的分布比较广泛,在不同的组织中都发挥着重要作用。研究显示MCP-1在类风湿性关节炎、肾病综合征、急性冠状动脉综合征、肿瘤等疾病的发生和发展过程中发挥重要作用[2-5]。此外,在癫痫、脑缺血、阿尔茨海默病、自身免疫性脑脊髓炎-1和创伤性脑损伤中,MCP-1在神经胶质细胞中的表达增加,但其具体病理生理机制尚不完全清楚[6-9]。
大鼠基因组与人类基因组相似度较高,且大鼠方便取材,被广泛应用于各种医学实验研究。研究大鼠MCP-1的各种性质对研究MCP-1的功能具有重要的意义,目前尚无关于大鼠MCP-1蛋白结构的相关报道,对大鼠MCP-1进行生物信息学分析,以期为研究该基因的调控机制奠定基础。
1材料与方法
1.1材料
登录美国国家生物技术信息中心(NationalCenterforBioteehnologyInformation,NCBI)的GenBank(http:∥www.ncbi.him.nih.gov/Genbank/),检索人Homosapiens(NP_002973.1)、猫Feliscatus(XP_003996605.1)、牛Bostaurus(NP_776431.1)、狼Canislupusfamiliaris(NP_001003297.1)、马Equuscaballus(NP_00107500.1)、猕猴Macacamulatta(NP_001027993.1)、小鼠Musmusculus(NP_035463.1)、猪Susscrofa(NP_999379.1)、兔Oryctolaguscuniculus(NP_001075763.1)、大鼠Rattusnorvegicus(NP_113718.1)、豚尾猴Macacanemestrina(NP_001292836.1)的MCP-1基因的cDNA序列和蛋白序列。
1.2方法
利用Mega软件程序对大鼠及其他物种的MCP-1基因的cDNA序列和蛋白序列进行同源比对;通过http:∥www.expasy.eh/tools/prot-param.html网站對大鼠MCP-1蛋白的理化性质进行分析;利用http:∥npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html网站分析大鼠MCP-1蛋白的二级结构;利用http:∥www.ebs.dtu.dk/servies/SignalP网站预测MCP-1蛋白的信号肽;利用http:∥smart.embl-heidelberg.de/网站预测蛋白质的结构域;利用http:∥swissmodel.expasy.Ors/网站预测MCP-1蛋白的高级结构;利用Strings数据库做蛋白质相互作用分析。
2结果与分析
2.1MCP-1蛋白分子进化分析
将不同来源的基因编码蛋白序列调入Mega软件程序进行系统进化分析,其结果见图1,进化树总体分为两支,大鼠和小鼠成为一支,亲缘关系最为密切,人类与其他8个物种成为独立的大分支。
2.2MCP-1理化性质分析
蛋白质的某些理化性质是蛋白质鉴定、提取、纯化的基本依据。对大鼠MCP-1的理化性质预测,结果显示,MCP-1分子式为C721H1175N197O223S9,由148个氨基酸组成,相对分子质量为16459.9,理论等电点为9.20,该蛋白由20种氨基酸组成,其中Thr、Ser、Val含量较高,分别占12.2%、11.5%、9.5%。带负电荷的氨基酸残基数(天冬氨酸、谷氨酸)为11个,带正电荷的氨基酸残基数(精氨酸、赖氨酸)为17个。不稳定指数为39.13,推定该蛋白为稳定蛋白。总平均亲水性为-0.110,预测该蛋白是亲水蛋白。
2.3MCP-1二级结构分析
利用在线蛋白质分析系统得到大鼠MCP-1的二级结构预测结果。由图2可知,大鼠MCP-1由8.78%的α-螺旋、35.81%的折叠延伸链、55.41%的无规则卷曲组成。这为预测其三级结构及蛋白质的功能提供了一定的参考依据。
2.4MCP-1结构域分析
通过结构域预测可知大鼠MCP-1含有1个SCY结构域。由图3结构域预测结果可知,大鼠MCP-1在31~90位置处有1个SCY结构域。
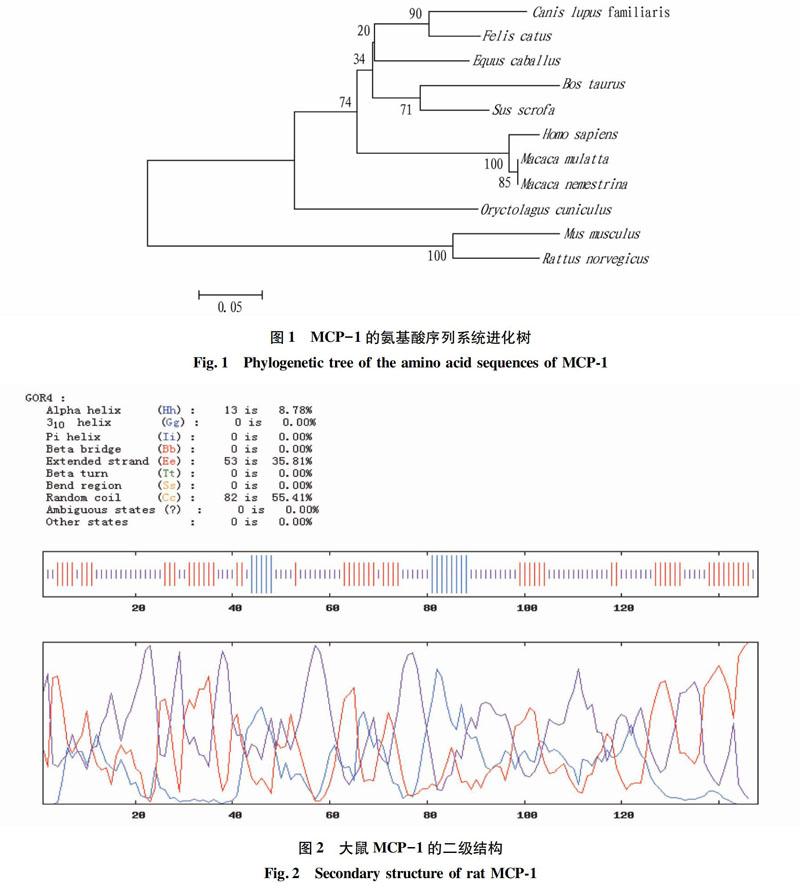
2.5MCP-1信号肽分析
对大鼠MCP-1的信号肽预测结果见图4。由图4的预测结果可以看出第17~18位点处S值陡峭,Y值最高并且具有高C值,是最可能的剪切位点。
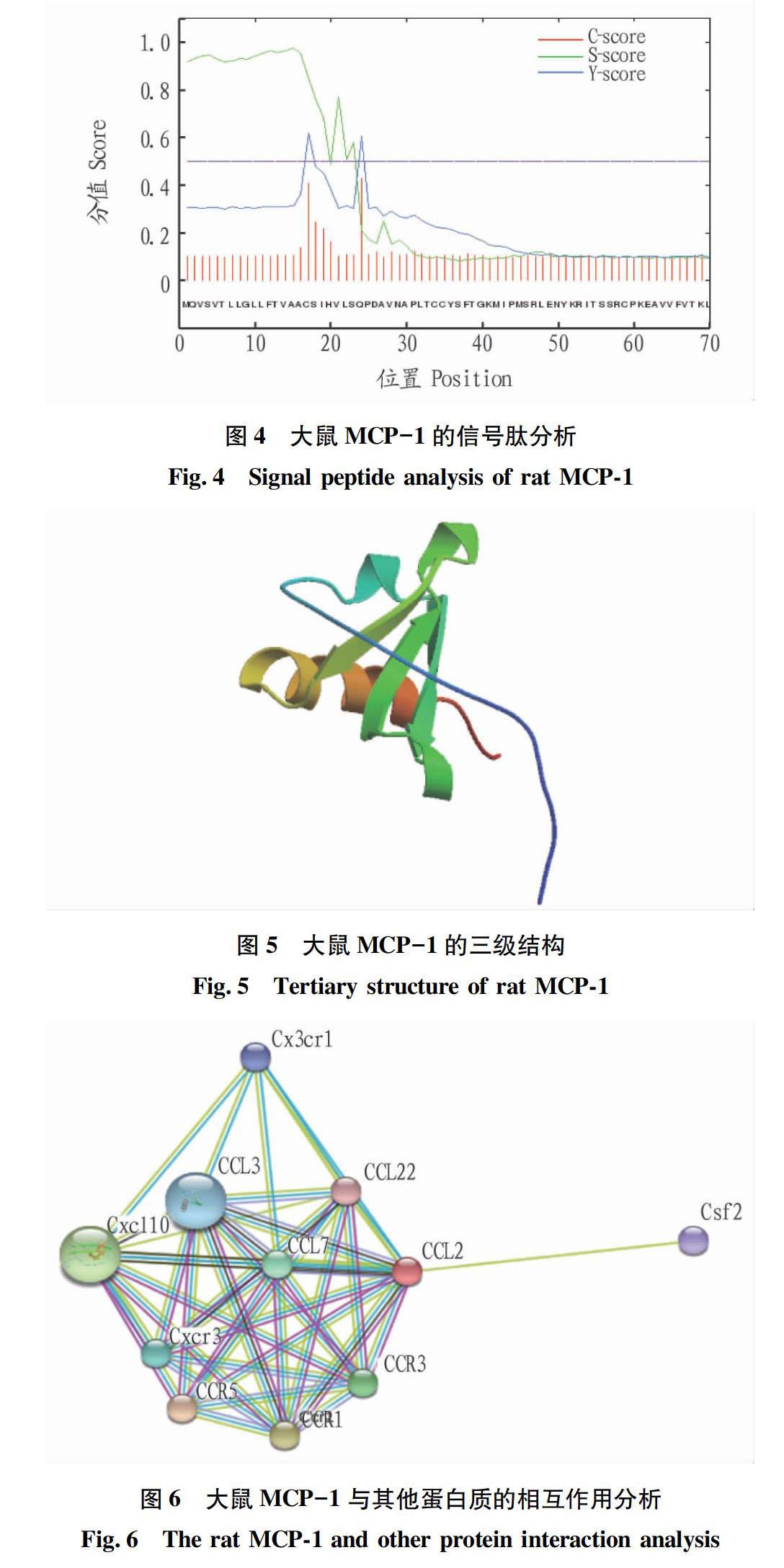
2.6MCP-1三级结构预测
对大鼠MCP-1的三级结构进行预测,结果见图5。
2.7MCP-1蛋白相互作用分析
对大鼠MCP-1与其他蛋白质的相互作用进行分析,结果见图6。
3讨论
MCP-1促进单核细胞的趋化,以及其他一些和趋化相关的细胞事件,包括Ca2+流出和整合素表达。MCP-1还是单核细胞细胞因子表达的弱诱导物,在高浓度时,能引发呼吸道破裂,导致活性氧的生成[10-12]。此外,MCP-1还是一个连接外围炎症与神经兴奋过度的关键分子。MCP-1通过与其受体CCR2结合参与炎症反应、血管生成和损伤修复等过程[12]。不过MCP-1在各种疾病中的信号转导机制还需要更深入的研究。该研究通过蛋白质相互作用分析发现MCP-1与CCL3、CCL7、CCL22、CCR5等分子存在相互作用,这为进一步研究MCP-1在不同疾病中的信号转导机制提供了一定的基础。
蛋白质的某些理化性质是蛋白质鉴定、提取、纯化的基
本依据。通过蛋白质理化性质预测结果推测,大鼠MCP-1
是一个稳定的亲水性碱性蛋白。蛋白质二级结构是空间结
构及蛋白功能的基础,通过二级结构的预测能为三级结构的预测提供指导。此外,使用预测的二级结构信息进行二硫键预测能够提高二硫键结构的准确率[13],这将有利于今后蛋白质三维结构的预测。从对信号肽分析结果中可知,大鼠MCP-1有信号肽并且预测出信号肽的剪切位点在第17位点处。信号肽是蛋白质的一部分,位于分泌蛋白N端。对信号肽进行改造能够提高外源蛋白表达量[14],该分析为大鼠MCP-1蛋白表达量提高的设计提供了参考依据。
MCP-1是炎症反应的一个关键因子,通过生物信息学方法对其进行研究,可为研究MCP-1在不同条件下的功能及其在信号转导调节中的作用提供必要的信息,也可为MCP-1相关的疾病研究和疾病治疗奠定一定的基础。
参考文献
[1]GUL,TSENGSC,ROLLINSBJ.Monocytechemoattractantprotein1[J].ChemImmunol,1999,72:7-29.
[2]林涛,吕昊哲,马玉霞,等.类风湿关节炎患者血清单核细胞趋化蛋白-l水平及与间质性肺疾病的关系[J].细胞与分子免疫学杂志,2010,26(1):59-63.
[3]张舒媚,包金兰,孙润陆,等.早发冠心病患者血清MCP-1与HDL2、HDL3水平及其相关性分析[J].中山大学学报(医学科学版),2015,36(3):403-407.
[4]KHOMC,PARKJH,HANBH,etal.PlantagoasiaticaL.amelioratespuromycinaminonucleosideinducednephroticsyndromebysuppressinginflammationandapoptosis[J].Nutrients,2017,9(4):386.
[5]HANR,GUSZ,ZHANGYJ,etalEstrogenpromotesprogressionofhormonedependentbreastcancerthroughCCL2CCR2axisbyupregulationofTwistviaPI3K/AKT/NFκBsignaling[J].Scientificreports,2018,8(1):9575.
[6]FABENEPF,BRAMANTIP,CONSTANTING.Theemergingroleforchemokinesinepilepsy[J].JNeuroimmunol,2010,24(1/2):22-27.
[7]HICKMANSE,ELKHOURYJ.MeehanismsofmononuclearphagocyterecruitmentinAlzheimersdisease[J].CNSNeurolDisordDrugTargets,2010,9(2):168-173.
[8]RANSOHOFFRM,HAMILTONTA,TANIM,etal.AstrocyteexpressionofmRNAencodingcytokinesIP10andJE/MCPinexperimentalautoimmuneencephalomyelitis[J].FASEBJ,1993,7(6):592-600.
[9]SEMPLEBD,BYEN,RANCANM,etal.RoleofCCL2(MCP1)intraumaticbraininjury(TBI):EvidencefromsevereTBIpatientsandCCL2/mice[J].JCerebBloodFlowMetal,2009,30(4):769-782.
[10]PRENTICEH,MODIJP,WUJY.Mechanismsofneuronalprotectionagainstexcitotoxicity,endoplasmicreticulumstress,andmitochondrialdysfunctioninstrokeandneurodegenerativediseases[J].Oxidativemedicineandcellularlongevity,2015,2015:964518.
[11]OERTELW,SCHULZJB.CurrentandexperimentaltreatmentsofParkinsondisease:Aguideforneuroscientists[J].Journalofneurochemistry,2016,139:325-337.
[12]OCONNORT,BORSIGL,HEIKENWALDERM.CCL2CCR2signalingindiseasepathogenesis[J].Endocrine,metabolic&immunedisordersdrugtargets,2015,15(2):105-118.
[13]石鷗燕,蔡春泉,孙伟,等.结合蛋白质二级结构信息预测蛋白质空间结构中的二硫键[J].计算机应用研究,2011,28(6):2049-2051.
[14]MARTNEZRUIZA,DELPOZOAM,LACADENAJ,etal.SecretionofrecombinantproandmaturefungalαsarcinribotoxinbythemethylotrophicyeastPichiapastoris:TheLysargmotifisrequiredformaturation[J].ProteinExprPurif,1998,12(6):315-322.

