黄连素对高糖培养下大鼠视网膜Müller细胞增殖的影响
金轶平,朱皓皓
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者最常见的并发症,是成年人失明的首要原因[1]。目前,治疗DR的方法主要有激光光凝、玻璃体切割手术以及抗血管内皮生长因子(VEGF)药物或糖皮质激素等药物的运用,但这些方法并不能完全阻止DR的发展,因此更多有效的治疗方法有待发现和研究[2]。Müller神经胶质细胞是视网膜中数量最多的细胞,位于视网膜神经和血管之间,为视网膜提供结构和神经营养支持,具有调节突触发育、神经血管耦合、电解质平衡和细胞代谢等多种生理功能,在维持视网膜组织的健康和结构完整性方面具有至关重要的作用[3-4]。谷氨酰胺合成酶(glutamine synthetase,GS)在视网膜中只存在于Müller细胞中,为Müller细胞特异性标记。黄连素作为我国应用已久的传统中药,可从黄连等多种植物中提取,亦可人工合成,对于糖尿病肾病、糖尿病性神经病、心脑血管疾病等多种糖尿病并发症均有明确的抑制和改善作用[5-8]。本研究以25mmol/L葡萄糖培养基模拟高糖状态,用不同浓度黄连素作用于大鼠视网膜Müller细胞,研究黄连素对高糖培养下Müller细胞增殖的影响,探讨黄连素在DR治疗中的可能作用。
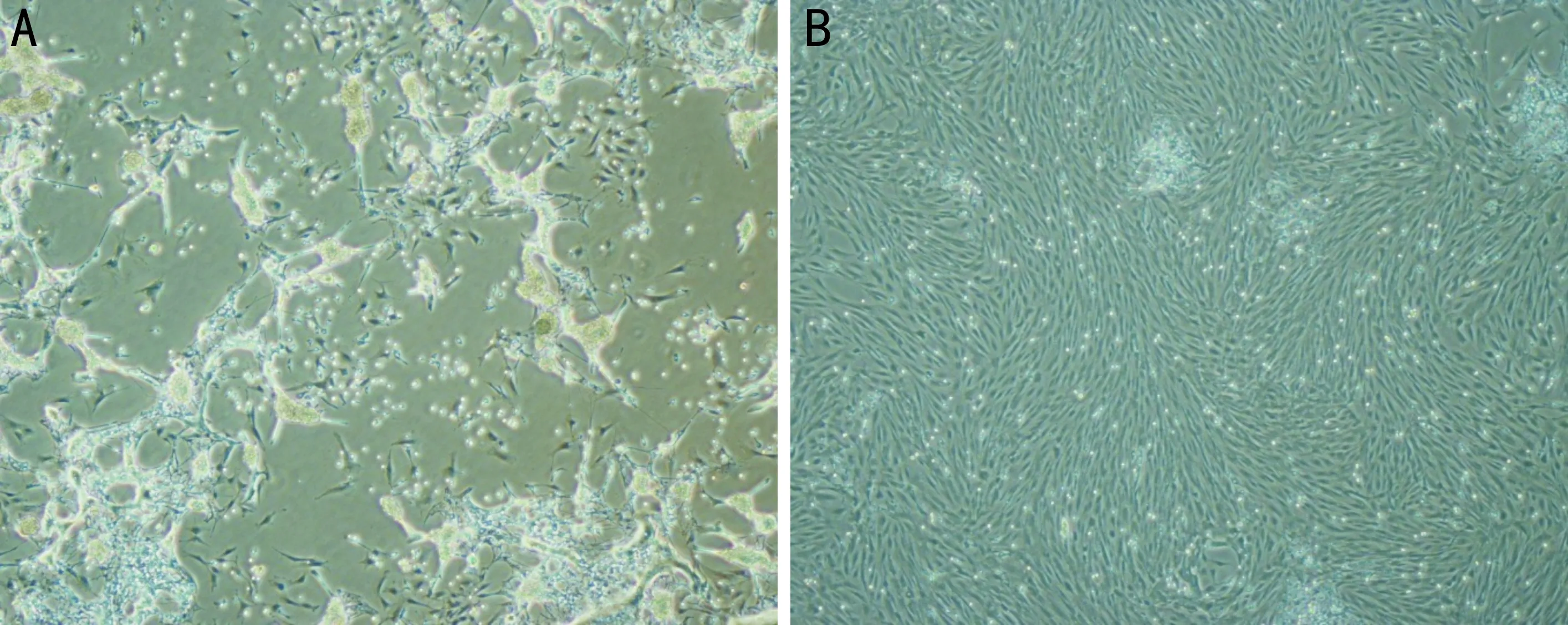
图1 大鼠视网膜Müller细胞形态观察(×100) A:原代培养3d,视网膜组织块周围不断有视网膜细胞爬出,贴壁细胞形态多样,呈梭形、多角形、不规则形,突起可有多条;B:原代培养10d,细胞融合。
1材料和方法
1.1材料实验动物:出生4~7d的Sprague Dawley(SD)大鼠(雌雄不限,SPF级)购自上海斯莱克实验动物有限公司。主要试剂:黄连素[美国 Sigma公司,14050,≥90%(AT),分子量371.81,C20H18ClNO4·xH2O],DMSO(美国Sigma公司),胎牛血清(美国Gibco公司),RPMI-1640(美国Hyclon公司),青链霉素混合液(100×)、0.25%胰蛋白酶-EDTA消化液(美国Solarbio公司),CCK-8细胞增殖及细胞毒性检测试剂盒(美国SAB公司),兔抗鼠GS抗体(美国Abcam公司,Ab49873),FITC标记山羊抗兔IgG抗体(上海碧云天生物技术有限公司,A0562)、DAPI(上海碧云天生物技术有限公司)。主要仪器设备:酶标分析仪(北京普朗新技术有限公司),CO2恒温培养箱(美国Thermo公司),荧光显微镜(日本Nikon公司),倒置相差显微镜(日本Olympus公司)。本研究获得复旦大学附属上海市第五人民医院动物实验伦理委员会批准。
1.2方法
1.2.1大鼠视网膜Müller细胞的原代培养和传代出生4~7d的SD大鼠腹腔注射戊巴比妥钠麻醉后取出眼球,在碘伏及含100U/mL青链霉素混合液的D-Hank液中各浸泡10min,D-Hank液冲洗,去除眼球外筋膜组织,沿角膜缘后1mm剪开眼球壁,去除眼前节及玻璃体,分离视网膜,将视网膜剪成小碎片,0.25%胰蛋白酶-EDTA消化液消化20min,吸管吹打,用含10%胎牛血清、1%青链霉素混合液的RPMI-1640培养液终止消化,铜网过滤,将过滤液离心,弃上清液,沉淀物加细胞培养液吹打稀释,接种于塑料培养瓶中,置于37℃、5%CO2培养箱中进行培养,每3d换液1次,去除悬浮细胞,待细胞贴壁达到80%融合后按1∶2传代。本实验所用细胞为传至2代细胞。
1.2.2大鼠Müller细胞的鉴定取第2代细胞接种于放置经多聚赖氨酸处理的盖玻片的六孔板内,细胞贴壁后弃培养液,用PBS液清洗,4%多聚甲醛固定10min,PBS液清洗,0.5% Triton穿孔15min,PBS液清洗,5%山羊血清封闭30min,加GS一抗(1∶200),4℃过夜,PBS液漂洗,加山羊抗兔FITC二抗(1∶500)37℃杂交1h,PBS液漂洗,加DAPI染核,PBS液漂洗,甘油封片,荧光显微镜下观察。
1.2.3 Müller细胞分组预先将黄连素溶解于50mmol/L DMSO溶液中,调整各组中黄连素浓度,同时保证各组中DMSO浓度≤0.05%。将处于对数生长期的大鼠视网膜Müller细胞分为正常糖浓度(5mmol/L)组、高糖浓度(25mmol/L)组、高糖+5μmol/L黄连素组、高糖+10μmol/L黄连素组、高糖+25μmol/L黄连素组、高糖+50μmol/L黄连素组和高糖+100μmol/L黄连素组。
1.2.4 CCK-8法检测Müller细胞增殖活性对数生长期的细胞经胰酶消化,在显微镜下计数后制成3×104个/mL的细胞悬液。接种至96孔培养板,每孔100μL,每组设3个复孔,置于培养箱分别培养24、48、72h后,按1∶10体积比混合CCK-8溶液和无血清培养基,每孔100μL加入待测孔中,培养箱中孵育1h后,用酶标仪测定在450nm波长处的吸光度(A)值并记录。
2结果
2.1大鼠视网膜Müller细胞形态观察大鼠视网膜Müller细胞原代培养24h后,部分视网膜细胞贴壁;2~3d后视网膜组织块周围不断有视网膜细胞爬出,首次换液去除未贴壁细胞及悬浮组织,贴壁细胞形态多样,呈梭形、多角形、不规则形,突起可有多条;7~10d原代细胞不断增生融合,生长抑制,细胞开始老化,此时予以传代,传代后第2、3代细胞生长活跃,细胞形态较一致,呈梭形、多角形、不规则形,可有数条突起,传至第4代后细胞老化明显,呈成纤维细胞样改变(图1)。
2.2大鼠视网膜Müller细胞的鉴定本研究培养的大鼠视网膜Müller细胞GS表达阳性率达90%以上,几乎所有细胞的细胞浆内均表达GS,细胞核周围局部可见点状高荧光聚集;DAPI染色显示Müller细胞核完整,呈蓝色荧光(图2)。
2.3黄连素对高糖培养下Müller细胞增殖的影响CCK-8
表1 不同浓度黄连素处理不同时间对大鼠Müller细胞增殖的影响
注:aP<0.05,bP<0.01vs同一时间正常糖浓度组;cP<0.05,dP<0.01vs同一时间高糖浓度组;eP<0.05,fP<0.01vs同一时间高糖+5μmol/L黄连素组;gP<0.05,hP<0.01vs同一时间高糖+10μmol/L黄连素组。
检测结果(表1)显示,正常糖浓度组、高糖浓度组、高糖+5μmol/L黄连素组、高糖+10μmol/L黄连素组、高糖+25μmol/L黄连素组、高糖+50μmol/L黄连素组和高糖+100μmol/L黄连素组细胞分别培养24、48、72h吸光度值比较,差异均有统计学意义(P<0.05)。与正常糖浓度组相比,高糖浓度组细胞分别培养24、48、72h吸光度值均明显降低,差异均有统计学意义(P<0.01)。与高糖浓度组相比,培养24h时,10、25、50、100μmol/L黄连素组细胞吸光度值明显上升,差异均有统计学意义(P<0.05);培养48h时,5μmol/L黄连素组细胞吸光度值无明显变化,10、25、50、100μmol/L黄连素组细胞吸光度值均明显上升,且25、50、100μmol/L黄连素组细胞吸光度值组间均无明显差异,但均高于5μmol/L黄连素组,差异均有统计学意义(P<0.05);培养72h时,5μmol/L黄连素组细胞吸光度值仍无明显变化,10、25、50、100μmol/L黄连素组细胞吸光度值均明显上升,且均高于5μmol/L黄连素组,而25、50、100μmol/L黄连素组细胞吸光度值组间无明显差异,但均高于10μmol/L黄连素组,差异均有统计学意义(P<0.05)。表明黄连素能促进高糖条件下Müller细胞的增殖活性。
2.4黄连素浓度与高糖培养下Müller细胞增殖的关系不同浓度黄连素组细胞培养72h的吸光度值与黄连素浓度呈正相关(r=0.7890,P<0.001),见图3,表明高糖环境下,随着黄连素浓度的增加,Müller细胞的增殖活性逐渐增强,高糖诱导细胞活性降低的效应逐渐减弱。
3讨论
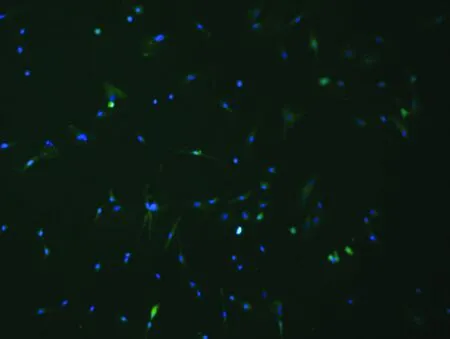
图2 大鼠视网膜Müller细胞的鉴定(×200) 绿色表示大鼠视网膜Müller细胞GS阳性表达;蓝色表示细胞核DAPI染色结果。
Müller细胞在高糖环境下尤其容易受到损伤,被认为是DR发生和发展的关键因素[9]。大量研究证实,体外高糖环境能够诱导Müller细胞发生凋亡,细胞增殖活性减弱[10-12]。本研究采用25mmol/L浓度的葡萄糖培养基模拟糖尿病患者体内的高糖状态,培养SD大鼠Müller细胞后,利用CCK-8法检测细胞增殖活性。CCK-8试剂中含有WST-8,其在电子载体(1-Methoxy PMS)的作用下被细胞中的脱氢酶还原为具有高度水溶性的橙黄色甲瓒产物,生成的甲瓒的量与活细胞的数量呈正比。结果发现,高糖浓度组Müller细胞吸光度值显著低于正常糖浓度组,提示高糖可导致细胞增殖活性降低,而25、50、100μmol/L黄连素组细胞吸光度值组间无明显差异,表明上述三组细胞增殖活性无明显差别,25μmol/L浓度的黄连素即可减轻高糖对大鼠视网膜Müller细胞增殖的抑制作用。
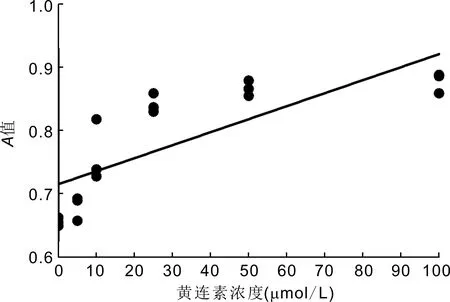
图3 黄连素浓度与高糖培养下Müller细胞吸光度值的关系。
黄连素药源广泛,价格低廉,具有降脂、降血糖、抗氧化、抗炎等多重作用[13-16]。研究表明,黄连素可以减轻由高糖、高脂诱导的人内皮细胞损伤,提高细胞存活率[16],还可显著抑制由链脲佐菌素诱导的小鼠胰岛细胞死亡[17]。高度氧化糖化的低密度脂蛋白(HOG-LDL)可显著降低人视网膜Müller细胞的活性,而黄连素可有效抑制HOG-LDL诱导的细胞损伤[18]。但黄连素对单一高糖作用下Müller细胞的作用效果及与其浓度的关系仍有待于进一步研究。本研究所采用的黄连素需溶解于DMSO溶液中,而DMSO具有一定的细胞毒性,含浓度为0.2% DMSO的培养液会抑制人视网膜色素上皮细胞(ARPE-19)的增殖,而含浓度为0.05% DMSO的培养液则对细胞增殖无明显影响[19]。为排除DMSO的干扰,本研究不同浓度黄连素组中的DMSO浓度≤0.05%,在高糖培养基中同时加入不同浓度(5、10、25、50、100μmol/L)黄连素培养Müller细胞发现,10μmol/L浓度黄连素即可有效抑制由高糖导致的细胞活性降低,且随着黄连素浓度的增加,作用效果逐渐加强,这与既往研究表明0~20μmol/L黄连素能够抑制细胞凋亡,且具有明显的浓度和时间依赖性[18-19]的结果一致。
氧化应激是糖尿病相关并发症的共同致病机制。体外高糖环境可使Müller细胞产生氧化应激反应,从而降低细胞活性。研究发现,核转录相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)可结合抗氧化反应元件诱导内源性抗氧化系统蛋白的表达,在Müller细胞氧化应激反应中具有重要作用[20]。Nrf2激活剂dh404不仅能减少氧诱导的视网膜病变中Müller细胞的胶质增生,同时通过增加Nrf2反应性抗氧化物减少缺氧诱导的Müller细胞中活性氧(ROS)及血管生成因子的升高[21]。Nrf2激活剂RS9能减轻光诱导的Müller细胞死亡[22]。另有研究表明,黄连素能显著降低糖尿病肾损伤大鼠的血糖水平和ROS、Kelch样环氧丙烷相关蛋白-1(Keap1)、还原型辅酶Ⅱ氧化酶4(NOX4)的水平,增强血清超氧化物歧化酶(SOD)活性以及Nrf2水平[23-24]。因此,黄连素可能通过调控Keap1-Nrf2/ARE信号通路缓解氧化应激,改善小鼠糖尿病肾病。黄连素还可明显促进抗氧化相关蛋白Nrf2的表达,抑制Keap1的表达,从而抑制由缺氧再复氧造成的心肌细胞活力降低和凋亡增加[25]。本研究发现,黄连素能有效抑制高糖诱导的细胞活性降低,分析可能是通过调控Nrf2信号通路,缓解高糖诱导产生的氧化应激反应而发挥抗氧化作用。
综上所述,高糖会抑制Müller细胞增殖活性,而经黄连素处理后可有效抑制由高糖诱导的细胞活性降低,且作用效果与黄连素浓度呈正相关,为黄连素应用于治疗DR提供了一定的实验依据。本研究后续将对黄连素0~50μmol/L浓度梯度内,高糖环境下视网膜Müller细胞凋亡、炎症因子的变化、氧化应激反应及其相关作用机制和作用靶点做进一步探索。

