遮光对杉木幼苗树干表面CO2通量的影响
贺同鑫,赵国华,刘兰兰,孙建飞,张忠华,张建兵,杨庆朋,3,*
1 中国科学院森林生态与管理重点实验室,中国科学院沈阳应用生态研究所,沈阳 1100162 广西师范学院北部湾环境演变与资源利用教育部重点实验室,广西地表过程与智能模拟重点实验室,南宁 5300013 中国科学院会同森林生态实验站,亚热带森林生态系统结构与服务功能湖南省重点实验室,会同 4183074 国家林业局华东林业调查规划设计院,杭州 310019
森林生态系统的自养呼吸是陆地生态系统碳循环的重要组成部分[1],每年释放到大气中的CO2量是化石燃料释放量的6—7倍,占整个大气CO2总量的1/15[2]。树干表面CO2通量占自养呼吸的12%—42%[3-4],其变化将对大气CO2浓度以及全球碳平衡产生重要影响。近年来,由于全球变化如CO2浓度增加、温度升高以及旱涝灾害频发等,导致植物光合产物供应发生改变,其对树干表面CO2通量的影响及机理越来越受到研究学者的关注[5- 8]。树干表面CO2通量是一个生物学过程,受环境(温度、湿度、大气CO2浓度、光合有效辐射、土壤养分和水分等)和生物(树种、树龄、径阶、林木含氮量等)因素的共同调控。外源环境的变化可以通过影响植物的生长状态,间接的改变植物光合产物供应,进一步影响树干表面CO2通量[9];而且这种影响因树种、树龄等生物因素的不同而存在差异[8]。现有研究表明增加光合产物供应能够增加树干表面CO2通量33%—130%[10-11],而减少光合产物供应则导致其降低14%—65%[6,11-12]。环剥和修枝是常用的减少植物光合产物供应的手段[6- 7,13- 14],但这些方法通常会对植物造成较大的伤害,破坏其生理过程进而产生较大的误差。光能是植物进行光合作用合成碳水化合物的必需条件,因此遮光能够通过改变植物的光合特性以及相关的生理过程(光合速率、气孔导度和蒸腾速率等),从而影响光合产物在植物体内的形成、运输和分配[15-16],进而改变植物光合产物的供应状况[17-18]。如Bahn等[18]的研究表明遮光降低植物茎叶中蔗糖和淀粉含量导致叶片呼吸速率下降。
温度是影响树干表面CO2通量最为重要的环境因素,一般来说,树干表面CO2通量会随着温度的上升而增强[8]。然而,光合产物供应变化可能会改变树干表面CO2通量对温度变化的响应程度[19-22],Q10通常用来指示树干表面CO2通量对温度变化的敏感程度。如Maier等[6]在火炬松(Pinustaeda)林进行的树木环剥研究表明,环剥位置上方的树干表面CO2通量Q10值增加,下方的Q10值下降;而Yang等[23]在杉木林(Cunninghamialanceolata)中的研究表明光合产物供应变化对Q10值没有产生显著的影响。Edwards等[10]在枫香林中(Liquidambarstyraciflua)的研究表明增加光合产物供应导致生长季Q10值降低,而非生长季Q10升高。可见,光合产物供应变化对树干表面CO2通量及其温度敏感性的影响可能因树种和植物生长期等不同而有所不同。然而,目前受研究方法所限,关于光合产物供应变化怎样影响树干表面CO2通量及其温度敏感性的研究较少,限制了对树干表面CO2通量变化机理的深入探讨。
杉木作为亚热带地区主要的造林树种,2014年其造林面积已达到8.95万hm2[24],作为潜在的巨大碳汇在缓解大气CO2浓度升高和全球变暖方面发挥着重要作用[25]。因此,本研究以杉木为研究对象,采用盆栽和遮光的方法探讨光合产物供应对杉木树干表面CO2通量的影响及其机理。研究目标:1)探讨光合产物供应变化对树干表面CO2通量的影响;2)光合产物供应变化对树干表面CO2通量温度敏感性的影响。
1 材料和方法
1.1 供试材料
供试土壤采自中国科学院会同国家森林生态实验站(110.13°E、27.15°N)26年生杉木人工林。其密度为1200株/hm2,平均树高和胸径分别为16.3 m和18.5 cm。于杉木人工林中随机选取6块10 m×10 m的样地小区,每个小区采用5点采样法采集0—20 cm土壤。将采集的所有土壤完全混匀,过2 mm筛,去除石砾和植物根系等杂物,风干备用。土壤类型为山地红黄壤,其砂粒、粉粒和黏粒含量分别为(8.7%±1.9%),(42.8%±1.3%),(48.5%±1.9%),土壤pH为(4.7±0.1),土壤全碳含量为(17.1±0.3) g/kg。供试植物为长势良好且生长情况基本一致的2年生杉木幼苗。
1.2 研究设计
杉木的生长季为4—10月,因此本研究于2015年4月选取35株杉木幼苗分别移栽至直径55 cm,深度35 cm的花盆(1棵/盆),每盆装入50 kg上述土壤,并加入等量的水,保持含水量为最大田间持水量的60%,保证幼苗的成活,随后进行3个月的缓苗期。缓苗1个月后,即5月份测定1次幼苗地径、树高和枝长。选取长势基本一致,地径、树高和枝长均无显著差异的20盆幼苗随机分成A(对照)、B(遮光处理)两组,每组各10盆。6月份再测定1次幼苗地径、树高和枝长,具体数据如表1所示。B组用遮光率60%的遮光网在树木上方1 m处进行遮光,改变植物的光照条件。试验期间盆栽幼苗置于室外挡雨棚中,除遮光处理外其他条件均相同。7月28日到8月28日期间进行遮光处理,8月29日以后恢复光照。遮光处理前测定1次树干表面CO2通量,遮光处理1周后开始测定,每10天测量1次,连续测量1个月。1个月后进行破坏性取样:即在A、B两组中各随机选取5盆杉木苗,分别测定树干可溶性糖、淀粉和非结构性碳含量。对B组剩余的5盆杉木幼苗进行恢复光照处理,A组继续作为对照组。每10天测量1次树干呼吸,共测量2次。9月18日实验结束后,破坏性取样测量两组树干可溶性糖、淀粉和非结构性碳含量。

表1 杉木幼苗地径、树高及枝长
数据为平均值±标准误(n=10);A:对照,Control;B:遮光,Shade
1.3 树干表面CO2通量和温度的测定
树干表面CO2通量利用改造的Li- 8100土壤碳通量测量系统进行测量。将Li- 8100主机上的进气管和出气管及土壤同化室拆除,截两段与Li- 8100出气管和进气管相同的塑料管插到主机上,形成新的出气管与进气管。截取一段长10 cm,直径4.5 cm的PVC环,劈开形成两个半圆形的环,用于制作气室。在每个半圆形环的中间部位钻一个小孔,把新的出气管和进气管分别从PVC环的外部插入小孔里,用硅橡胶把小孔与管之间的缝隙密封。其中,把插入小孔内的进气管部分拧成螺旋状,并用针在上边均匀的钻几个小孔,并将PVC环内的进气管缠绕在杉木苗的树干以确保自制气室内空气混合均匀。最后,将橡胶皮剪成两个直径大于PVC环的圆片,在圆片的中间钻两个与树干直径差不多的圆孔,将圆孔到圆片的外边缘之间剪开。测量时,将其中一个橡胶圆片放在盆栽的土壤上,圆片的圆孔与树干之间用中性硅胶密封,然后将PVC环放到橡胶圆片上,之后再把另一个橡胶圆片放到PVC环上,将圆片与PVC环,两个PVC半环之间以及橡胶圆片与树干之间全部密封。检查气密性符合要求后开始测定树干表面CO2通量。测量结束后,将装置取下,每次测定时需要重新安装。由于研究对象为杉木幼苗,钻孔测定树干温度对树苗的破坏性太大,因此我们使用Li- 8100自带的温度探头测定树干表皮温度以代替树干温度。
1.4 非结构性碳的测定
本文中的非结构性碳含量是可溶性糖(葡萄糖、果糖和蔗糖)和淀粉含量的总和。为尽可能的减少碳水化合物日变化的影响,通常在9:00—11:00之间采集树干样品,并立即放入冰盒带回实验室。样品于105℃杀青15 min,然后70℃烘干至恒重。
可溶性糖和淀粉采用酶分析法测定[26-27]。具体操作步骤为:将树干样品粉碎磨细过0.5 mm筛,称取约100 mg的烘干样品置于离心管中,并在离心管中加入10 mL乙醇溶液(体积分数为80%),用漩涡振荡器充分摇匀30 s之后放入80℃的水浴锅中水浴10 min,然后3000 rpm离心10 min,收集上清液于比色管中,将离心管中剩余的沉淀物质重复上述操作并再次收集上清液。将2次收集的上清液合并,用于测量可溶性糖含量,最终剩余的沉淀物质用于测定淀粉含量。可溶性糖含量采用K-SUFRG 试剂盒(Megazyme,Wicklow,Ireland)测定。各种试剂均按试剂盒配套的说明书进行添加,在340 nm下比色(对照为用蒸馏水代替样品加入同样试剂),根据说明书所设公式计算可溶性糖含量。淀粉浓度采用K-TSTA 试剂盒(Megazyme,Wicklow,Ireland)测定。其原理为淀粉在α-耐热淀粉酶(α-amylase)的作用下水解为麦芽糖糊精,麦芽糖糊精在淀粉葡糖苷酶的进一步作用下水解为葡萄糖。葡萄糖浓度的测定方法为先加入葡萄糖氧化酶/过氧化物酶,然后在510 nm波长下测定吸光度(对照为在蒸馏水中加入葡萄糖氧化酶/过氧化物酶),根据说明书所设公式计算淀粉含量。
1.5 数据处理
PVC环覆盖的树干表面积计算公式如下:
S=π×D×H
(1)
式中,S为PVC环所覆盖的树干表面积(cm2),D为树干直径(cm),H为PVC环的高度(cm)。
树干表面CO2通量的温度敏感性(Q10)计算公式如下:
R=aebT
(2)
Q10=e10b
(3)
式中,R表示树干表面CO2通量;T表示树干温度;利用SPSS软件将R和T数据按照公式(2)进行拟合,b为式(2)拟合的温度反应系数。
本文中树干表面CO2通量、树干温度和树干非结构性碳含量的比较均采用单因素方差分析,统计显著性水平设定为P=0.05。数据分析采用SPSS 19.0完成,绘图采用Origin 8.5。
2 结果
2.1 树干非结构性碳含量
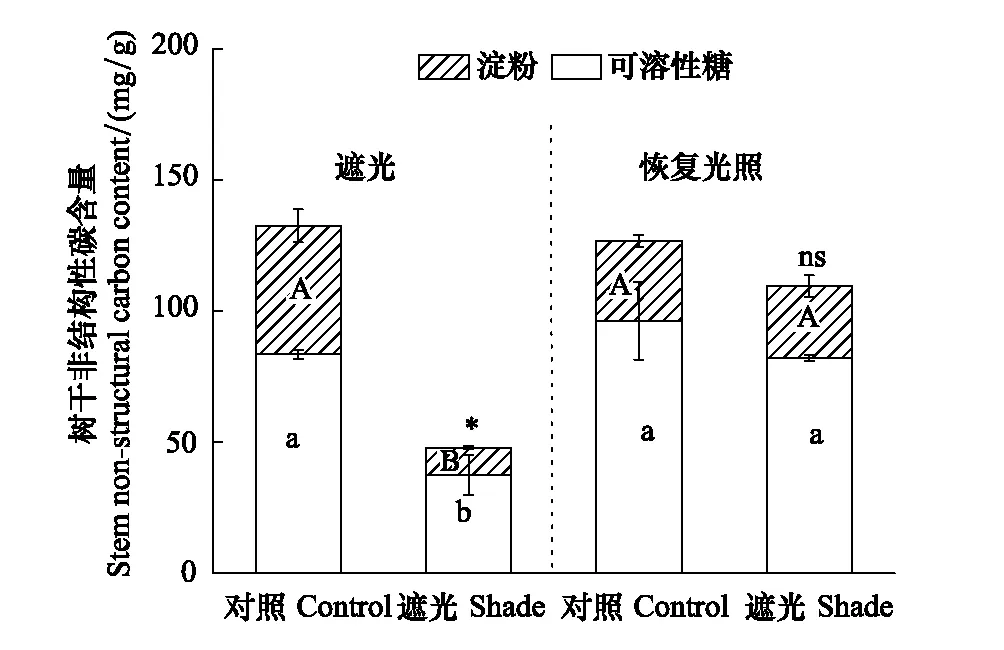
图1 树干非结构性碳含量变化(平均值±标准误差) Fig.1 The changes in stem non-structural carbon content (mean ± SE) 不同大写字母、小写字母分别表示淀粉和可溶性糖含量在不同处理间差异显著,*代表非结构性碳含量差异显著,ns表示差异不显著
遮光显著降低了树干可溶性糖、淀粉和非结构性碳含量(P<0.01,图1)。对照组可溶性糖、淀粉和总非结构性碳含量分别为83.5±1.7、49.0±6.3、132.5±8.0 mg/g,遮光组分别为37.6±7.6、10.3±0.5、47.3±7.2 mg/g,分别减少了55.0%、78.9%、64.3%。恢复光照后,对照和遮光处理的树干可溶性糖、淀粉和总非结构性碳含量均无显著差别(P>0.05)。
2.2 树干温度
遮光处理前两组的树干温度没有显著差异。遮光后第一次测定(8月6日)树干温度显著降低4.4℃;第二次测定(8月15日)树干温度略有降低,但不显著;第三次测定(8月28日)树干温度显著降低3.8℃。恢复光照后树干温度恢复至对照组水平(图2)。
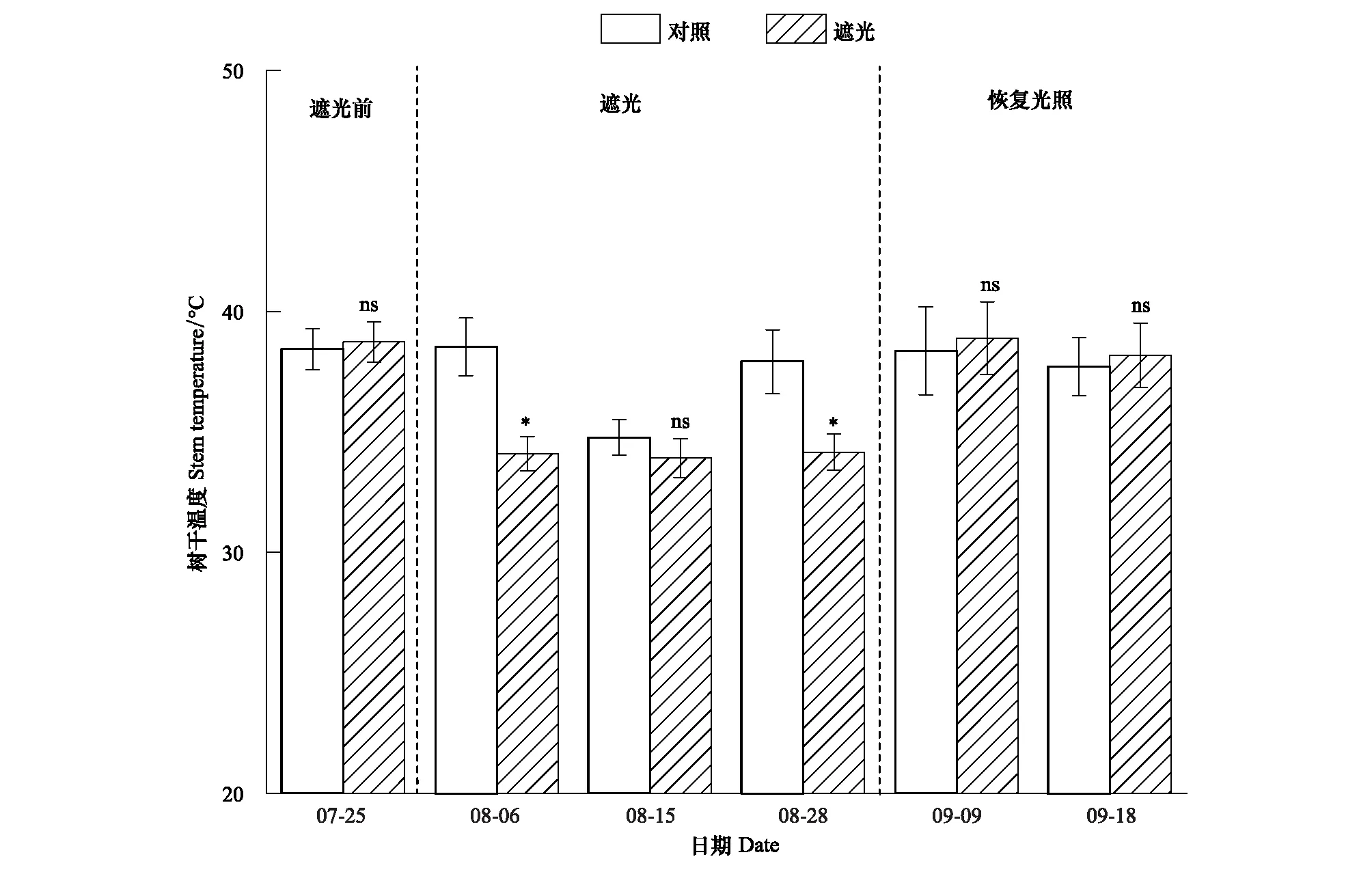
图2 树干温度动态变化(平均值±标准误差)Fig.2 Dynamics of tree stem temperature (mean ± SE)
2.3 树干表面CO2通量
遮光处理前对照和遮光组的树干表面CO2通量没有显著差异(P>0.05,图3),分别为1.17±0.14和1.19±0.11 μmol m-2s-1。遮光处理后3次测定的树干表面CO2通量均显著低于对照处理(P<0.05),遮光处理阶段平均树干表面CO2通量显著降低了39.9%(对照和遮光分别为:1.34±0.08和0.81 ± 0.04 μmol m-2s-1);而且随着遮光处理时间的延长,树干表面CO2通量的降低幅度有逐渐增加的趋势,分别为36.1%,39.3%和46.1%。遮光处理的杉木幼苗在恢复光照后树干表面CO2通量显著上升了43.2%(P<0.001),遮光和恢复光照处理分别为0.81±0.04 μmol m-2s-1和1.16±0.05 μmol m-2s-1,对照组在遮光和恢复遮光处理阶段树干表面CO2通量并无显著差异(P>0.05);而且恢复光照后两个处理间的树干表面CO2通量差异不显著(P>0.05,图3)。树干表面CO2通量与温度拟合曲线结果表明对照处理中温度与树干表面CO2通量存在显著相关性,遮光处理导致两者相关性不显著,而且遮光处理导致树干表面CO2通量的Q10值下降(表2)。
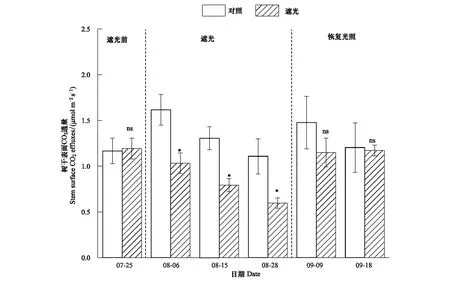
图3 树干呼吸速率动态变化(平均值±标准误差)Fig.3 Dynamics of tree stem respiration rate (mean ± SE)

abR2Q10n对照Control0.0820.0740.529∗∗2.1030遮光Shade0.1460.050.085ns1.6530
**:P< 0.01;ns:无差异
3 讨论
3.1 遮光对树干表面CO2通量的影响
本研究发现遮光显著降低了树干表面CO2通量,而光照恢复后树干表面CO2通量也恢复至对照水平,表明遮光对树干表面CO2通量产生显著的影响,但其原因可能是复杂的。已有的研究表明温度是决定树干表面CO2通量的首要因素,通常树干表面CO2通量随温度升高呈指数增加[7]。本研究中遮光导致树干表面温度下降,这在一定程度上造成了树干表面CO2通量的下降。尽管如此,相比于对照组树干表面CO2通量随温度升高显著增加,遮光组中树干表面CO2通量与温度的相关性则不显著,这表明遮光后温度与树干表面CO2通量的关系受到其他因素的影响。此外,在8月15日的测定中,遮光对树干表面温度没有产生显著影响,而树干表面CO2通量依然大幅度下降,这进一步表明除温度以外的其他因素导致了树干表面CO2通量的显著下降(图2,图3)。非结构性碳作为植物生长代谢过程中重要的能量供应物质和植物呼吸作用的底物,其含量变化会对植物呼吸产生重要影响[6,28]。本研究结果发现遮光显著降低了树干中可溶性糖和淀粉含量;此外,本研究也发现随着遮光时间的延长,树干表面CO2通量下降幅度逐渐增加,这也间接表明遮光导致光合产物供应下降可能是树干表面CO2通量下降的另一个主要原因,该结果与前人的研究结果较为一致[6,10- 12]。如Maier等[6]在火炬松林中采用环割方法阻断光合产物的传输,发现环割以下部分的树干由于降低了非结构性碳含量,从而导致树干表面CO2通量下降了50%。
Wertin和Teskey[11]在美洲黑杨林(Populusdeltoides)中为期1周的研究表明CO2浓度升高引起光合产物供应的增加使树干表面CO2通量增加了130%,而全部遮光处理导致树干表面CO2通量下降了65%。本研究通过为期1个月的60%的遮光处理改变杉木幼苗光合产物供应,导致树干表面CO2通量下降了39.9%,这与上述研究相比其下降的幅度偏小。一方面是由于环割和全部遮光处理基本完全阻止植物光合产物对树干的供应,而我们采用的60%的遮光处理只是部分的减少光合产物供应,因此树干表面CO2通量下降幅度较低。本研究结果与Clinton等[12]在长叶松(PinuspalustrisMill.)林中的研究较为一致,其发现火烧处理导致树木的叶面积降低,部分减少了光合产物对树干的供应,因而导致树干表面CO2通量降低了14%—34%。另一方面,杉木具有很强的萌芽能力,储存的非结构性碳含量较高[29],当遮光降低光合速率后,树干中储存的非结构性碳水化合物可暂时作为树干呼吸的底物,这在一定程度上降低了树干表面CO2通量的下降幅度。
综合以上结果表明遮光后温度下降和光合产物供应的降低共同导致了杉木幼苗树干表面CO2通量的下降,树干光合产物供应的下降是其降低的主要原因,而温度的影响是次要的,这也间接的表明利用遮光方法来研究光合产物变化对树干呼吸的影响是切实可行的。然而,本研究中很难将两者的单独效应和交互作用进行区分量化,这可能需要后期进行更为精细的人为控制实验方能对其加以区别。
3.2 遮光对树干表面CO2通量温度敏感性的影响
树干表面CO2通量对温度的响应对于预测全球变化背景下森林生态系统碳循环具有重要意义,综合分析研究结果表明树干表面CO2通量的Q10值在1.0—3.0之间[30],本研究对照组树干表面CO2通量的Q10值为2.1,在以往的研究结果范围内。目前的研究普遍认为树干表面CO2通量的Q10值与温度呈负相关关系,即温度越低Q10值越大[31]。然而,本研究发现尽管遮光处理导致树干温度下降,但Q10值不增反降,这说明遮光后树干表面CO2通量的温度敏感性受到其他因素的调控。遮光引起的光合产物供应降低可能是导致Q10值下降的一个重要原因。一般认为随着温度的升高,植物呼吸速率升高,直到达到最大反应速率(Vmax);然而呼吸速率能够达到最大值的前提条件是底物供应必须充足,光合产物供应下降会限制呼吸速率升高的程度,进而导致Q10值的下降。此外根据Michaelis-Menten理论(R=Vmax×C(Km+C)),光合产物供应浓度(C)的变化能够通过影响半饱和常数(Km)来改变呼吸对温度的响应程度。该理论认为Vmax和Km均具有温度敏感性,当底物供应低时,Vmax和Km的温度敏感性部分抵消导致Q10值的下降。Maier等[6]在火炬松林进行的树木环剥研究表明在环剥位置上方树干表面CO2通量的Q10值增加,下方的Q10值降低,这表明降低树干光合碳供应导致树干表面CO2通量的Q10值下降。Azcón-Bieto等[32]和Covey-Crump[33]通过添加外源葡萄糖增加对植物根系的碳供应,其结果也证明改变植物的碳供应能够影响植物呼吸的温度敏感性。然而,由于本研究采用破坏性取样方法,受样本量限制,树干非结构性碳的数据量较少,所做的数据分析可能存在一定的不足,这限制我们深入剖析光合产物供应变化如何影响树干呼吸及其温度敏感性。
4 结论
本研究结果表明:(1)遮光导致树干温度和非结构性碳含量下降,两者共同导致树干表面CO2通量下降了39.9%,降低树干光合产物供应是其下降的主要原因;(2)光合产物供应变化能够影响树干表面CO2通量对温度变化的响应;(3)目前的结论是基于现有数据的分析得出的,由于树干表面CO2通量测定比较难,而且涉及破坏性取样,导致样本数量和树干非结构性碳含量数据较少,而且缺少遮光梯度处理,限制了我们深入探索遮光是如何影响树干表面CO2通量及其温度敏感性,是本研究的不足之处。
致谢:感谢中国科学院会同国家森林生态实验站于小军和王晓峰在实验布置工作中给予的帮助。

