模拟增温和丛枝菌根对门源草原毛虫幼虫生长发育的影响
陈珂璐,石国玺,张中华,姚步青,马 真,王文颖,周华坤,*,赵新全
1 中国科学院西北高原生物研究所,青海省寒区恢复生态学重点实验室,西宁 8100082 天水师范大学,生物工程与生物技术学院,天水 4730613 青海大学,高原生态与农业国家重点实验室,西宁 8100014 青海师范大学,生命与地理科学学院,西宁 8100085 中国科学院大学,北京 100049
当前,植食性昆虫对于气候变暖的响应已成为深入了解全球变暖对地球生态系统复杂影响的关键和热点问题之一。气候变暖对于植食性昆虫的影响,主要通过调节昆虫和植物的代谢水平平衡、昆虫所取食植物的生长-分化平衡以及昆虫来实现[1]。此外,昆虫天敌、第二营养级其他生物和地下生物也会对上述过程产生复杂影响[2-3]。气候变化对植食性昆虫的作用,是由上述多个生态过程相互作用所产生的的综合结果。
门源草原毛虫(Gynaephoramenyuanensis)是青藏高原东北部的特有物种[4]。该物种一个世代周期为1年,共经历幼虫期、蛹期、成虫期以及卵期4个发育阶段。此外,这一物种在发育过程中表现出性二型性,其雌雄幼虫的发育龄期分别为7龄和6龄,且自6龄开始,雌性幼虫个体的体重、体长、头宽等形态指标开始大于雄性个体,另外,其成虫在形态和习性等方面均有明显差异[4]。门源草原毛虫是一种完全变态昆虫,其一龄幼虫以滞育状态进行越冬,每年3月中下旬结束滞育成为二龄幼虫并开始活动,至7月份,其雄性个体完成六龄发育开始化蛹,雌性个体继续发育经第7个龄期后进入蛹期,8月中旬以后破蛹成虫,9月中旬前完成交配产卵,10月中旬左右一龄幼虫孵化随即进入滞育状态越冬[4]。门源草原毛虫是多食性昆虫,喜食禾草类和莎草类植物叶片,其食谱随生长发育及密度增长有所扩大[5]。鉴于上述特性,门源草原毛虫可被作为气候变暖背景下生物适应性研究的模式物种。
丛枝菌根真菌(Arbuscular mycorrhiza fungi,AMF) 可通过宿主植物获取其生长发育所必须的碳水化合物,作为回报,AM真菌则帮助植物吸收磷、氮等矿质元素[6]。以往的研究表明它们能够通过宿主植物对食草动物产生影响[7- 8]。然而目前还没有关于AMF和增温对植食性昆虫综合影响的研究,为填补这一空白,进一步挖掘AMF在陆地生态系统应对气候变暖过程中发挥的作用,我们以门源草原毛虫为研究对象,通过模拟增温和杀菌剂抑制AMF侵染,于青藏高原高寒矮嵩草草甸进行了野外试验,拟回答以下问题:1)增温对于门源草原毛虫幼虫的生长发育有何影响;2)丛枝菌根对门源草原毛虫幼虫生长发育有何影响;3)丛枝菌根是否能够调节增温对于门源草原毛虫幼虫的影响?
1 试验材料和方法
1.1 试验区域
本研究野外工作部分在中国科学院海北高寒草甸生态系统定位观测站(以下称“海北站”)附近草地进行。该站位于青藏高原东北部,祁连山南麓,地理坐标为37°29′—37°45′N,101°12′—101°23′E,平均海拔3200 m。站区属高原大陆性气候,季风微弱,空气稀薄,年平均气压为691 hPa,年均大气密度为0.8496 kg/m3[9],植被为高寒矮嵩草草甸,其优势种以垂穗披碱草(Elymusnutans)、早熟禾(Poaspp.)、异针茅(Stipaaliena)等禾草和莎草类植物为主,平均植被覆盖率达到95%[9]。
1.2 试验设计与方法
本试验采用增温与AMF控制相耦合的两因素两水平设计,共4个处理:不增温不施用杀菌剂(No warming×No fungicide,NWNF)、不增温施用杀菌剂(No warming×Fungicide,NWF)、增温不施用杀菌剂(Warming×No fungicide,WNF)、增温施用杀菌剂(Warming×Fungicide,WF),每个处理组设置5个重复,所有试验均于花盆中进行。于2016年3月将草地植被原位移栽到规格为直径32 cm×高23 cm的花盆中,每个花盆上安装一个直径30 cm,高60 cm的扣笼。扣笼由粗铁丝制成的框架并罩以孔隙大小为0.2 mm×0.2 mm的细钢丝网构成,用以限制门源草原毛虫幼虫的活动范围,避免毛虫的丢失。
本试验采用开顶式增温室(Open top chamber,OTC)进行模拟增温,规格为高度0.40 m,底部直径1.15 m,顶部直径0.70 m[10]。增温效果已在我们先前的研究中有过报道[11]。
丛枝菌根控制处理通过苯菌灵杀菌剂实现。苯菌灵对丛枝菌根能够产生有效的抑制作用,并且对其他种类的生物影响较小,被广泛应用于丛枝菌根研究中[12-13]。于实验开始后每隔5天向花盆中施用0.5 L浓度为2 g/L的苯菌灵溶液一次,对照组施用等体积清水。
1.3 试验指标测定
为了检验苯菌灵对AMF侵染的抑制效果,于2016年10月用环刀对花盆内土壤进行取样,每个花盆取直径2.5 cm×深度14 cm的土壤三份并混合,将上述样品带回实验室后参照刘润进等[14]的方法进行预处理。
随机挑选上述已处理的根段于洁净载玻片上并加盖盖破片后测定根断侵染率,每个处理测定5次,每次选取5个根段,其侵染率均值作为该重复内的菌根侵染率[14]。
2016年3月下旬开始,每天在试验区域附近尽可能多地采集刚刚结束越冬的幼虫,于4月3日采集到足够进行试验数量的幼虫,逐个称量后选取体重近似相等的个体放入上述花盆内进行试验,每个花盆放5只幼虫,于7月上旬,幼虫化蛹前,对其体重进行称量。生长速率(Growth rate,GR)按如下公式计算:
GR=(M2-M1)/D
式中,GR表示生长速率,M2为第二次测量体重,M1为初次测量体重,D为两次测量相隔天数,上述测量体重均为鲜重。
在上述称量操作完成后,观察并记录幼虫的蛹化时间直至所有幼虫完成化蛹。
1.4 数据分析
采用广义线性模型对所得数据做了两因素方差分析,在有交互作用的情况下运用Tukey HSD对各组间的均值进行比较,对交互作用不明显的指标,采用独立样本t检验对其进行均值比较。所有分析及统计图形的制作均使用IBM SPSS Statistics 22和Microsoft office Excel 2013软件完成。
2 结果
2.1 苯菌灵对丛枝菌根的抑制效果
苯菌灵显著地抑制了AMF对高寒矮嵩草草甸植物根系的侵染(F=57.373,P<0.001,表1)。相比未使用灭菌剂的处理组而言,苯菌灵使得AMF侵染率降低了29%(图1)。本试验中的增温处理对上述抑制作用不构成干扰(表1)。

表1 增温和丛枝菌根抑制对试验指标影响的方差分析
W:增温,Warming; F:杀菌剂,Fungicide; W×F:增温和杀菌剂,Warming and fungicide
2.2 增温和丛枝菌根抑制对门源草原毛虫幼虫生长发育的影响
对照组(不增温不施用苯菌灵)、增温、丛枝菌根抑制(施用苯菌灵)、增温×丛枝菌根抑制组的门源草原毛虫幼虫生长速率分别为1.63、2.17、1.57、1.88 mg/d(图2)。增温、丛枝菌根抑制以及两者间交互作用均对门源草原毛虫幼虫的生长速率有着显著的影响(F值分别为56.109,9.292,4.345,P值分别为<0.001,0.003和<0.040;表1)。相比对照组(不增温不施用苯菌灵)而言,增温将门源草原毛虫幼虫的生长速率提升了34%(图2)。增温和丛枝菌根抑制使得这一指标较对照组升高了16%,而较增温处理降低了13%(图2)。
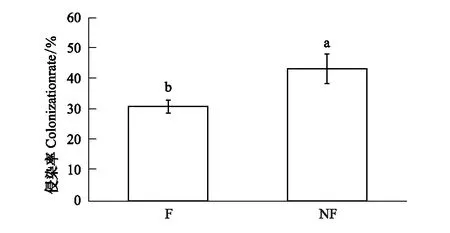
图1 丛枝菌根抑制效果 Fig.1 Colonization rate of AMF under different treatmentsF:杀菌剂,Fungicide; NF:无杀菌剂,No fungicide; 不同字母表示差异显著,P<0.05

图2 不同处理下门源草原毛虫幼虫生长速率 Fig.2 Growth rate of Gynaephora menyuanensis under different treatmentsNWNF:不增温且无杀菌剂,No warming and no fungicide; NWF:不增温施用杀菌剂,No warming and fungicide; WNF:增温无杀菌剂,Warming and no fungicide; WF:增温且施用杀菌剂,Warming and fungicide
增温对门源草原毛虫雌、雄性幼虫的蛹化时间均有显著的影响(F=21.188,P<0.001;F=69.597,P<0.001。表1)。增温处理下雌、雄幼虫的蛹化时间分别为204、218 d,而不增温处理下分别为212、223 d(图3)。增温使得雌、雄幼虫的蛹化时间较不增温处理分别提前了2%和4%。增温和不增温处理下的雌、雄虫蛹化时间差分别为15、12 d(图3)。增温将上述时间差扩大了25%。
增温及其与丛枝菌根抑制的交互作用对门源草原毛虫雌虫蛹重的影响显著(F值分别为17.952和5.354,P值分别为0.001和0.036,表1),而对于雄虫的蛹重来说,仅增温处理的影响显著(F=5.374,P=0.034,表1)。增温和增温丛枝菌根抑制处理,使得雌蛹重较对照组增大了22%和8%(图4)。增温使雄蛹重增大了18%(图5)。
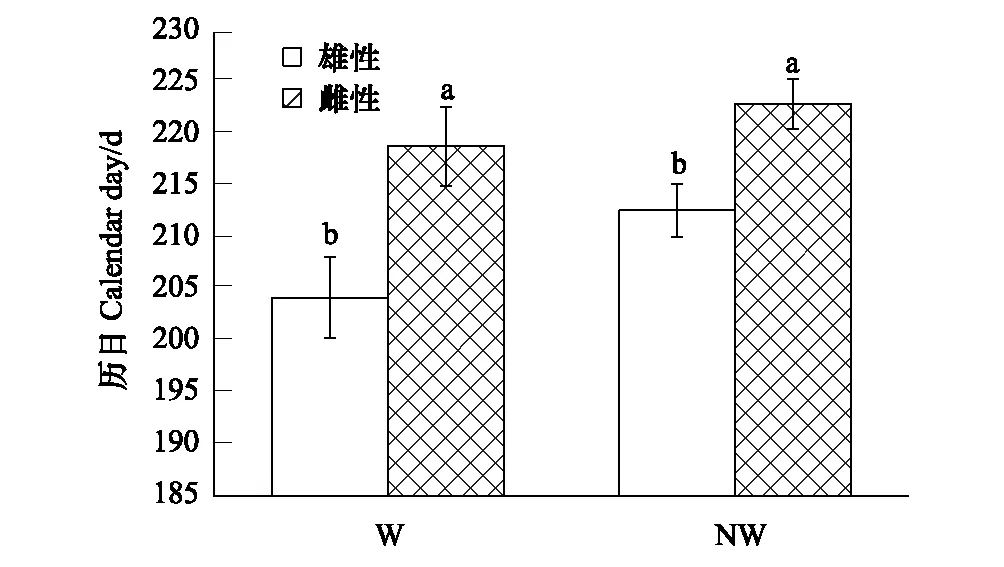
图3 增温对门源草原毛虫幼虫蛹化时间的影响 Fig.3 Effects of warmign on pupation time of Gynaephora menyuanensis NW:不增温,No warming; W:增温,Warming
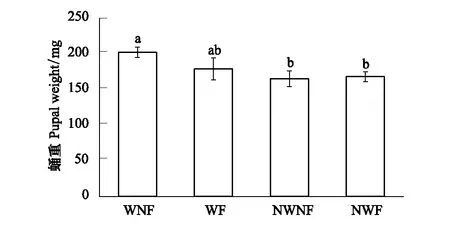
图4 不同处理下的门源草原毛虫雌蛹重 Fig.4 Female pupal weight of Gynaephora menyuanensis under different treatment

图5 不同处理下门源草原毛虫的雄蛹重 Fig.5 Male pupal weight of Gynaephora menyuanensis under different treatment
3 结论与讨论
本试验的结果表明,增温显著地升高了门源草原毛虫幼虫的生长速率,提前了门源草原毛虫蛹化时间,这与我们前期的结果一致[11]。余欣超等[11]的研究显示,适当增温能够促进门源草原毛虫的生长,提高该物种种群的存活率,而增温到达一定程度后又会对该昆虫产生抑制效应。这种抑制效应可能是由于过高的增温幅度抑制了门源草原毛虫幼虫的代谢过程,另一方面也可能是因为由于增温在促进门源草原毛虫幼虫代谢速率的同时,造成了植物C/N比的升高[15],降低了该昆虫对食物的利用率[4],使其获取的能量不足以支持代谢过程的需要,进而形成了过多的消耗。与本文的研究结果不同,曹慧等[16]认为在放牧条件下的增温提高了门源草原毛虫幼虫的生长速率,而单独的增温并未对上述指标产生显著影响,这可能是因为两组试验所采用的的增温设施以及试验样地植被情况不一致。此外,作为完全变态昆虫的一种,门源草原毛虫的一个世代要经历幼虫期、蛹期、成虫期、卵期4个发育阶段,其幼虫期主要进行营养生长[4]。该类昆虫在幼虫期面临着极端环境、天敌捕食、种间偏害关系等的威胁[3,17-18]。本研究表明增温提前了门源草原毛虫蛹化时间,这有利于其在一定程度上避免发育末期青藏高原东北部的低温环境以及更少的暴露在天敌等的威胁之下。
幼虫期的提前结束意味着毛虫更早地完成了变态发育和繁殖所需的能量积累,也将进一步导致羽化及产卵时间的提前[18]。从更长的时间尺度来看,增温导致的上述变化会使得门源草原毛虫生活史周期的缩短乃至世代数的增加,这将大大有利于该物种后代的繁衍和种群规模的扩大[19]。
此外,本文的结果表明增温明显增大了门源草原毛虫蛹的重量,而蛹重的增大意味着其成虫繁殖能力的提高[20],余欣超[19]的研究能够证实这一观点。
丛枝菌根对于植食性昆虫的影响,主要通过其宿主植物实现。AMF是植物专性营养共生菌,通过宿主植物获取其生长发育所必须的碳水化合物,作为回报,AM真菌则帮助植物吸收磷、氮等矿质元素[21]。AMF还可以调节植物抗逆抗病等生理作用[22],进而改善植物与昆虫的相互关系[23]。大多数禾草类植物、少数莎草科植物以及部分其他杂草都能够与丛枝菌根真菌形成互惠共生体[24]。门源草原毛虫幼虫的食物也主要以上述种类植物为主,尤其对垂穗披碱草的利用率最高[4]。孙永芳等[25]的研究表明丛枝菌根显著提高了垂穗披碱草的含氮量,而门源草原毛虫幼虫生长速率和其食物含氮量成正比[18]。这可以解释本试验中丛枝菌根抑制对于增温对门源草原毛虫幼虫生长速率正向效应的减弱。然而,在未增温条件下,丛枝菌根抑制对门源草原毛虫幼虫食物氮含量的降低并未引起其生长速率的变化。这可能是因为增温加快了门源草原毛虫幼虫的代谢速率进而使得其对食物质量的要求提高[1],因此增温条件下丛枝菌根抑制所造成食物质量的降低对其影响较为显著,而在未增温条件下,尽管植物含氮量因丛枝菌根抑制而有所降低,但仍然足以满足门源草原毛虫幼虫维持其正常的生长速率。此外,在研究中,雌雄个体的蛹重对丛枝菌根抑制处理表现出不同程度的响应,在增温条件下,雌蛹重量因丛枝菌根的抑制而明显降低,而雄蛹未表现出这一趋势。这可能是由于门源草原毛虫雌性个体的幼虫发育历期较雄性幼虫个体多了一个龄期,而且末龄幼虫的生长速率在雌性性别间的差异更加明显,这就使得在同样的处理下,雌虫的体重更容易比雄虫发生变化,曹慧[18]的研究结果也表明在放牧作用下门源草原毛虫雌蛹重量的增大比率是雄蛹重量的两倍。
综上,增温有利于门源草原毛虫幼虫的生长发育,表现为能够提高其生长速率及蛹重,提前其蛹化时间,扩大其雄性先熟现象及性二型性。丛枝菌根对于门源草原毛虫的影响并不明显。增温扩大了丛枝菌根抑制对门源草原毛虫幼虫生长速率的不利影响。
致谢:感谢青海师范大学屈柳燕博士和陕西师范大学郭成龙硕士在野外试验过程中给予的帮助。

