β-环糊精修饰Mn-ZnS量子点荧光探针用于检测血液中对乙酰氨基酚
曾燕艳, 王玥婷, 梁志辉, 焦 哲, 范洪波
(东莞理工学院 生态环境与建筑工程学院,广东 东莞 523808)
1 引 言
对乙酰氨基酚(Acetaminophen,ACOP)是一种具有解热镇痛功效的酰胺类药物,被广泛应用于医疗领域。但是,对乙酰氨基酚对人体有一定的毒副作用,过多服用可致肝肾衰竭[1-2]。因此,对对乙酰氨基酚含量的检测方法研究,对生理功能和临床应用都具有重要的意义。现行的药品标准中对对乙酰氨基酚的测定方法是重氮化的外指示剂法,该方法步骤繁琐、终点不易掌握。据报道,不少学者开发了新型的对乙酰氨基酚的测定方法,郭波等[3]采用液相色谱-质谱串联法对小鼠血浆中对乙酰氨基酚进行定量分析,检测范围为0.2~10.0 μg/mL。王书民等[4]利用对乙酰氨基酚在碱性介质下对CdS量子点-高锰酸钾-鲁米诺化学发光体系强烈的抑制作用,建立了对药物中对乙酰氨基酚的流动注射化学发光测定法,其借助发光信号对对乙酰氨基酚的含量进行定量分析。刘益庆等[5]建立了测定小儿氨酚烷胺颗粒中对乙酰氨基酚含量的高效液相蒸发发光法(HPLC-ELSD),该方法在浓度为2.017~10.084 mg/mL范围内呈现良好的线性关系。Beitollahi等[6]利用石墨烯和乙基-(4-二茂基-[1,2,3]咪唑)醋酸盐修饰碳糊电极,利用该电极建立了快速测定对乙酰氨基的电化学法,其测定浓度为75.0~900.0 μmol/L。Kim等[7]采用两步活化法(ZnCl2-KOH)对以海藻为原料的活性炭进行修饰,制备出一种新型的电极材料,用于测定人体中对乙酰氨基酚的含量,其检出限为0.004 μmol/L。Menon等[8]提出了一种简单可靠的基于分子印迹聚合物的伏安法测定药物中的对乙酰氨基酚。以对乙酰氨基酚为模板分子制备出分子印迹聚合物,通过电聚合的方式将MIP修饰到AuNPs改性的金电极表面,增大传感器的电信号,从而提高其选择性和灵敏度。研究结果表明,该方法的电信号值在对乙酰氨基酚的浓度为4.5×10-5~5.0×10-7mol/L范围内呈现良好的线性关系。Arif等[9]将β-环糊精修饰到多壁碳纳米管上,增强纳米管的比表面积和亲水性,再将其涂抹到玻璃碳电极上,制备出MWCNT-βCD/GCE,用于测定水体中对乙酰氨基酚的含量,其线性响应范围为50 nmol/L~300 μmol/L。Cao等[10]用两步合成法制备出CeBiOx纳米纤维电极,采用循环伏安法和差士脉冲伏安法,对止痛剂中的对乙酰氨基酚含量进行测定,其检出限为0.2 μmol/L。综上所述,目前对乙酰氨基酚的常用检测方法主要有高效液相色谱法[11]、化学发光法[12]和电化学法[13-14]等,这些方法虽然简便快速、灵敏度高,但其检测主要针对药物中对乙酰氨基酚的含量,且检测范围主要是微克级别,对于更低含量的对乙酰氨基酚存在局限性。本研究基于对乙酰氨基酚对量子点的荧光猝灭机理,建立一种简便快捷、灵敏度高、对对乙酰氨基酚进行痕量分析的新方法。
量子点由于其独特的光学性质和较好的生物相容性,被广泛应用于化学、电子和生物传感领域,如用于离子检测[15]、分子识别[16]和免疫分析[17]等。本研究合成了具有良好荧光特性和水溶性的乙二胺-环糊精修饰的Mn-ZnS量子点(EN-β-CD-QDs),并利用合成的EN-β-CD-QDs建立一种简单有效的对乙酰氨基酚(ACOP)检测方法。EN-β-CD-QDs的合成以L-半胱氨酸(L-Cys)为桥梁,将乙二胺-环糊精修饰到量子点表面。以EN-β-CD-QDs作为荧光探针,利用其表面修饰的β-环糊精对ACOP进行包合,ACOP与EN-β-CD-QDs的表面发生电子转移过程进而使EN-β-CD-QDs的荧光猝灭,基于这一原理建立ACOP的荧光检测方法。
2 实 验
2.1 试剂与仪器
实验试剂包括:β-环糊精(β-CD)(国药集团化学试剂有限公司)、对甲苯磺酰氯(TsCl)(99%,上海麦克林生化科技有限公司)、L-半胱氨酸(L-Cys)(99%,上海麦克林生化科技有限公司)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)(98.5%,上海麦克林生化科技有限公司)、N-羟基琥珀酰亚胺(NHS)(98%,上海麦克林生化科技有限公司)、对乙酰氨基酚(ACOP)(98.5%,北京百灵威科技有限公司)、醋酸锰(天津市大茂化学试剂厂)、醋酸锌(天津市大茂化学试剂厂)、硫化钠(天津市大茂化学试剂厂)、乙醇(天津市大茂化学试剂厂)、乙二胺(天津市富宇精细化工有限公司)、NaOH(天津市大茂化学试剂厂)、丙酮(天津市大茂化学试剂厂)。实验所用的试剂除特别注明外均为分析纯,实验用水为二次蒸馏水。
样品的晶体结构利用Ultima-IV型X射线衍射仪(XRD)(布鲁克(北京)科技有限公司)进行分析验证。粒子的形貌利用Tecnai F30型透射电子显微镜(TEM)(美国FEI公司)和JSM-6701F型扫描电子显微镜(SEM)(日本电子株式会社)观察。样品的荧光光谱利用UVD170U型紫外-可见分光光度计(Dionex Softron GmbH)和F-4500型荧光分光光度计(日立仪器(上海)有限公司)测得。
2.2 EN-β-CD-QDs的合成
2.2.1 L-Cys-Mn掺杂ZnS量子点的合成
在三口烧瓶中依次加入0.096 96 g L-Cys、50 mL H2O、1.5 mL 0.02 mol/L醋酸锰和5 mL 0.2 mol/L醋酸锌,搅拌溶解后,用2.0 mol/L NaOH溶液调节pH=11。在氮气保护下逐滴加入5 mL 0.3 mol/L硫化钠溶液,并搅拌30 min。得到的混合溶液于50 ℃下陈化2 h,冷却至室温。然后用无水乙醇析出沉淀,离心后取沉淀,用无水乙醇洗涤3次以去除杂质。最后于50 ℃条件下真空干燥12 h。
2.2.2 EN-β-CD的合成
称取30.0 gβ-CD 和7.8 g TsCl置于720 mL去离子水中,搅拌2~3 h。然后加入120 mL 2.5 mol/L的NaOH,继续搅拌30 min,过滤,收集滤液,并将滤液倒入36.0 g NH4Cl中,放入冰箱静置12 h后,过滤得到白色固体,重结晶操作3次后得到亮白色晶体。最后置于50 ℃真空条件下干燥12 h,得到白色粉末,记为Mono-6-OTs-β-CD。
取3.0 g Mono-6-OTs-β-CD溶于20 mL无水乙二胺中,在氮气氛围下,升温至80 ℃,持续搅拌反应4 h。反应结束后采用减压蒸发去除溶剂,将残余反应液逐滴加入丙酮中,得到白色沉淀,收集沉淀溶于少量水中,再将水溶液逐滴加入丙酮,反复多次得到较纯的白色沉淀,收集沉淀于40 ℃真空下干燥7 h,得到最终产物EN-β-CD。
2.2.3 EN-β-CD修饰ZnS量子点
称取20 mg L-Cys-Mn掺杂ZnS量子点溶于20 mL PBS缓冲液中,加入10 mg EDC和10 mg NHS,搅拌30 min以活化。然后加入100 mg EN-β-CD,继续搅拌5 h。用适量无水乙醇洗出环糊精量子点,离心分离,去掉清液,反复用少量无水乙醇洗涤沉淀,得到较纯产物,最后于50 ℃真空下干燥12 h。
2.3 荧光检测
分别配制0.01 mg/mL的EN-β-CD-QDs溶液和0.01 mg/mL的对乙酰氨基酚溶液。取100 μL对乙酰氨基酚溶液,加入到10 mL EN-β-CD-QDs溶液中,超声震荡30 min,于25~45 ℃水浴条件下反应5~45 min,在激发波长为300 nm,发射波长为310~740 nm,入射狭缝为5 nm、出射狭缝为5 nm的条件下进行荧光测定。
3 结果与讨论
3.1 EN-β-CD-QDs的结构表征
图1(a)是EN-β-CD和β-CD的红外光谱图。由图可知,3 381,2 927,1 080 cm-1附近的峰证明了—OH、—NH、—CH和—CN的存在,而EN-β-CD中815 cm-1的苯环基团的吸收峰已消失,说明对甲苯磺酰基已经被乙二胺所取代,得到的产物为EN-β-CD[18]。此外,946,1 028,1 158 cm-1附近出现β-CD的特征吸收峰,分别代表 α-(1, 4)糖苷键的骨架振动、C—C/C—O 键耦合振动峰和C—O—C 键伸缩振动峰,表明EN-β-CD保留了β-CD 分子的空腔结构[19]。
图1(b)是 EN-β-CD-QDs 和 L-Cys-QDs 的红外光谱图。通过对比修饰前后的量子点红外光谱图可知,1 029,1 154 cm-1处分别出现C—C/C—O 键耦合振动峰和C—O—C 键伸缩振动峰,为β-CD 结构的特征峰,1 080 cm-1左右的是C—N振动吸收峰,2 930 cm-1处的吸收峰是C—H的伸缩振动。其位置峰值大概重复于β-CD,说明环糊精已经成功修饰到了量子点上。
由图1(c)EN-β-CD-QDs的透射电镜(TEM)表征结果可知,EN-β-CD-QDs 呈现单分散排列,形状为球形,粒径分布均匀。EN-β-CD-QDs 的X射线衍射(XRD)表征结果如图1(d)所示。由图可知,2θ=28.76°,47.35°,57.20°处的3个衍射峰与ZnS立方闪锌矿晶型的(111)、(220)、(311)晶面相对应,而且没有看到其他的衍射峰,说明合成的产物有闪锌矿结构的ZnS晶型且纯度较高,修饰上去的环糊精并不影响ZnS量子点的晶型。
由图1(e)紫外吸收光谱可知,对乙酰氨基酚(APAP)在250 nm附近有较强的紫外吸收,EN-β-CD-QDs 在300 nm处有紫外吸收。但是,EN-β-CD-QDs 在300 nm的激发波长下的荧光光谱(图1(f))与对乙酰氨基酚的紫外吸收光谱没有重叠部分,故两者的发光机理不存在荧光共振能量转移(FRET)。
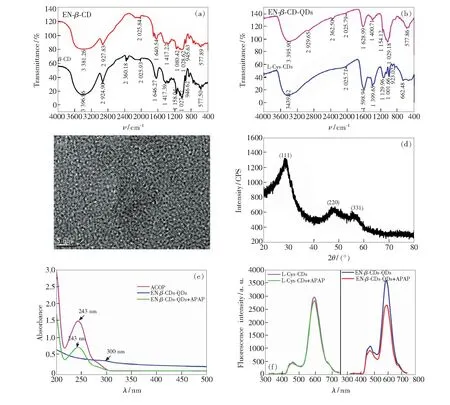
图1 EN-β-CD-QDs的表征。(a)EN-β-CD和β-CD的红外光谱;(b)EN-β-CD-QDs 和 L-Cys-QDs 的红外光谱;(c)EN-β-CD-QDs的透射电镜图;(d)EN-β-CD-QDs 的X射线衍射谱;(e)紫外吸收光谱;(f)L-Cys-QDs和EN-β-CD-QDs的荧光发射光谱,λ=300 nm。
Fig.1 Characterization of EN-β-CD-QDs. (a)FT-IR of EN-β-CD andβ-CD.(b) FT-IR of EN-β-CD-QDs and L-Cys-QDs. (c) TEM image of EN-β-CD-QDs. (d) XRD of EN-β-CD-QDs. (e) UV absorption spectra of EN-β-CD-QDs, APAP and their mixture. (f) Fluorescence spectra of L-Cys-QDs(left) and EN-β-CD-QDs(right), excited atλ=300 nm.
图1(f)分别是L-Cys-QDs和EN-β-CD-QDs在激发波长为300 nm下的荧光发射光谱。由图可知,未经过环糊精修饰的L-cys-ZnS量子点加入对乙酰氨基酚前后荧光强度没有明显的变化,而经过β-CD修饰后的EN-β-CD-QDs与对乙酰氨基酚反应,有明显的荧光强度降低,这说明EN-β-CD-QDs对于对乙酰氨基酚具有更强的识别作用。
3.2 检测条件优化
3.2.1 水浴反应时间
取100 μL 0.01 mg/mL的对乙酰氨基酚溶液分别加入到10 mL 0.01 mg/mL的EN-β-CD-QDs溶液中,分别水浴反应5,15,25,35,45 min,取适量的反应混合溶液检测其荧光强度,结果如图2所示。随着反应时间的延长,EN-β-CD-QDs与对乙酰氨基酚相互作用的荧光强度逐渐下降,当反应时间大于35 min时,荧光强度趋于稳定,说明两者反应基本完全,故实验以35 min作为最佳水浴反应时间。

图2 水浴反应时间对荧光强度的影响
Fig.2 Influence of reaction time on the fluorescence intensity
3.2.2 水浴反应温度
水浴反应时间为35 min,改变水浴反应温度为25,30,35,40,45,50 ℃,考察反应温度对荧光强度的影响。当加入目标物对乙酰氨基酚后(图3),温度为40 ℃时,溶液的荧光强度降到最低,基于对乙酰氨基酚与EN-β-CD-QDs发生电子转移、引起荧光猝灭现象、进而降低荧光强度的机理,本实验选择40 ℃作为最佳水浴反应温度。
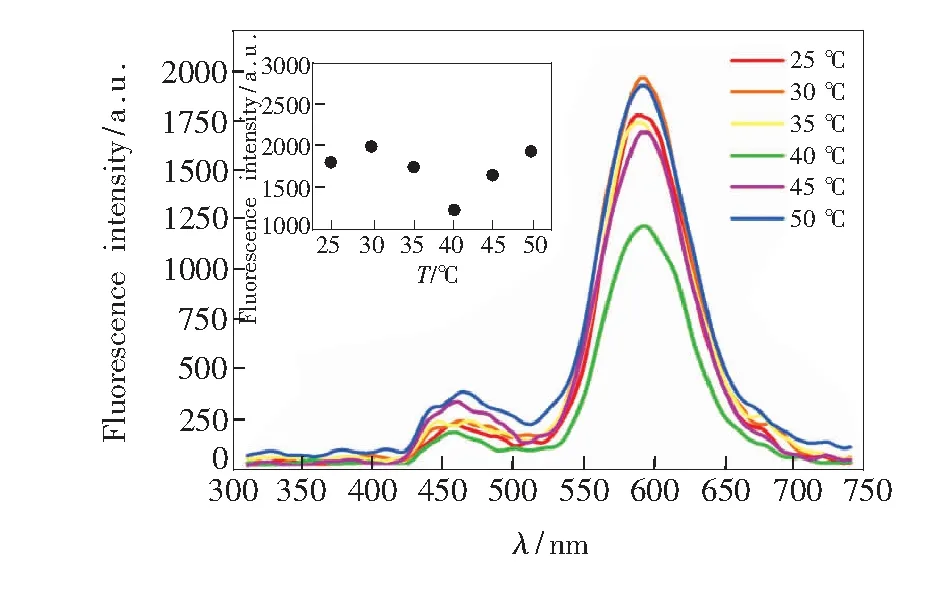
图3 反应温度对荧光强度的影响
Fig.3 Influence of reaction temperature on the fluorescence intensity
3.3 对乙酰氨基酚的检测
以300 nm作为EN-β-CD-QDs的激发波长,在310~740 nm 的发射波长条件下考察EN-β-CD-QDs的荧光强度随对乙酰氨基酚浓度的变化(图4)。对乙酰氨基酚在一定浓度范围能够线性猝灭EN-β-CD-QDs的荧光,据此建立EN-β-CD-QDs检测对乙酰氨基酚的方法。在最佳条件下,EN-β-CD-QDs对对乙酰氨基酚的检测结果表明,在浓度为1~100 ng/L的范围内呈现良好的线性关系,其相关系数R2=0.997 6,检出限为0.64 ng/L,RSD为1.69%(n=11)。
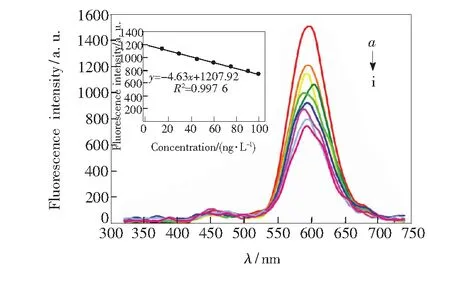
图4 对乙酰氨基酚对EN-β-CD-QDs荧光强度的影响(a~i: 0,1,15,30,45,60,75,90,100 ng/L)
Fig.4 Fluorescence spectra of EN-β-CD-QDs to various acetaminophen concentrations (a-i: 0, 1, 15, 30, 45, 60, 75, 90,100 ng/L). Inset: resulting calibration curve.
3.4 荧光猝灭机理分析
量子点检测目标物的发光原理主要可以分为荧光共振能量转移原理(FRET)和电子转移原理(ET)两类。经过实验证明,对乙酰氨基酚对EN-β-CD-QDs的荧光猝灭并不是由FRET引起的。由图1(e)和1(f)可以明显看出对乙酰氨基酚紫外吸收光谱与EN-β-CD-QDs荧光发射光谱之间不存在任何重叠区域,说明二者不具备发生荧光共振能量转移的条件。有研究表明[20],β-CD同时具有亲水的外表面和强烈的疏水内腔结构,既可以很好地保持EN-β-CD-QDs的水溶性,又可以对客体分子进行包合。对乙酰氨基酚是一种良好的电子受体,其作为疏水客体可以被β-CD包合,进入空腔后与量子点发生电子转移,致使量子点的荧光发生猝灭。
对乙酰氨基酚对EN-β-CD-CDs的荧光猝灭机理详见图5。

图5 β-环糊精修饰量子点对ACOP的检测机理
3.5 血液样品的检测
取50 mL人体血液样品,溶于水中,超声30 min,离心过滤,取滤液定容至50 mL。测定时逐级稀释,按照实验方法,对血样中的对乙酰氨基酚进行检测,测得血样中对乙酰氨基酚的含量为0.664 8 μg。为检验方法的可靠性,同时进行加标回收实验,结果见表1。

表1 样品检测与回收率测定(n=5)
4 结 论
采用β-CD与乙二胺在碱性条件下反应,合成了水溶性好的乙二胺-β-环糊精(EN-β-CD),再将EN-β-CD修饰到L-Cys掺杂的Mn-ZnS量子点表面,制备出具有良好的荧光特性和水溶性并能很好地溶解在水溶液中的乙二胺-环糊精-ZnS量子点材料(EN-β-CD-QDs)。利用EN-β-CD-QDs作为荧光探针对水体中对乙酰氨基酚进行检测,成功建立了对乙酰氨基酚的荧光检测分析方法。在实验过程中,考察了反应时间和反应温度等因素对对乙酰氨基酚检测的影响。结果表明,在反应时间为35 min、反应温度为40 ℃的条件下,对乙酰氨基酚在1~100 ng/L的浓度范围呈现良好的线性关系,检出限达到0.64 ng/L。

