CeO2/Bi2MoO6纳米复合材料的制备及其增强光催化降解性能研究
王书红, 刘新, 孔斌, 卢家伟, 李鸿, 刘烈泉,王津津, 陈娟, 黄微雅
(江西理工大学冶金与化学工程学院,江西 赣州341000)
近年来,随着工业的快速发展,工业废水的处理成为突出问题[1].工业废水成分复杂,往往涉及多种有机、无机污染物,例如:偶氮染料、酚类(包括苯酚[2]、4-氯苯酚[3]、二硝基酚[4]、双酚 A[5]等)以及重金属污染物等.其中,有机污染物往往浓度高且难降解[6],直接排放将对水环境生态系统造成严重影响,甚至威胁人类健康[7,8].因此,如何有效处理工业废水中的有机污染物是当前环境领域的热点问题.
目前,工业废水处理方法包括吸附、膜处理技术、电化学处理、活性污泥法、离子交换和光催化等[9-16].其中,光催化技术能够充分利用太阳能将废水中的有机污染物降解为CO2和H2O等无机小分子,具有效率高、无二次污染等优点,被认为是一种绿色的技术,在化学、材料、能源、环境方面备受关注[17-25].在半导体光催化材料中,铋(III)基半导体受到了研究者的极大关注,如其中,Bi2MoO6(BMO)的带隙能[32](2.6~2.8 eV)相比传统的半导体材料如:TiO2更窄,因而,能够利用太阳光中的可见光而备受关注.但是,纯BMO光催化剂存在光生电子-空穴极易复合的缺点,导致其光催化活性不高,从而限制了其在光催化降解废水中污染物方面的应用.将BMO与其它半导体复合构建异质结是降低其电子-空穴对复合率的有效手段.根据近期的研究报道,CeO2是一种良好的可见光催化剂,具有优异的光催化活性、无毒性和高耐久性[33-37].尤其值得一提的是,CeO2可以作为一种高效的助催化剂来提升复合光催化剂的活性[38].因此,通过构建CeO2和BMO异质结获得CeO2/BMO纳米复合材料,有望提高其对污水中有机污染物的光催化降解效率.Li等[39]采用溶剂热法合成了具有花状微结构的CeO2/BMO复合材料,并研究了其在可见光下的光催化降解活性.研究发现,具有最优化组成的CeO2/BMO复合材料在光催化反应75 min后对RhB的降解效率可达100%,远超过相同实验条件下CeO2(26.8%)和 BMO(80.3%)的光催化降解效率.然而,水热法合成CeO2/BMO复合材料及其光催化活性的研究尚未见报道.
文中通过水热法合成了一系列不同CeO2/BMO纳米复合材料,考察了pH值以及Ce/Bi摩尔比对所制备的复合材料光催化活性的影响.在实验室模拟太阳光条件下(300 W 氙灯),分别以RhB、MB和苯酚为污染物模型,分别研究和比较所制备CeO2/BMO纳米复合材料的增强光催化降解活性,并探讨其光催化降解机理.
1 实验部分
1.1 化学试剂
Ce(NO3)2·6H2O(AR,西陇化工股份有限公司),尿素(AR,上海展云化工有限公司),乙醇、乙二醇、丙三醇、浓氨水、Bi(NO3)3·5 H2O(AR,阿拉丁),浓硝酸、柠檬酸、钼酸铵(AR,上海国药集团).
1.2 催化剂的制备
CeO2纳米颗粒的制备参考文献[40]方法,具体的实验过程如下:称量 1.00 g Ce(NO3)2·6 H2O 与 0.50 g尿素,溶解于20.00 mL乙醇-丙三醇混合水溶液中(乙醇:丙三醇:水的体积比为 5∶5∶10).搅拌 30 min 后置于高压反应釜中,170℃保温6 h.产物冷却至室温后取出抽滤,并用蒸馏水清洗直至滤液的pH=7.收集固体颗粒,90℃干燥2 h,350 ℃煅烧4 h,所得到的产物即为CeO2纳米颗粒.
CeO2/BMO复合材料合成采用改进文献[41]方法.具体实验步骤如下:称量 1.07 g Bi(NO3)3·5H2O 溶解在 62.50 mL HNO3(浓硝酸与水体积比 1∶10)溶液中,然后加入0.59 g钼酸铵,将混合物在40℃下加热并剧烈搅拌.加入一定量的CeO2纳米颗粒(Ce/Bi摩尔比3%、5%和10%)和2.03 g柠檬酸,用浓氨水调节溶液pH至6.然后,加入1.75 mL乙二醇,80℃继续磁力搅拌2 h,随后将溶液转移到100 mL聚四氟乙烯反应釜内,在150℃下反应8 h.待产物自然冷却至室温后抽滤,分别用蒸馏水和无水乙醇对样品洗涤至中性,60℃干燥过夜.400℃煅烧4 h(升温速度为5℃/min)后获得复合材料,样品记为x CeO2/BMO,其中x为Ce/Bi摩尔比,分别对应为3%、5%和10%.
作为对照,纯钼酸铋的制备方法同上,只是没有加入 CeO2纳米颗粒.并且,分别在pH=2~9的条件下,考察了pH值对纯钼酸铋晶型的影响.
1.3 催化剂的表征
采用FEI公司FEG-250型扫描电子显微镜(SEM)观察样品的形貌;用Rigaku公司D/max-2500型X射线衍射仪(XRD)分析样品的晶相结构,其中,辐射源为Cu阳极靶,Kα射线,波长为λ=0.154 18 nm,测试电压为40kV,测试电流为40mA,扫描速率为5°/min.用美国麦克仪器公司ASAP2020型物理吸附仪,测定样品的比表面积.用日本日立F-4500型荧光光谱仪测定样品的光致发光光谱,扫描范围为200~700 nm.用Nicolet-470型红外光谱仪(FTIR)测样品的红外光谱,样品以KBr为底物做成压片.用日本岛津UV-2550型紫外可见分光光度计进行紫外可见漫反射(UV-Vis DRS)测试,以 BaSO4作为参比,扫描范围200~800 nm.光电流的测试用三电极电化学工作站(CHI-660E,China),0.10 mol/L Na2SO4饱和溶液作为电解质,Ag/AgCl电极和 Pt电极分别作为参比电极和辅助电极.
1.4 光催化性能评价
光催化实验以300 W的氙灯作为光源模拟太阳光.具体实验过程如下:称量0.08 g催化剂分散于 80 mL,10 mg/L的RhB、MB和苯酚水溶液中.光催化反应前,悬浮液在黑暗中磁力搅拌30 min以达到催化剂对染料的吸附-脱附平衡.实验过程中使用循环冷却以保持光催化反应温度维持在室温.每间隔10 min,取3~4 mL混合液,在高速离心机中离心20 min(9 000 r/min)后取上层清液测定染料的吸光度.降解率 η 计算公式为:η=(C0-Ct)/C0×100%,其中 C0、Ct分别为染料的初始浓度与不同时间时的浓度.
2 结果与讨论
2.1 X-射线衍射(XRD)、比表面积(BET)和 SEM
分析
图1所示为所制备样品的XRD图.从图1(a)中可见,不同pH条件下所制备的BMO样品在衍射角2θ为 10.88°、28.44°、33.20°、36.26°、46.91°、56.4°和58.79°处出现衍射峰,分别对应四方晶系Bi2MoO6(JCPDF No.21-102)的(020)、(131)、(002)、(202)、(133)和(262)晶面.当 pH=2 ~ 6 时,随着 pH 的升高,BMO的特征衍射峰(131)晶面的衍射峰强度逐渐增强,而pH值进一步增大时,其衍射峰的强度又有所降低.其中pH=6时,(131)晶面的衍射峰的强度最高,半峰宽最小,且峰最尖锐,呈现出最好的结晶度[42].从图1(b)中,除钼酸铋的衍射峰外,还可以观察到在 33.2°、56.4°处分别出现 CeO2的衍射峰,对应CeO2的 (200)和(311)晶面.表明 CeO2/Bi2MoO6复合材料被成功合成.
图2所示为BMO和5%CeO2/BMO复合材料的SEM图.从图2中可见,纯BMO的晶体形貌为细针状,复合CeO2后,5%CeO2/BMO复合材料的形貌为厚片状.
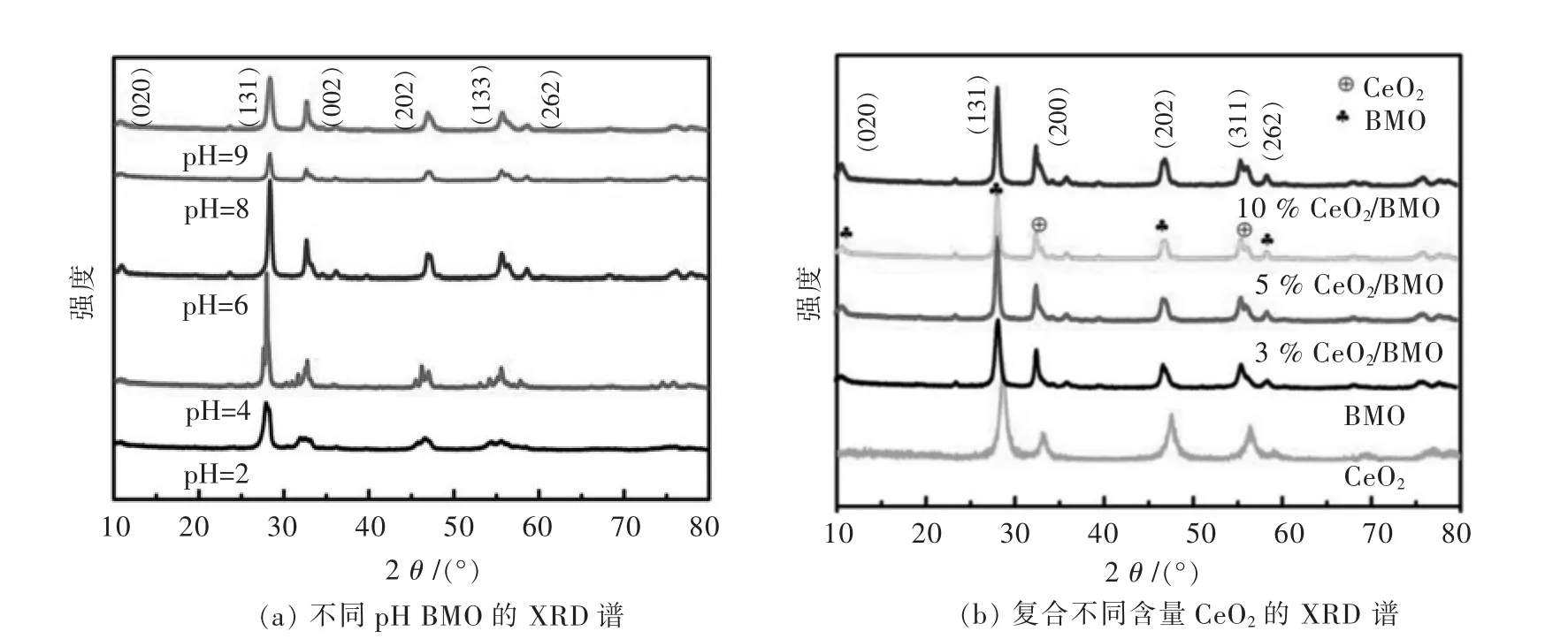
图1 样品的XRD谱Fig.1 XRD patterns of the samples

图2 样品的SEM像Fig.2 SEM images of the samples
此外,根据比表面积测试结果,纯BMO的比表面积为4.16 m2/g,复合CeO2后形貌为厚片状,比表面积减小、晶体颗粒增大.复合材料3%CeO2/BMO、5%CeO2/BMO和10%CeO2/BMO的比表面积分别为 3.36 m2/g、2.21 m2/g 和 3.58 m2/g.
2.2 傅里叶红外光谱分析 (FTIR)
图 3 所示为 3%CeO2/BMO、5%CeO2/BMO、10%CeO2/BMO复合材料和BMO样品的FTIR谱图.从图3中可见,纯BMO样品在840 cm-1和797 cm-1处出现吸收峰,对应MoO6八面体中的Mo-O键的伸缩振动.449 cm-1处的吸收峰对应为Bi-O的伸缩振动和形变振动模式,而586 cm-1附近的峰对应Mo-OBi的振动[43-45].xCeO2/BMO复合材料的FTIR图谱中分别出现BMO的上述吸收峰,说明样品中存在Bi2MoO6,进一步证实了XRD分析结果.
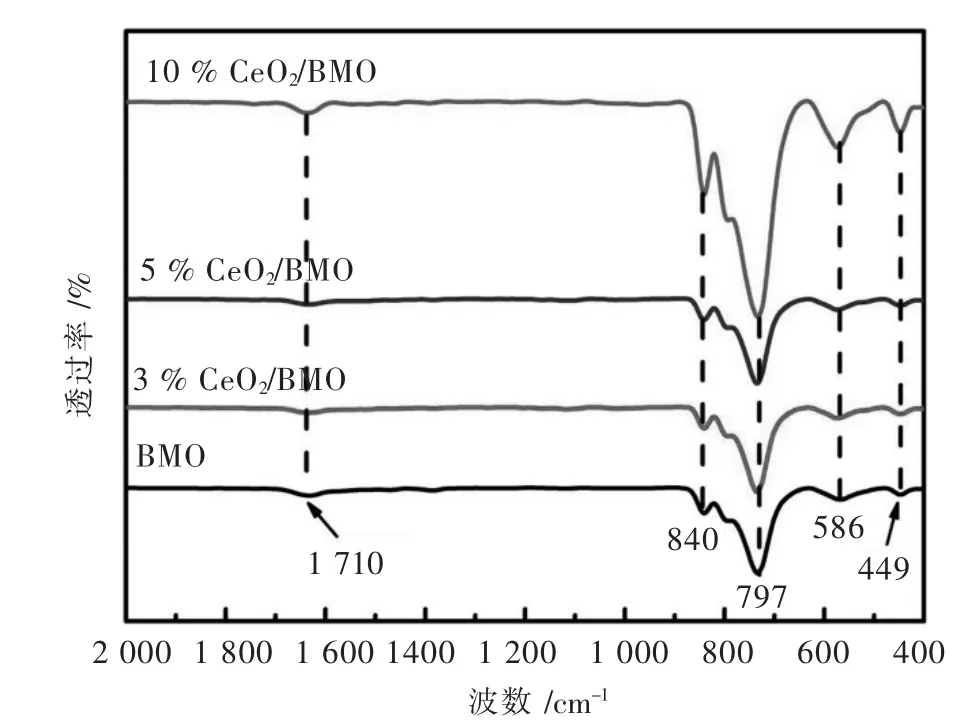
图3 xCeO2/BMO和BMO样品的FTIR谱Fig.3 FTIR spectra of xCeO2/BMO composites and BMO samples
2.3 紫外-可见漫反射吸收光谱分析 (UV-Vis DRS)

图4 样品的UV-Vis DRS谱Fig.4 UV-Vis DRS spectra of Samples
图 4所示为CeO2、BMO和5%CeO2/BMO复合材料UV-Vis DRS谱图.从图4中可见,纯BMO的吸收边缘在475.09 nm附近,对应带隙能为2.61 eV表明BMO在可见光区具有光吸收.当复合5%CeO2后,所制备5%CeO2/BMO复合材料的吸收边呈现红移,说明复合材料对可见光具有增强光吸收性能.根据半导体的光吸收阀值与带隙能公式:Eg=1240/λg,所制备样品的带隙能如表1所列.由表1可见,BMO、CeO2带隙能分别为2.61 eV和2.00 eV,3%CeO2/BMO、5%CeO2/BMO 和 10%CeO2/BMO复合材料的带隙能先从2.39 eV降低到1.50 eV,再增加到2.44 eV.可见,通过调节Ce/Bi摩尔比,复合材料的带隙能在一定范围内具有可调控性.其中,5%CeO2/BMO复合材料的带隙能最低.
2.4 光致发光谱(PL)
图 5所示为样品 BMO、3%CeO2/BMO、5%CeO2/BMO、10%CeO2/BMO在激发波长为 320 nm下得到的光致发光(PL)谱图.PL发射峰的强弱可以反映光生载流子的复合几率,强度越弱表明光生电子-空穴复合的几率越低[46].从图5可见,所测样品的发射峰在480 nm左右,强度次序:BMO>10%CeO2/BMO>3%CeO2/BMO>5%CeO2/BMO.可见样品 5%CeO2/BMO具有最低的光生电子-空穴复合几率,有利于其光催化活性的提高.

表1 样品的带隙能Table 1 Band-gaps of the samples
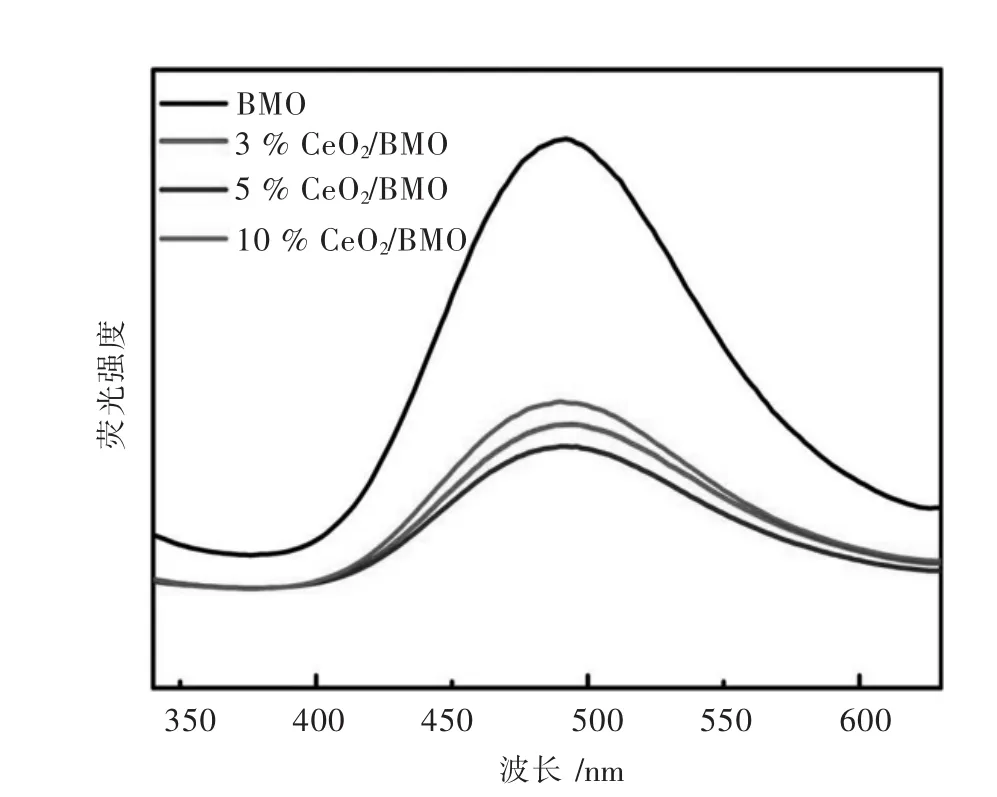
图5 样品的PL图Fig.5 PL spectra of samples
2.5 光电流分析
为了进一步揭示光生电子-空穴的分离与转移情况,对样品进行光电流测试,如图6所示.一般而言,光电流响应强度越强,意味着半导体催化剂的光生电子转移效率越高[47].从图6可见,复合CeO2之后,复合材料的光电流强度增强,其增强顺序为:BMO<10%CeO2/BMO<3%CeO2/BMO<5%CeO2/BMO.可见,当CeO2的复合量为5%时,复合材料5%CeO2/BMO的光电流最强,因而,其光电子转移效率最高,有利于光催化活性的提高.其原因可能是,CeO2可以承担电子俘获中心的作用,BMO在光激发后产生的电子可以有效转移到CeO2上,从而极大提高光生电子转移效率,降低电子-空穴的复合.光电流的结果与PL的结果一致.

图 6BMO、3%CeO2/BMO、5%CeO2/BMO、10%CeO2/BMO样品的光电流Fig.6 Photocurrent measurements of BMO、3%CeO2/BMO、5%CeO2/BMO、10%CeO2/BMO
2.6 光催化性能测试
图7所示为不同pH条件下所合成的BMO样品对RhB的光催化降解性能对比.从图7中可见,pH=6时,所制备的样品BMO在光照60 min后,对RhB的降解率为49.06%,高于其他pH条件下制备的BMO(5.91% ~44.46%).
图8所示为催化剂对不同染料光催化降解图及其动力学拟合图.从图8中可见,5%CeO2/BMO复合材料在光催化降解RhB、MB和苯酚中具有最高的催化活性(图 8(a)~图 8(c)).当光照 60 min 时,5%CeO2/BMO对RhB、MB和苯酚的降解率分别为90.01%、62.80%和35.20%,高于3%CeO2/BMO (69.19%、45.93%和26.79%)和10%CeO2/BMO (16.32%、40.38%和22.61%)复合材料,并且远高于纯BMO(49.06%、43.75%和 8.71%).此外,5%CeO2/BMO对RhB、MB和苯酚的降解率相应的光催化反应的速率常数分别为0.037 0 min-1、0.016 4 min-1和0.007 2 min-1(图 8 (d)~图 8 (f)), 相对于纯的 BMO 分别提高了3.19倍、1.70倍和4.58倍 (具体数据见表2).可见,当在BMO表面复合适当量的CeO2后,所形成的复合材料的光催化活性能够明显提升.

图7 不同pH条件下所合成BMO对RhB的光催化降解性能对比Fig.7 Photocatalytic degradation of RhB B by the samples of different pH BMO
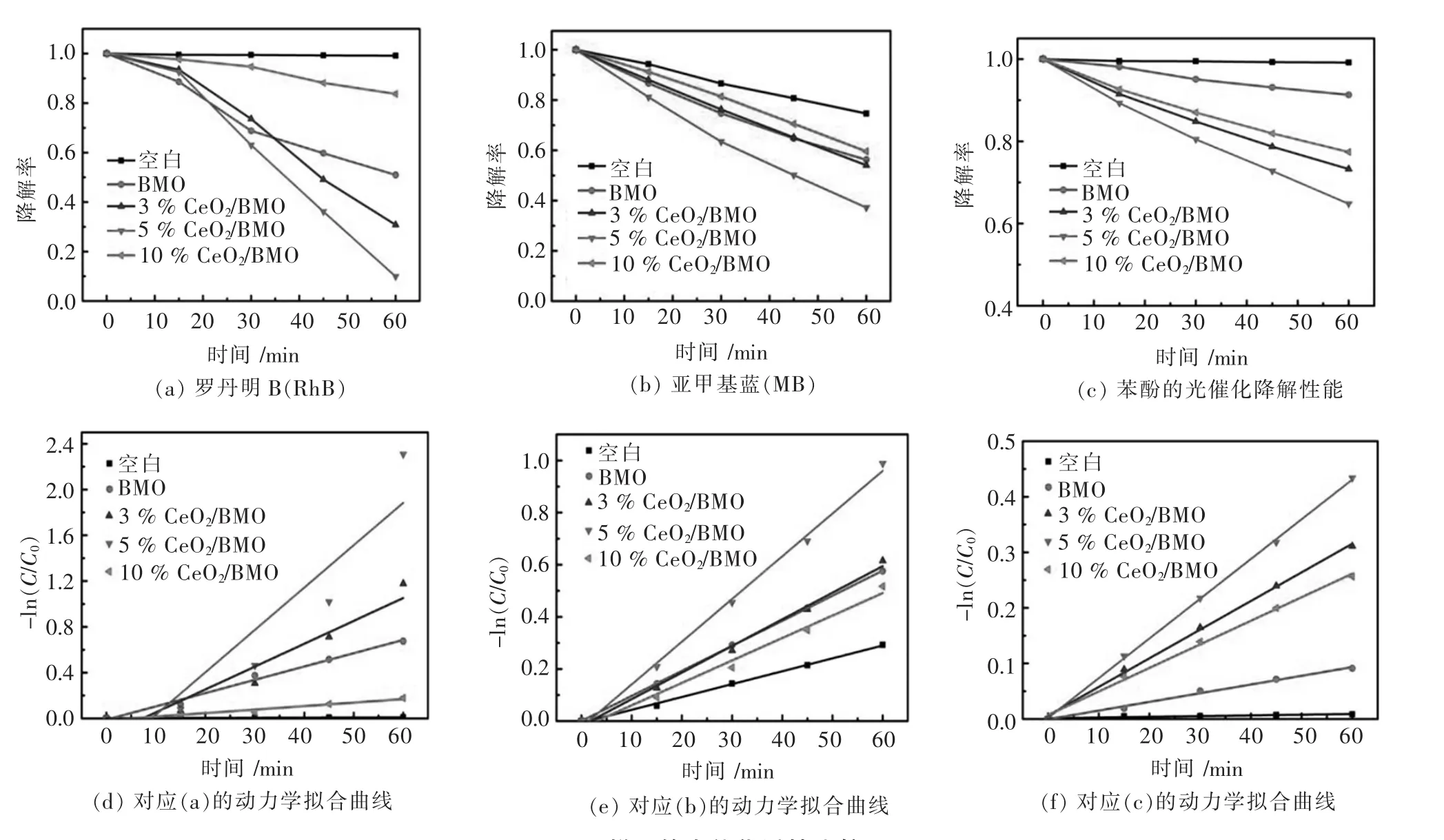
图8 样品的光催化活性比较Fig.8 Photocatalytic activity comparison of samples Photocatalytic degradation of(a) RhB,(b) MB,(c) phenolby the differert samples;Degradation kinetics of (d)RhB, (e)MB ,(f) Phenol
图9所示为5%CeO2/BMO纳米复合材料的自由基捕获实验.采用乙二胺四乙酸 (EDTA)、对苯醌(BZQ)和叔丁醇 (TBA)作为空穴(h+)、超氧自由基(·O2-)和羟基自由基(·OH)的捕获剂[48-50].从图 9 可见,当不加捕获剂时,5%CeO2/BMO对RhB的降解率为90.01%,而加入EDTA、TBA和BZQ后其对RhB的降解率分别为62.13%、23.16%和7.62%.可见,所对应活性物质对光催化的影响程度的大小顺序为:·O2->·OH>h+.其中,加入BZQ后,对其降解的抑制作用最明显,说明·O2-是RhB光催化氧化降解的主要活性物种,跟文献报道的其他钼酸铋复合材料一致[51-52].
5%CeO2/BMO复合材料的增强光催化降解机理如图10所示.在模拟太阳光照射下,CeO2/BMO复合材料光催化剂中的CeO2和BMO都能够被激发产生光生电子.根据文献[39],BMO的导带、价带位置均略高于CeO2的导带和价带位置.因而,当CeO2和BMO形成异质结时,BMO导带上的光生电子容易转移到CeO2导带上,而CeO2价带上的h+能够转移到BMO的价带上,从而使得电子-空穴有效分离,从而提升其光催化降解活性.复合材料表面的光生电子能够与溶液中的溶解氧反应生成·O2-,而表面的h+可能与 OH-反应生成·OH.所生成的·O2-、·OH 以及 h+作为活性物质参与RhB的光催化降解.
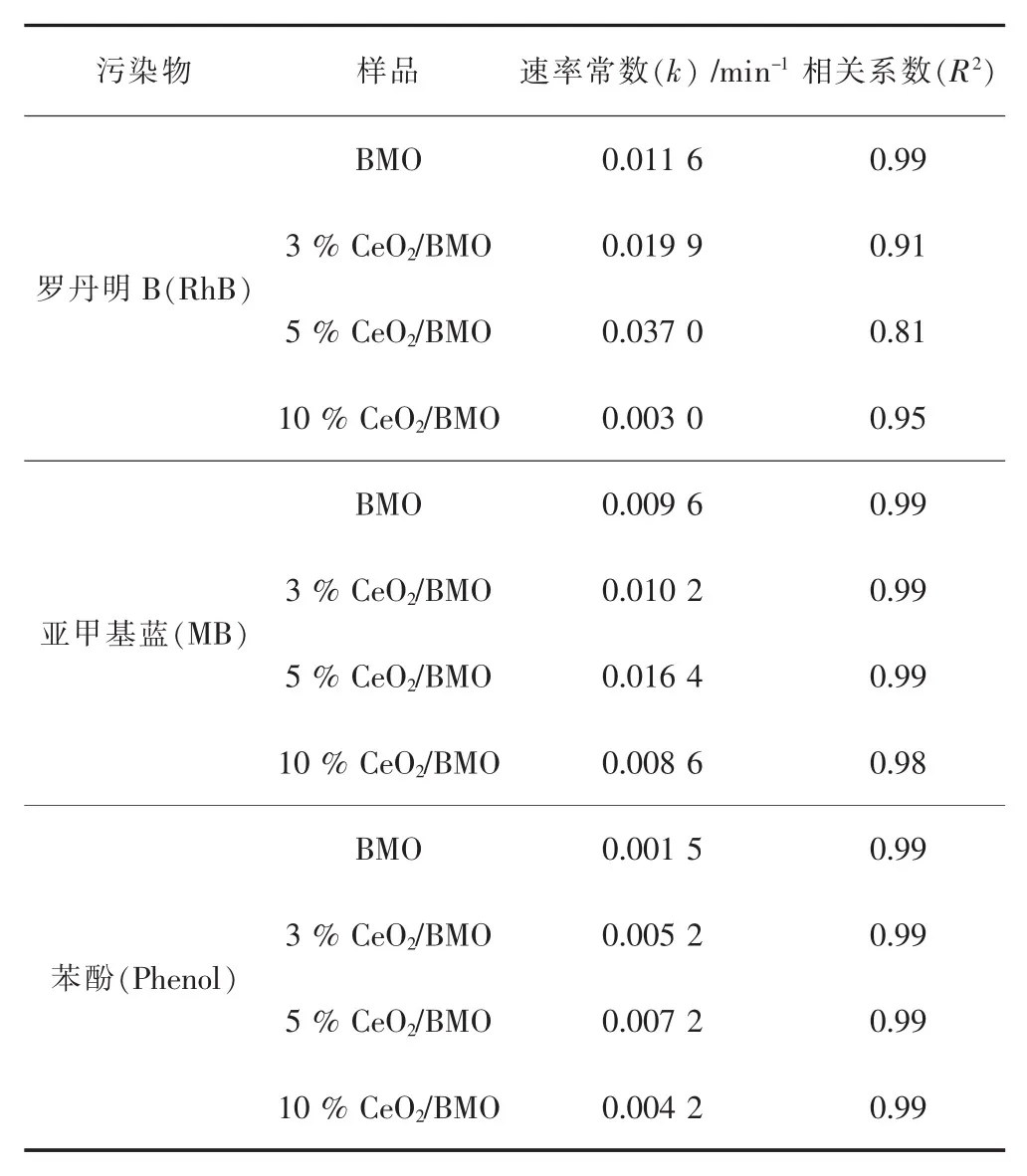
表2 催化剂在降解RhB、MB和苯酚的准一级速率常数Table 2 Pseudo-first order rate constants of catalyst samples in the photocatalytic degradation of RhB、MB and Phenol
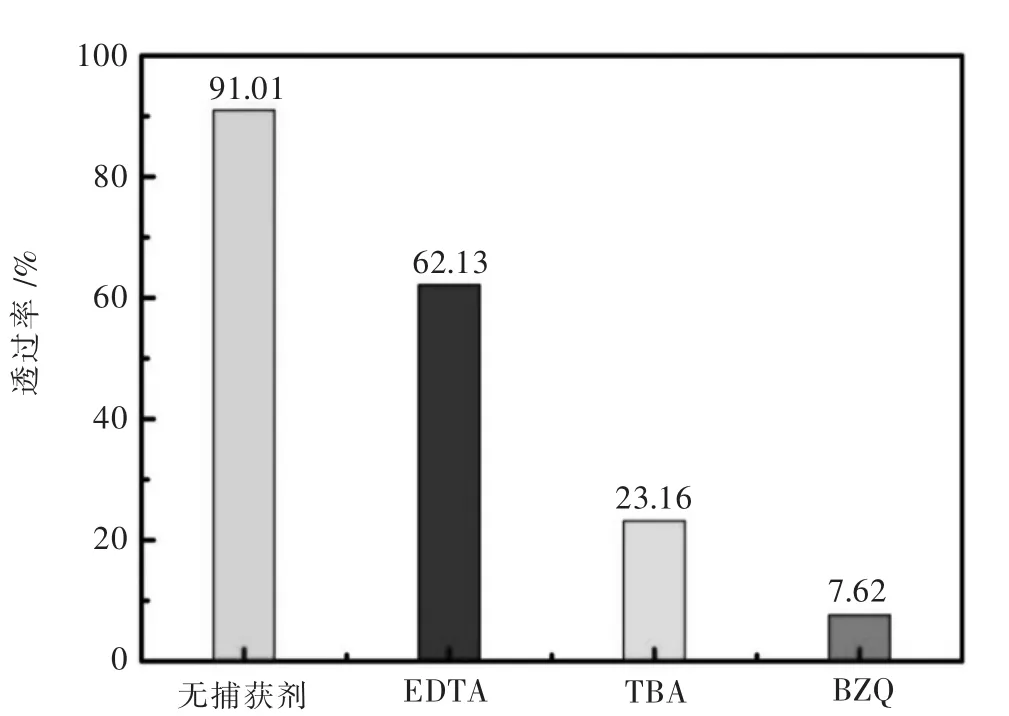
图9 捕获剂EDTA、TBA和BZQ对5%CeO2/BMO光催化降解罗丹明B的性能影响Fig.9 Effect of quencher(EDTA,TBA and BZQ)on the photocatalytic degradation of rhodamine B by 5%CeO2/BMO
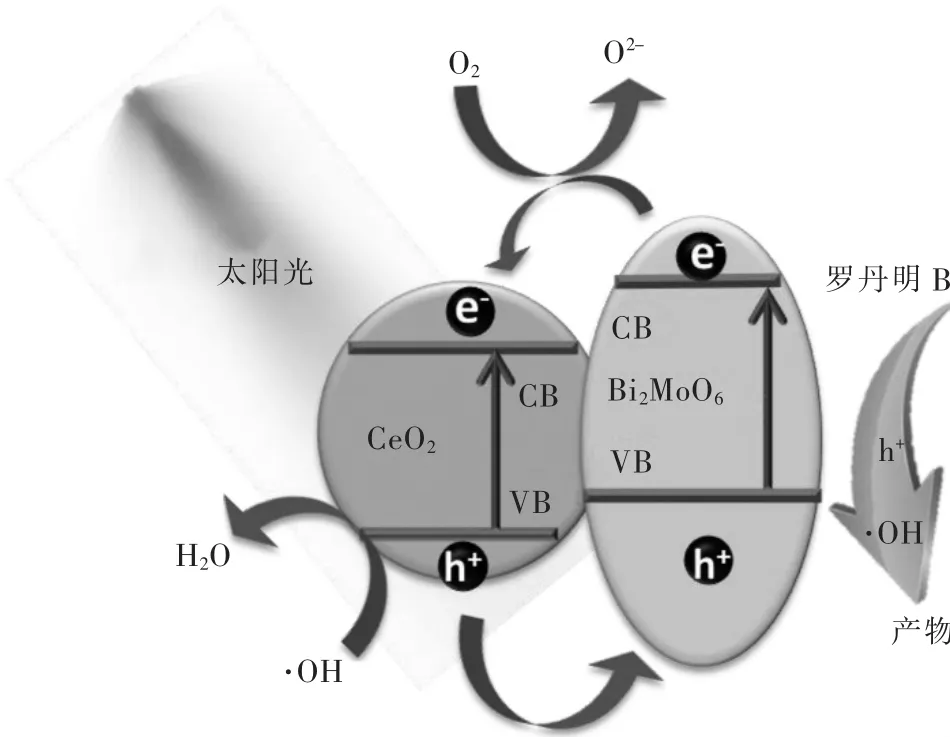
图105 %CeO2/BMO复合材料光催化剂对RhB的降解机理Fig.10 Mechanism of degradation of RhB by 5%CeO2/BMO composite photocatalyst
3结 论
通过水热法合成不同pH条件的钼酸铋光催化剂,并在其基础上复合CeO2,制备了一系列不同比例的CeO2/BMO复合材料 (摩尔比为3% ~10%).以可见光为光源,RhB、MB和苯酚为降解对象进行光催化活性测试,具体实验结论如下:
1)当pH=6时制得的钼酸铋光催化活性最高,在其基础上复合CeO2后其光催化活性显著提高.
2)CeO2复合量为5%时,模拟太阳光照射60 min后,其对RhB的光催化降解率可达90.01%,相同条件下,纯BMO对RhB降解率仅为49.23%.
3)5%CeO2/BMO复合材料对可见光吸收能力明显增强,CeO2复合后与BMO形成异质结有效促进了光生电子-空穴的分离,从而提高光催化活性.

