缢蛏α-淀粉酶基因外显子区域SNPs筛选及其与生长性状关联性
李 浩,孟德龙,薛宝宝,牛东红,李家乐,沈和定
(上海海洋大学,省部共建水产种质资源发掘与利用教育部重点实验室,水产科学国家级实验教学示范中心,水产动物遗传育种中心上海市协同创新中心,上海 201306)
α-淀粉酶(Alpha amylase)广泛存在于动物、植物和微生物中,主要参与葡萄糖高分子聚合物中α-1,4-糖苷键水解以及作用于淀粉生成糊精和还原糖等反应,对动植物及微生物体内的淀粉降解起重要作用[1]。α-淀粉酶基因广泛存在于真核生物和原核生物基因组中[2-5],到目前为止,许多物种的该基因序列已经被成功克隆。如:YANG等[6]、TADA等[7]、ROGERS等[8]、LEVY等[9]先后分别从细菌、真菌、植物、动物中克隆得到α-淀粉酶基因。在鱼类中,已经成功克隆出美洲拟鲽(Pseudopleuronectes americanus)[10]、澳洲肺鱼(Neoceratodus forsteri)、日本鳗鲡(Anguilla japonica)、斑马鱼(Danio rerio)、尖吻鲈(Lates calcarifer)[11]、 斑 点 绿 河 豚 (Tetraodon nigroviridis)[12]等 α-淀粉酶基因全长序列;此外,在贝类如大珠母贝(Pinctada maxima)[13]、合浦珠母贝(Pinctada fucata)[14]、长牡蛎(Crassostrea gigas)、九孔鲍(Haliotis diversicolor supertexta)[15]、河蚬(Corbicula fluminea)、欧洲大扇贝(Pecten maximus)等也已经成功克隆出α-淀粉酶基因全长序列。随着α-淀粉酶基因克隆与结构分析技术不断成熟,关于α-淀粉酶基因与水产经济动物生长性状相关性分析逐渐成为水产研究的热点,如长牡蛎淀粉酶基因中1个SNP位点与体质量显著相关[16];合浦珠母贝的 α-淀粉酶基因中发现7个SNP位点与生长性状存在显著性差异[14];草鱼(Ctenopharyngodon idellus)α-淀粉酶基因的2个SNP位点与生长性状差异均不显著[17];九孔鲍α-淀粉酶基因中间片段比对获得2个与生长性状相关 SNP位点[15]。但关于缢蛏(Sinonovacula constricta)a-淀粉酶基因与生长性状相关SNP位点研究尚未见报道。
缢蛏,俗称蛏子、蜻子,广泛分布于中国、日本和朝鲜等国的沿海地区,埋栖生活,生长快,味道鲜美,营养丰富,具有重要的经济价值[18],是沿海滩涂养殖的主要经济贝类。近年来,随着缢蛏规模化养殖技术和模式的不断创新和完善,对具有生长速度快、养殖周期短的缢蛏新品种需求越来越迫切。α-淀粉酶作为缢蛏体内主要的消化酶,其活性与生长发育相关,较快的生长速度对应较强的消化生理机能,高水平的消化酶活性有利于缢蛏对营养物质的消化吸收并转化为生长发育所需的能量[19],另有研究表明 α-淀粉酶基因多态性对贝类生长有重要影响[20-22]。因此本实验以缢蛏快长新品种“申浙1号”为研究对象,采用PCR产物直接测序法对缢蛏α-淀粉酶基因外显子区域进行 SNPs位点筛选,利用MassARRAY质谱检测方法对其进行分型,将该基因的多态性与生长性状进行关联分析,以期获得与生长性状相关的分子标记,为缢蛏遗传改良特征标记筛选及定制培育提供参考依据。
1 材料与方法
1.1 材料
采用本实验室自2008年经过连续5代选择育种获得的缢蛏快长新品种“申浙1号”群体作为亲本,进行同批次人工育种且同塘养殖获得8月龄缢蛏快长新品种“申浙1号”群体,随机选取204个个体作为实验材料,平均体质量为(7.682±1.479)g(取自浙江省宁海县潮渔水产养殖公司)。挑选6个极大个体[平均体质量为(10.893±0.926)g]和 6个极小个体[平均体质量为(5.086±0.532)g],取外套膜置于 95%乙醇固定,4℃保存,用于提取DNA筛选SNP位点。缢蛏快长新品种“申浙1号”群体分别用游标卡尺(精确度0.01 mm)和电子天平(精确度 0.001 g)测量其壳长、壳高、壳宽、总重等生长数据用于进行生长性状相关性分析,同时取外套膜置于95%乙醇固定,4℃保存,提取DNA用于SNP分型。
实验所用引物委托上海生工生物工程有限公司合成;海洋动物组织基因组DNA提取试剂盒、2×Taq PCR master mix、DNA分子量标准购自天根生化科技(北京)有限公司;琼脂糖为上海生工生物工程有限公司产品。
1.2 基因组DNA提取
缢蛏外套膜基因组DNA提取,按照海洋动物组织基因组DNA提取试剂盒方法进行操作。采用1%琼脂糖凝胶电泳和紫外分光光度计检测DNA的质量和浓度,-20℃保存。
1.3 缢蛏α-淀粉酶内含子克隆
根据GenBank中已登录的缢蛏α-淀粉酶基因cDNA序列(KX197931.1)同时参照同源性最高的(71%)河蚬 α-淀粉酶基因组序列(AF468016.2),利用 Primer 5.0设计特异性引物AMY F1/AMY R1、AMY F2/AMY R2、AMY F3/AMY R3、AMY F4/AMY R4(表 1)对缢蛏 α-淀粉酶基因内含子区域进行扩增,PCR反应体系为:2×Taq PCR master mix 10μL,上下游引物(10 μM)各 0.6μL,DNA模版 0.8μL,加 ddH2O补足20μL。PCR扩增程序为:94℃ 5 min,94℃30 s,50℃ 30 s/60℃ 30 s/60℃ 30 s/50℃ 30s,72℃1~3 min,35个循环;72℃10 min。扩增产物经过1%琼脂糖凝胶电泳验证,然后按照SanPrep柱式DNA胶回收试剂盒说明书进行纯化,将回收的产物与pMD18-LT载体连接,转化大肠杆菌DH5α感受态细胞后,菌落PCR筛选阳性克隆送上海生工生物工程有限公司测序。
1.4 缢蛏α-淀粉酶基因外显子区域SNPs位点筛选
根据真核生物基因GT-AG法则,将1.3中获得的测序结果进行连接,获得缢蛏α-L淀粉酶全基因序列,利用Primer 5.0设计特异性引物AMY F5/AMY R5、AMY F6/AMY R6、AMY F7/AMY R7、AMY F8/AMY R8、AMY F9/AMY R9、AMY F10/AMY R10(表 1)分别对缢蛏 α-淀粉酶基因外显子区域进行扩增。PCR反应体系同缢蛏α-淀粉酶内含子克隆的反应体系,6对引物PCR扩增程序为:94℃ 5 min,94℃ 30 s,48.5℃ 30 s/52℃ 30 s/54℃ 30 s/50℃ 30 s/53.3℃ 30 s/50℃ 30 s,72℃ 1~2 min,35个循环;72℃10min。用1%琼脂糖凝胶电泳验证,然后PCR产物切胶回收纯化,送上海生工生物工程有限公司直接进行 PCR产物测序,测序结果用软件DNAMAN进行比对,发现 SNP位点后,用SnapShot软件查看测序图谱,进行人工校对,原则为:1)突变位点在所有比对序列中出现频率≥20%则认为是一个潜在的SNP位点。2)突变位点只出现一次则认为是测序错误所致故而舍弃。3)测序结果在引物3′端后的40个碱基内出现的突变位点不予考虑。
1.5 SNP位点分型
由上海欧易生物医学科技有限公司采用MassARRAY质谱检测方法对筛选出来的SNP位点进行分型,具体方法为根据筛选出的位点进行PCR引物和延伸引物设计,PCR引物用于扩增待验SNP位点的目的片段,延伸引物用于延伸待验SNP碱基。SNP分型具体操作为:第一步,PCR扩增目的片段,扩增体系为:HotStar Taq(5U·μL-1)0.100μL,MgCl2(25 mM)0.325μL,PCR Buffer(15 mM MgCl2)0.625μL,dNTP Mix(25 mM each)0.100μL,Primer Mix(500 nM each)1.000μL,加 Water(HPLC grade)补足4.000μL。扩增条件为94℃ 5 min,94℃ 20 s,56℃ 30 s,72℃1 min,45个循环,72℃3 min。第二步,用SAP处理 PCR产物,SAP Mix处理液体系为10xSAP Buffer 0.17μL,SAP Enzyme(1U·μL-1)0.30μL,加 Water(HPLC grade)补足 2.00μL。SAP反应程序为37℃20 min,85℃5 min,4℃保存。第三步,SNP位点延伸,iPLEX Termination mix 0.200μL,iPLEX Enzyme 0.041μL,0.222×iPLEX Buffer Plus 0.200μL,Primer Mix 0.940 μL,加 Water(HPLC grade)补足 2μL。然后加入上述反应液,混均。延伸反应程序为94℃30 s,94℃ 5 s,(52℃ 5 s,80℃5 s,5个循环),40个循环,72℃3 min,4℃保存。第四步,对延伸产物进行树脂纯化,运用MassARRAY Nanodispenser RS1000点样仪将其点样至 SpectroCHIP芯片,MassARRAY Analyzer Compac质谱检测,TYPER软件分析实验结果,从而获得分型数据。
1.6 数据统计分析
SNPs分型与缢蛏快长新品种“申浙1号”表型数据利用EXCEL软件进行整理,使用Cervus 3.0软件[23]进行分型后SNP位点遗传多样性参数计算,运用 SPSS 22.0[24]软件中的一般线性模型对缢蛏快长新品种“申浙1号”进行位点(单倍型)与壳长、壳高、壳宽和总重的关联分析,若组间存在显著性差异时,进行Duncan’s氏法的事后多重比较。
2 结果与分析
2.1 缢蛏α-淀粉酶基因序列获得
缢蛏α-淀粉酶基因序列总长度为5 767 bp,含有7个外显子和6个内含子,剪切符合GTLAG剪接规则,其中4号外显子最长,为1 094 bp,1号外显子最短,为36 bp,其余长度在137~244 bp之间;6号内含子最长,为1 255 bp,2号内含子最短,为419 bp,其余长度在433~595 bp之间。
2.2 缢蛏α-淀粉酶基因外显子区域突变位点筛查
缢蛏α-淀粉酶基因外显子区域进行扩增、测序和比对,共发现18个候选SNPs位点,以缢蛏α-淀粉酶 cDNA序列(KX197931.1)起始密码ATG开始,分别命名为 Rs-1:48 G/C、Rs-2:247 C/A、Rs-3:420 A/G、Rs-4:441C/T、Rs-5:537 G/T、Rs-6:837 G/T、Rs-7:936 A/G、Rs-8:952A/C、Rs-9:1047 T/G、Rs-10:1062 C/T、Rs-11:1287C/T、Rs-12:1350 A/C、Rs-13:1362 C/T、Rs-14:1371 C/T、Rs-15:1503T/C、Rs-16:1536 T/C、Rs-17:1737T/C、Rs-18:1788 C/T。
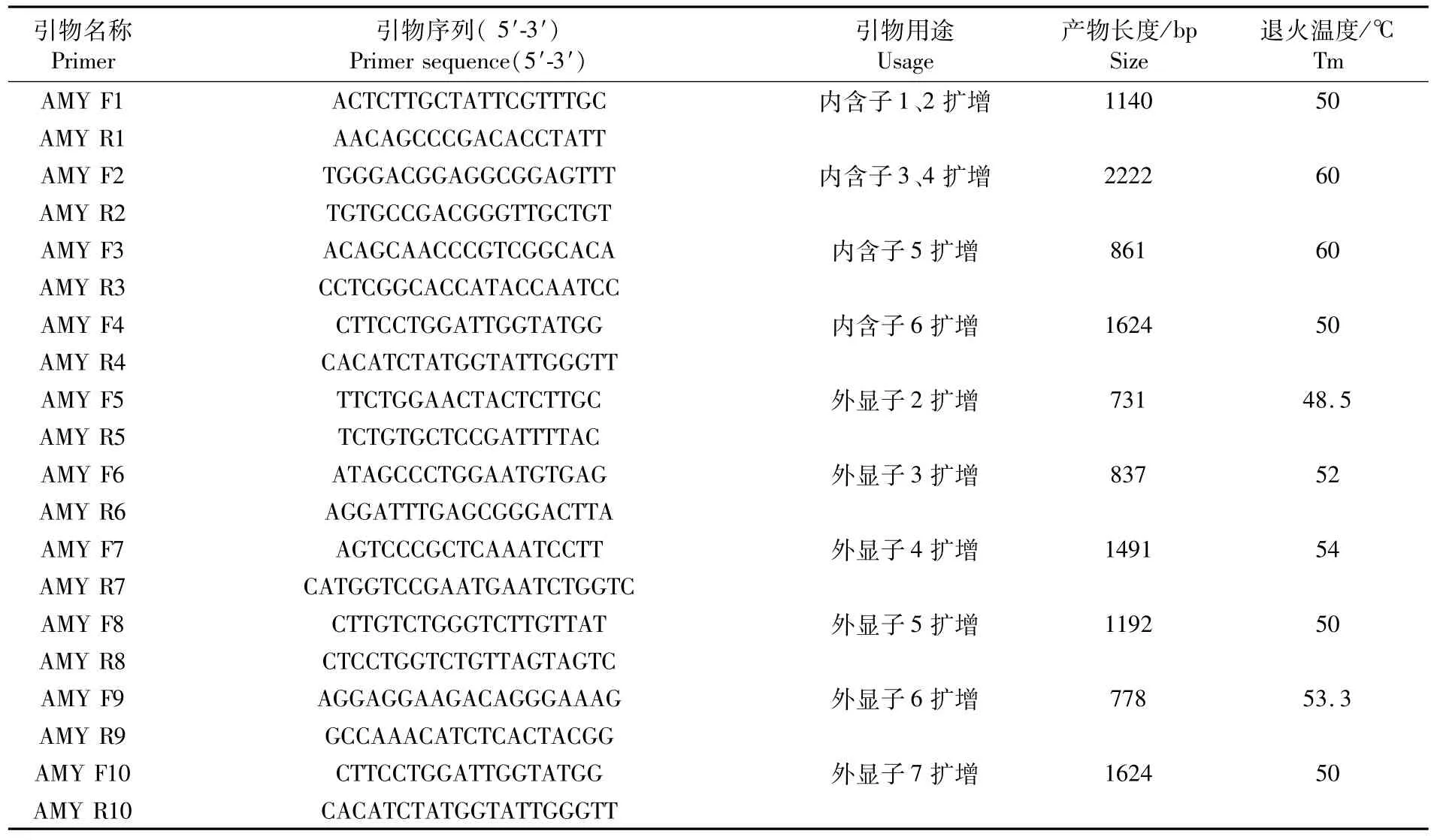
表1 α-淀粉酶基因序列获得及外显子区域SNP位点筛选所用引物Tab.1 Primers used forα-amylase gene clone and SNP test of exome
2.3 α-淀粉酶基因外显子区域SNPs位点遗传参数分析
SNP位点分型前技术评估,Rs-4、Rs-15、Rs-17 3个位点不能设计引物进行检测,故未对其进行SNP位点分型。运用MassARRAY质谱检测方法对缢蛏快长新品种“申浙1号”204个个体进行α-淀粉酶外显子区域15个SNPs位点分型结果显示,Rs-8、Rs-11两个位点呈现三态,其余位点均呈现为二态。由于3个或者4个等位多态性极为少见,几乎可以忽略[25],因此本文中对 Rs-8、Rs-11位点未进行遗传参数等相关计算。剩余位点采用Cervus 3.0软件计算其有效基因(Ne)、期望杂合度(He)、观测杂合度(Ho)及哈迪-温伯格平衡(P-value)等遗传参数(表 2,表 3)。
2.4 不同位点基因型与生长性状的相关性分析
缢蛏快长新品种“申浙1号”群体不同位点的基因型与生长性状的相关性分析结果发现,Rs-5、Rs-10位点各基因型个体之间部分生长性状存在显著性差异,其余位点未发现显著性差异的存在(表4)。Rs-5位点显著性差异在壳高与壳宽两个性状上表现具有一致性,均为GG型个体大于GT与 TT型个体(P<0.05);Rs-10位点 CC与CT型个体(壳长)均大于TT型个体(P<0.05)。
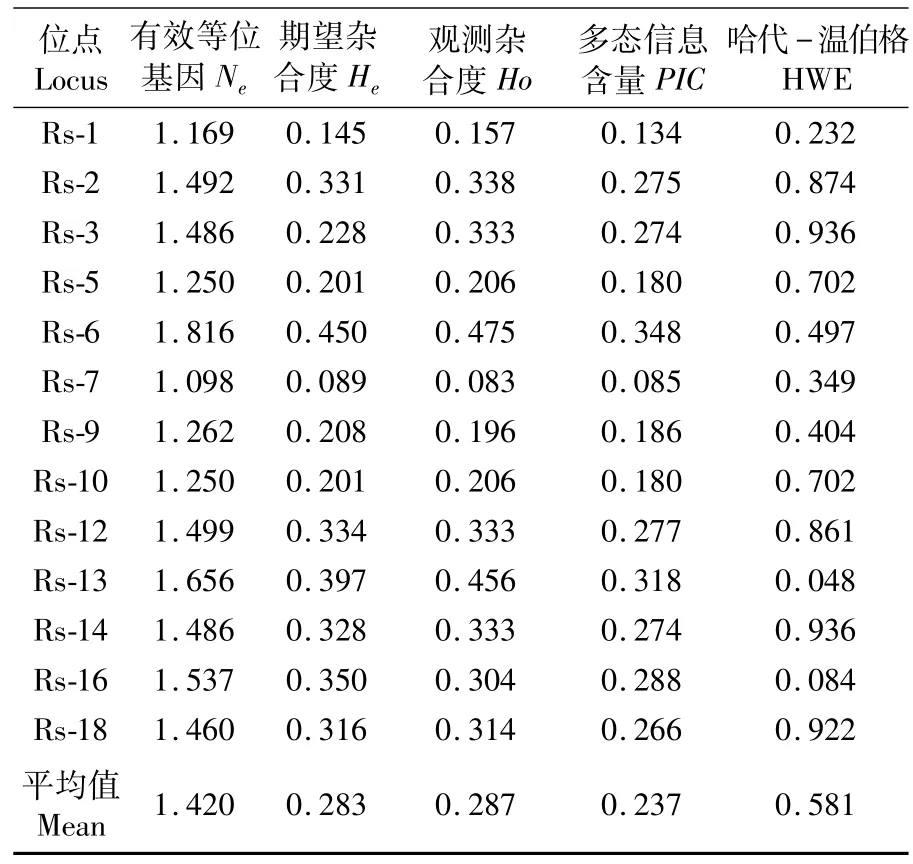
表2 α-淀粉酶外显子区域13个SNP位点的遗传参数Tab.2 Polymorphic parameters of thirteen SNPs site ofα-amylase exon region
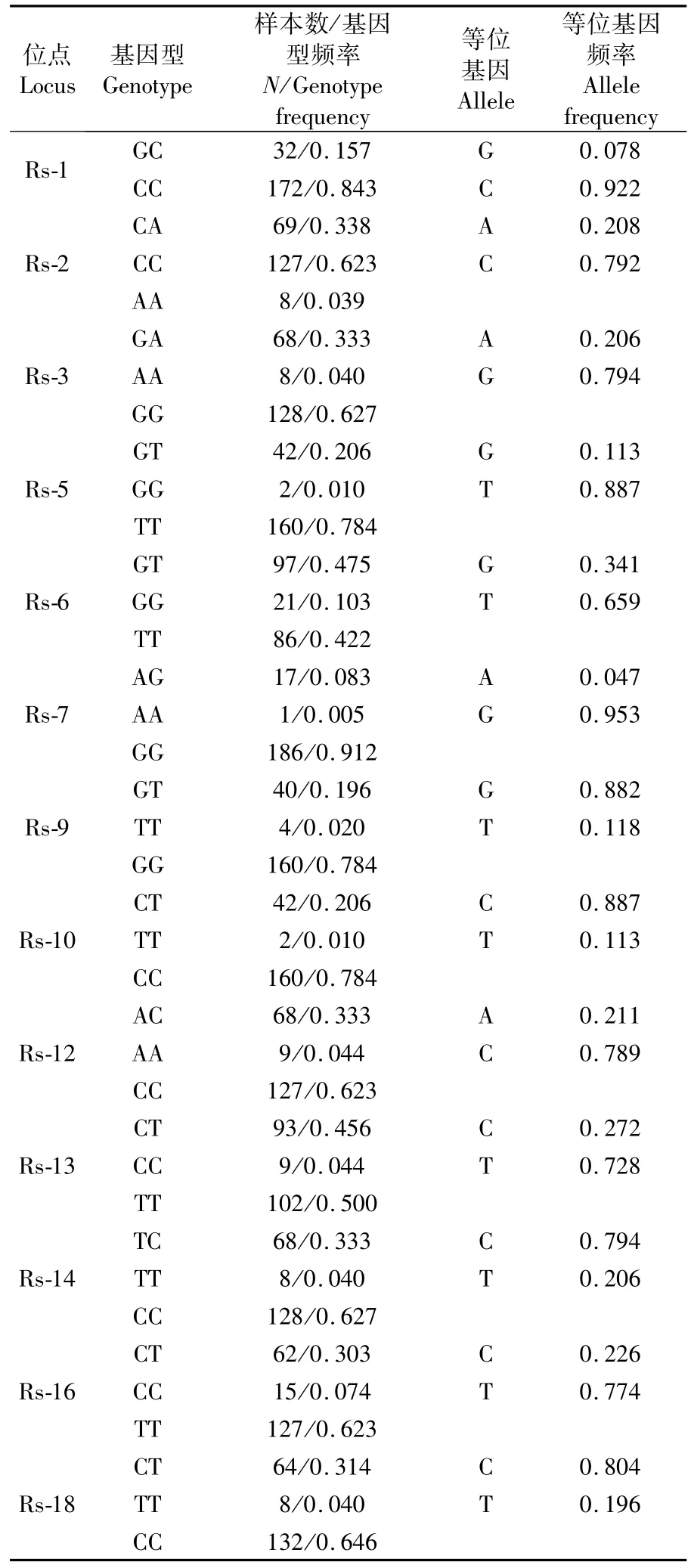
表3 α-淀粉酶外显子区域SNPs位点的基因型及等位基因频率Tab.3 Genotype and gene frequency of the SNPs site ofα-amylase exon region
在将13个SNP位点组合成双倍型时,缢蛏快长新品种“申浙1号”204个个体共构成31种类型,对其中频率较高(大于3%)的组合(基因型与组合信息见表5),进行其与生长性状的相关性分析(表6)。S1~S7在壳长、壳宽性状方面均未达到显著性水平;双倍型S6壳高高于S3、S5、S7(P<0.05);双倍型 S6总重高于 S7(P<0.05)。
3 讨论
3.1 缢蛏α-淀粉酶基因的多态性
SNP分为基因编码区SNP和非编码区SNP,据生物遗传性状影响可将基因编码区SNP分为同义 cSNP(synonymous cSNP))和非同义 cSNP(non-synonymous cSNP));发生在基因序列中非编码区SNP以及编码区同义cSNP一般不会对蛋白质功能结构和表型性状产生重大影响。本实验中绝大部分SNPs位点为同义突变,仅Rs-2、Rs-5、Rs-6 3个SNP位点发生非同义突变,分别为亮氨酸→异亮氨酸、天冬氨酸→谷氨酸、苯丙氨酸→亮氨酸。非同义cSNP的产生将会使蓝本翻译的蛋白质序列发生改变,从而可能影响蛋白质的功能,导致生物性状的改变[26]。因此探究基因编码区域SNP位点在生物育种领域的研究具有重要意义。本实验对缢蛏快长新品种“申浙1号”α-淀粉酶基因外显子区域PCR产物直接测序、筛选获得18个候选SNPs位点,分别有:Rs-1:48 G/C、Rs-2:247 C/A、Rs-3:420 A/G、Rs-5:537 G/T、Rs-6:837 G/T、Rs-7:936 A/G、Rs-9:1047 T/G、Rs-10:1062 C/T、Rs-12:1350 A/C、Rs-13:1362 C/T、Rs-14:1371 C/T、Rs-16:1536 T/C、Rs-18:1788 C/T;除3个位点无法进行SNPs分型外,剩余15个位点中2个位点为三态性,13个位点为二态性。深入研究13个SNPs位点,发现其变异类型为单个碱基的转化或颠换,其比值接近于1,这一结果与合浦珠母贝[14]、九孔鲍[15]的 α-淀粉酶基因中两种变异类型的比值一致。转化中以C-T之间变异居多,这可能是因为CpG二核苷酸上的胞嘧啶残基大多数是甲基化,自发地脱去氨基而形成胸腺嘧啶所致[27]。
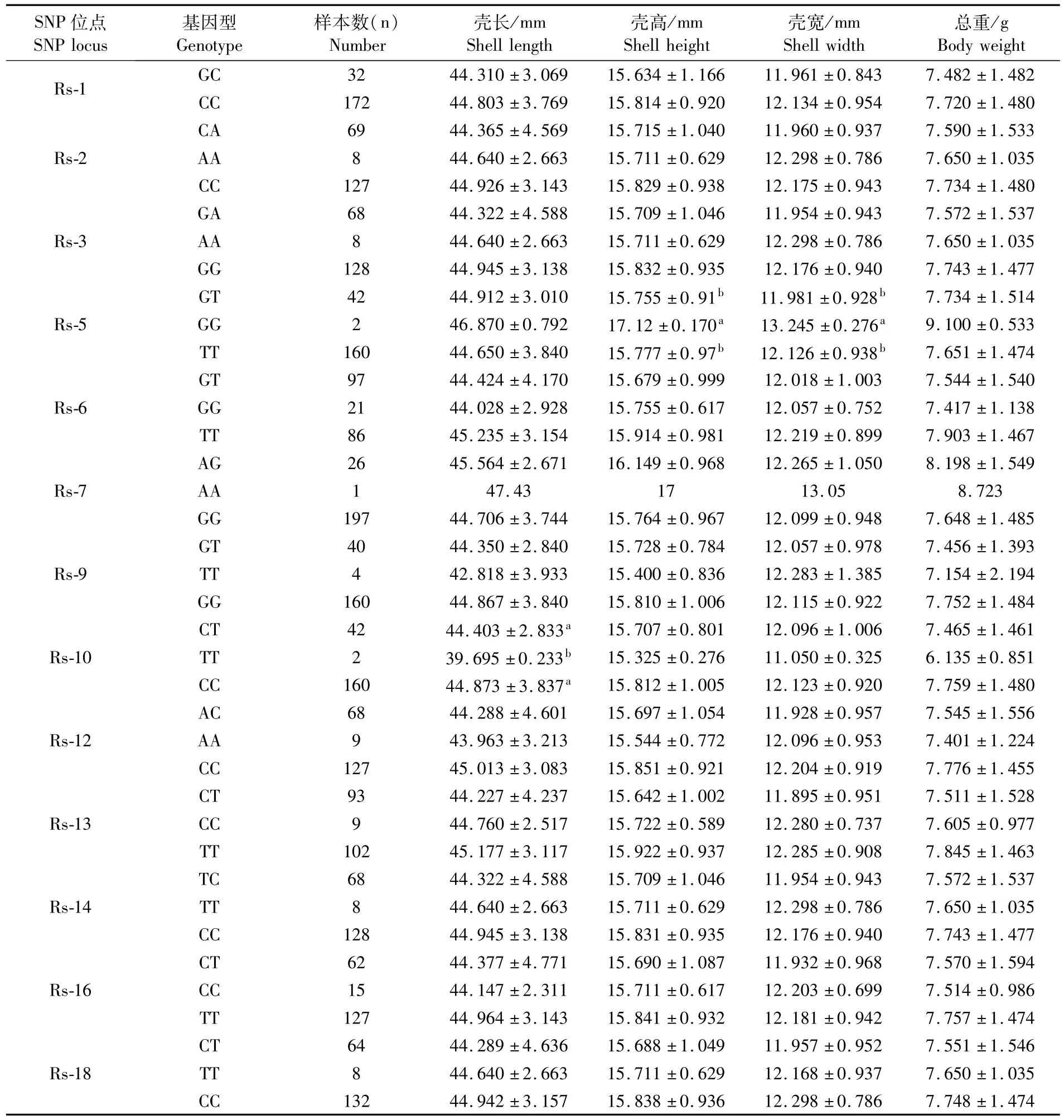
表4 α-淀粉酶外显子区域SNP位点与生长性状的关联分析Tab.4 Correlation ofα-amylase exon region genotypes with growth traits
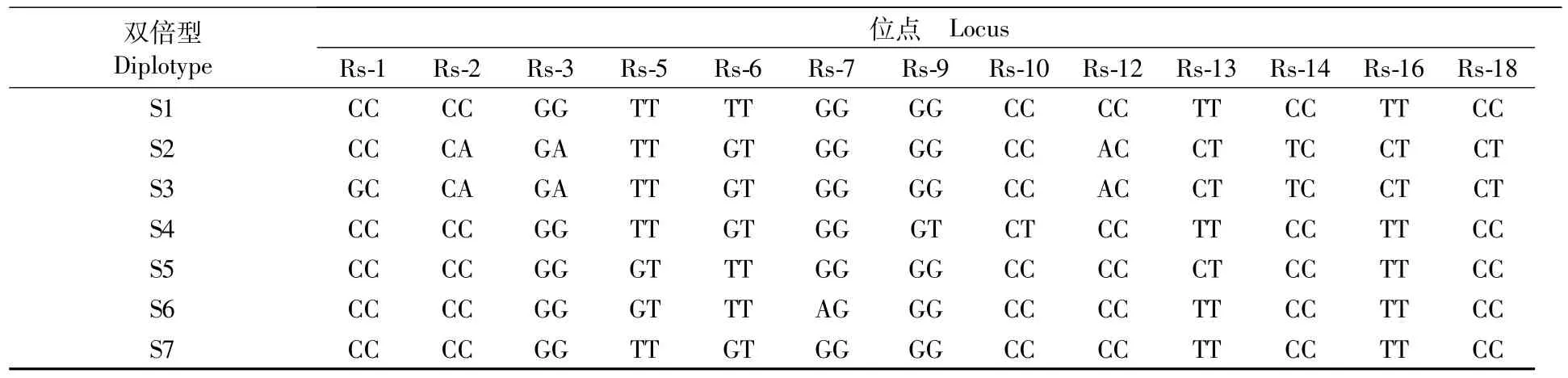
表5 双倍型S1-S7基因型与组合信息Tab.5 Sequence information of diplotype S1-S7
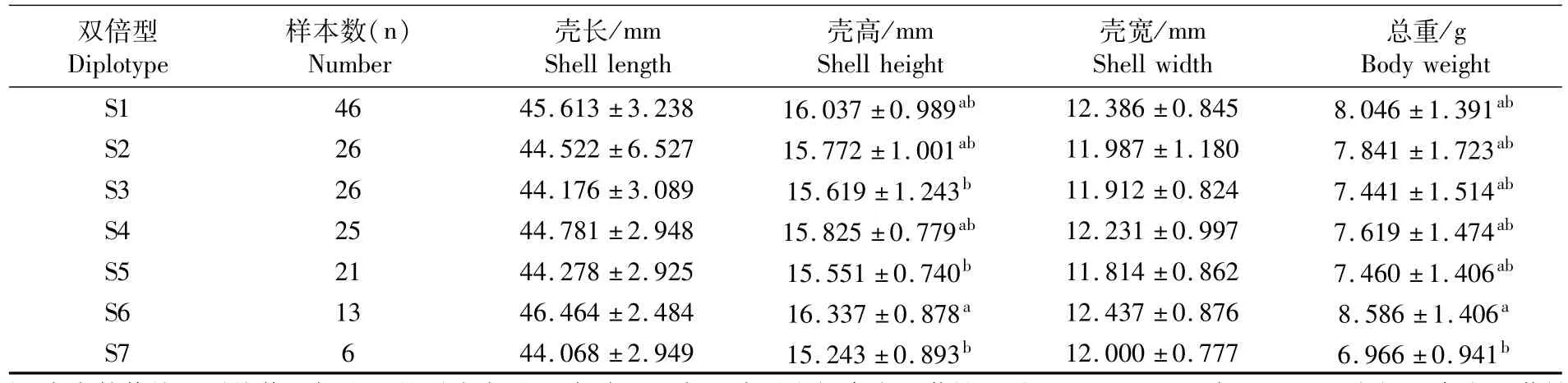
表6 α-淀粉酶外显子区域不同双倍型与生长性状的多重比较Tab.6 Association ofα-amylase exon region of different diplotypes with growth traits
另外,非同义突变虽未引起α-淀粉酶空间结构改变,但对3个非同义突变位点不同基因型个体间的生长性状差异性分析发现:Rs-2与Rs-6位点的突变对缢蛏快长新品种“申浙1号”群体生长性状未造成显著性差异(P>0.05);Rs-5位点由T→G,GG型个体的均值在平均壳高、平均壳宽两个性状方面均显著大于TT与GT型(P<0.05)。这可能因为Rs-5位点的突变位于α-淀粉酶基因的活性区域,突变造成酶活性提高。高水平的淀粉酶活性有利于缢蛏对营养物质的消化吸收并转化为生长发育所需的能量[19],因此在缢蛏快长新品种“申浙1号”育种过程中,针对Rs-5位点可以保留GG型个体,淘汰TT与GT型个体。
遗传多样性指物种群体内及群体间的遗传变异度,这种变异度决定其进化潜力[28],丰富的遗传多样性意味着较高的环境适应能力[29-30],物种遗传多样性通常根据PIC、杂合度以及有效等位基因数等指标进行衡量。本实验结果显示,期望杂合度与观测杂合度均小于0.5,表明α-淀粉酶基因外显子区域较保守,选择的潜力较小。一般认为PIC>0.5时该位点为高度多态,0.25<PIC<0.5为中度多态,PIC<0.25则为低态[31],13个 SNPs位点中有8个位点 PIC大于0.25,属于中度多态性,其余均小于0.25,为低态性,PIC总体均值为0.237,为低态性。选择潜力小以及PIC低态性表明:在连续数代的缢蛏群体选育过程中,基因型纯合度提高,遗传多样性降低,表明快长选育效果理想。因此,在今后缢蛏选育中可以适当引进不同地理种群或者大幅提升亲本数量以及建立性状明显的特征家系,以此来提高基因位点的丰富度,降低快长性状退化消失的风险。
3.2 缢蛏α-淀粉酶外显子区域SNPs位点与生长性状关联的应用潜力
HUVET等[22]对太平洋牡蛎 α-淀粉酶基因多态性与生长性状、消化特性的相关性进行研究,发现不同基因型对牡蛎的摄食及吸收效率有显著影响,进而影响牡蛎的生长。PRUDENCE等[16]对太平洋牡蛎α-淀粉酶基因多态性研究发现不同基因型牡蛎的生长差异显著,并认为淀粉酶基因标记在选择育种中具有潜在的价值。本实验中缢蛏快长新品种“申浙1号”α-淀粉酶外显子区域13个SNPs位点与生长性状相关性分析显示:只有Rs-5、Rs-10两个单个位点在部分性状(壳高、壳宽、壳长)存在显著性差异,其余位点未发现与生长性状的显著性关联,不同的突变位点对应着各自的优势基因,但是生长性状为连续的数量性状,不是由某个优势基因所决定,单倍型分析则针对位于同一条染色体上的2个或多个SNPs的等位基因,根据所有连锁不平衡的信息,探究多个突变位点间的相互作用,因此更加容易发现不同基因型组合方式对生长性状带来的影响[32-35],也能更真实地反映位点与性状的相关性[36]。本研究单倍型分析中发现:除壳长未有显著性差异外,壳高、壳宽和总重3个性状均存在显著性差异,并且双倍型S6在壳高、壳宽、总重3个性状上均显著大于S7(P<0.05)。因此在今后缢蛏的分子育种过程中,应尽量选择生长优势明显的双倍型S6个体,淘汰基因型为双倍型S7的个体。

