吉非替尼半固体过饱和纳米自乳化药物递送系统的制备与评价
杨春燕 操锋 赵甜静
【摘要】目的:本实验旨在制备与评价一种新型的半固体过饱和纳米自乳化药物递送系统。方法:采用三相图法,将沉淀抑制剂和吉非替尼(Gefitinib,GEF)加入半固体制剂中,对处方乳化粒径、时间和体外稀释进行评价。结果:过饱和自乳化处方的载药量(90.1mg/g-98.0mg/g)显著提高。稀释后可在5min内完全乳化,粒径为200~400nm。1% (w/w) Soluplus(聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物)的加入即可将经稀释产生的过饱和状态延长至6h。结论:总体结果表明,本实验制备的半固体过饱和自乳化体系有利于提高SNEDDS(Self-nanoemulsifying Drug Delivery System)中载药受限的难溶药物的溶解度并维持其体外稀释后的药物过饱和状态。
【关键词】吉非替尼;半固体过饱和纳米自乳化药物递送系统;Soluplus;Gelucire44/14
[Abstract] Objective:This study aimed to prepare and evaluate a novel semi-solid supersaturable self-nanoemulsifying drug delivery system. Methods:G-sSNEDDS(GEF-loaded supersaturable self-emulsifying drug delivery system)was prepared by homogenizing precipitation inhibitor and GEF into semisolid SNEDDS. G-sSNEDDS was evaluated for particle size,emulsification time and in vitro dissolution. Results: Significant improvement of GEF load was observed from G-sSNEDDS (90.1mg/g-98.0mg/g). G-sSNEDDS spontaneously formed droplets between 200nm and 400nm within 5 min when introduced into simulated gastric fluid. On the other hand,G-sSNEDDS resulted in a slower crystallization of GEF by virtue of 1%(w/w) soluplus (polyvinyl caprolactam-polyvinyl acetate-polyethylene glycol graft copolymer), maintaining longer supersaturable state (6h) after diluted. Conclusion: The overall results suggest that this novel formulation could improve solubility and supersaturation time of poorly water soluble drugs that have limited drug load in SNEDDS.
[Key words] Gefitinib; Semi-solid supersaturable self-nanoemulsifying drug delivery system; Soluplus; Gelucire44/14
【中圖分类号】R249【文献标识码】B 【文章编号】2095-6851(2019)04-051-01
与常规液体SNEDDS相比,半固体SNEDDS可改善稳定性、顺应性和不相容性等问题,具有一定的优势。常规SNEDDS中药物均完全溶解,这限制了SNEDDS的载药能力,无法满足处方中溶解度不理想且具有高剂量要求的药物的需求。结合混悬液高载药量的优势,高剂量要求的药物可制备为基于SNEDDS的混悬液。此外,SNEDDS处方筛选时不仅应满足药物在处方中的稳定,还需能够在整个胃肠道中维持药物的溶解。沉淀抑制剂的加入,有利于在整个胃肠道中产生和维持亚稳态过饱和药物状态,即热力学稳定的过饱和SNEDDS。
本实验旨在以难溶药物吉非替尼为模型药物,制备并评价具有高载药量的半固体过饱和自乳化药物递送系统。
1 实验
1.1. 实验材料与仪器 吉非替尼(Gefitinib,上海珂华生物科技);Oleic acid(油酸,Sinopharm);Capmul MCM C8(油酸聚乙二醇甘油酯,ABITEC);Gelucire 44/14(月桂酸聚乙二醇甘油酯,GATTEFOSSE,);Cremophor RH40(聚氧乙烯氢化蓖麻油,BASF);VE-TPGS(维生素E聚乙二醇琥珀酸酯,BASF);Solutol HS15(聚乙二醇羟基硬脂酸酯,BASF);PEG400(聚乙二醇400,BASF);Transcutol HP(二乙二醇单乙基醚,GATTEFOSSE);PVP K12(聚乙烯吡咯烷酮,ASHLAND);HPMC E5(羟丙基甲基纤维素,Dow Chemical Company);Soluplus(聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物,BASF);恒温磁力搅拌器(IKA);粒度检测仪ZPPS(Zeta Potential & Particle Sizer,Nicomp380);HPLC(岛津);恒温震荡仪(Biozshake)。
1.2 HPLC分析方法 流动相:50mM乙酸铵的水溶液-甲醇;色谱柱:Waters Xbrige C18(3.5μm,4.6*150mm);柱温40℃;进样量:10μL;流速:1.0mL/min;检测波长:249nm;稀释剂:80%乙醇-水。
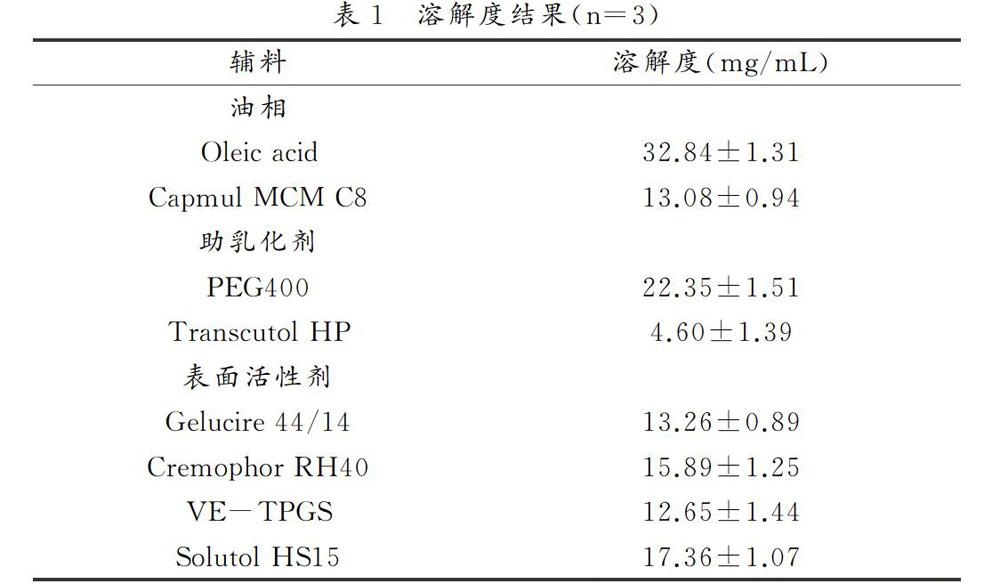
1.3. 溶解度实验 将过量的GEF加入含有1mL各油性辅料中,于25℃(液体辅料)或50℃(半固体辅料)下700rpm加热搅拌24h平衡,14000rpm离心5min,取上清并稀释,通过HPLC定量分析。
1.4 自乳化处方筛选与制备
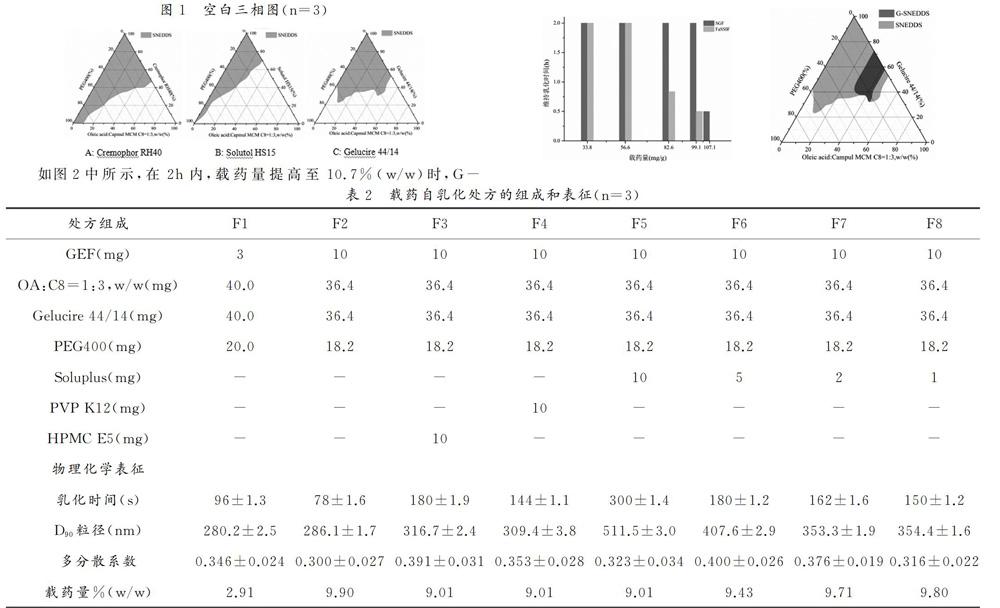
1.4.1 空白SNEDDS三相图 将混合油相、表面活性剂和助乳化剂按照不同质量比混合,于40℃下700rpm震荡平衡24h,制得空白SNEDDS。将100uL空白处方逐滴加入已预热(37℃)的1mL SGF(Simulated gastric fluid,模拟胃液,pH1.2的HCl溶液)中,37℃下100rpm搅拌,从第一滴加入开始计时,通过目视观察记录自乳化形成的时间和最终微乳效果(2min形成澄清透明或泛蓝色乳光的溶液则视为乳化良好[1]),用Origin9.0构建空白三相图。
1.4.2 载药量的确定 将适当量GEF加入空白自乳化处方中,于40℃下700rpm搅拌,最终得到均一混悬的载药处方(GEF-loaded self-emulsifying drug delivery system,G-SNEDDS)。分别取不同载药量的G-SNEDDS(含5.5mg GEF)加入500uL SGF中,于37℃下100rpm搅拌并计时;在搅拌2h后,若乳液仍澄清透明泛蓝色乳光,则移取100uL 该乳液逐滴加入300uL FaSSIF(Fasted state simulated intestinal fluid,模拟肠液[2])中继续搅拌并计时。通过目视观察,记录各溶液中有可见沉淀析出的时间。
1.4.3 载药SNEDDS三相图 将100uL G-SNEDDS逐滴加入1mL SGF中, 37℃下100rpm搅拌,通过目视观察记录SGF稀释后的自乳化时间与效果(方法同1.3.1),用Origin9.0绘制载药三相图。
1.4.4 过饱和载药处方(G-sSNEDDS)的制备 将适当量的沉淀抑制剂(Soluplus,PVP K12,HPMC E5)加入SNEDDS中,40℃下700rpm搅拌至沉淀抑制剂完全溶解或均匀分散,再加入一定量GEF并繼续搅拌,最终得到均一混悬的液体载药处方。将液体载药处方静置于5℃下,使处方加速固化制得均一的半固体载药处方。
1.5 乳化时间与粒径的测定 分别取每份含有5.5mg GEF的载药自乳化处方加入500uL已预热的SGF中,在37℃下以100rpm下搅拌,记录最终乳化形成的时间,测定最终微乳的粒径大小和分布(D90,PDI)。
1.6 体外稀释实验
1.6.1 载药体系的体外稀释 将G-SNEDDS或G-sSNEDDS(均含55mg GEF)加入20mL的稀释介质(SGF、FaSSIF或水)中,37℃下100rpm搅拌,分别在5min,10min,15min,0.5h,1h,1.5h,2h,3h,4h,5h和6h时取样200uL,14000rpm离心5min,取上清稀释后于HPLC进样分析。
1.6.2 GEF与沉淀抑制剂物理混合物的体外稀释 将质量比为1:1的GEF和沉淀抑制剂在涡旋混匀仪上涡旋10min,将110mg混合均匀的物理混合物加入20mL的FaSSIF,37℃下100rpm搅拌,同“1.6.1”项下时间点取样离心并稀释,HPLC进样分析。
1 实验结果
1.1 溶解度实验
根据各辅料对GEF的溶解能力和形成制剂的乳化能力对自乳化处方的进行初步筛选。表 1中为GEF在辅料中的平衡溶解度结果,结合长链油相(油酸)的溶解能力和中链油相(Capmul MCM C8)的乳化能力[3],选择二者按质量比1:3混合作为最终油相;选择溶解度较高的PEG400作为助乳化剂;VE-TPGS作为表面活性剂加入后所得混合物不能互溶,因此采用Gelucire 44/14、Cremophor RH40和Solutol HS15进一步筛选。
1.2 三相图和载药量
如图1所示,含有Cremophor RH40和Gelucire44/14的处方乳化能力更好。相同比例的Gelucire44/14(熔点44℃)比Cremophor RH40(熔点20-40℃)加入后得到的空白SNEDDS在冷却条件(2-8℃)下更易固化、形成的半固体更稳定。综合考虑载药量(脂质含量)和乳化能力及固化能力(Gelucire44/14含量),基于自乳化区域,最终选择混合油相、Gelucire44/14和PEG400质量比为2:2:1为空白自乳化处方。
如图2中所示,在2h内,载药量提高至10.7%(w/w)时,G-SNEEDS在SGF中的维持澄清透明的乳化能力明显降低;提高至8%(w/w)时,在FaSSIF中的保持澄清透明得乳化能力则逐步降低;选择在SGF中保持良好乳化能力的99.1mg/g为初步载药量。图3中深灰色区域载药后的自乳化区域,由于载药量的提高,其自乳化区域相对空白自乳化区域变小。
1.3 乳化时间和粒径
如表 2所示,F1为GEF完全溶解的常规自乳化处方,F2-F8为GEF以溶解和混悬状态并存的自乳化处方。加入沉淀抑制剂之后的G-sSNEDDS(F3-F8)自乳化粒径均略微增大,但仍适用于GEF的口服递送。其中加入PVP(F3)和HPMC E5(F4)和的G-sSNEDDS自乳化粒径与G-SNEDDS(F2)相比较变化不大;而加入Soluplus的G-sSNEDDS(F5-F8),乳化粒径增大。
1.4 体外稀释
1.4.1 不同介质对于G-SNEDDS稀释的影响
图4中,G-SNEDDS(F2)在SGF、FaSSIF和水三种不同稀释介质中的溶解曲线呈现出一定的pH依赖性。在较低pH的稀释介质SGF中能够迅速完全乳化并维持至少6h;但在高pH稀释介质FaSSIF和纯水中,初始乳化水平约为65%,并可观察到乳化能力随时间延长逐步降低至约40%。
1.4.2 不同沉淀抑制劑对于GEF和G-sSNEDDS的影响 如图 5所示为GEF、GEF与沉淀抑制剂物理混合物在FaSSIF中的动力学溶解度。沉淀抑制剂的加入均一定程度上提高了GEF的溶解度,其中沉淀抑制剂Soluplus的增溶作用最为显著。
如图 6所示为GEF、G-SNEDDS(F2)和G-sSNEDDS(F3-F5)在FaSSIF中的动力学溶解度曲线。HPMC E5和Soluplus的加入均有明显的延长过饱和状态的作用,Soluplus的增溶作用最高。PVP K12的加入则没有可见的延长过饱和效果。
三种沉淀抑制剂维持G-sSNEDDS过饱和的能力为:Soluplus > HPMC E5 > PVP K12。
1.4.3 Soluplus的含量对于G-sSNEDDS的影响
为了评价Soluplus的用量对过饱和状态持续时间的影响,制备含有不同比例Soluplus的G-sSNEDDS并考察其在FaSSIF中的体外稀释行为(F2,F5-F8)。如图 8所示,含有不同比例的Soluplus均可使G-sSNEDDS(F5-F8)的过饱和状态维持时间延长至至少6h;随着Soluplus的含量降低,G-sSNEDDS粘度降低,自乳化速率加快。1% 的Soluplus(F8)即可维持6h的过饱和状态。
进一步研究吉非替尼、Soluplus与GEF的物理混合物、G-SNEDDS(F2)和G-sSNEDDS(F8)在FaSSIF中体外稀释行为,如图 9,与物理混合物和G-SNEDDS(F2)相比,G-sSNEDDS(F8)始终显示出较高的体外稀释水平,表明沉淀抑制剂和自乳化系统对药物的增溶具有协同作用。
2 讨论
半固体表面活性剂Gelucire 44/14的使用使得SNEDDS在室温下呈现半固体状态。沉淀抑制剂的加入在维持过饱和状态的同时,也会增加SNEDDS的粘度,过高的粘度使得SNEDDS自乳化速率延缓,延迟其在水中的扩散。亲水性沉淀抑制剂PVP K12和HPMC未吸附或掺入液滴表面,则对液滴粒径无明显影响[4],两亲性沉淀抑制剂Soluplus由于其在乳滴表面的结合或吸附使得乳化粒径增加[5]。沉淀抑制剂与药物之间的氢键作用可增加药物晶体成核活化能,延迟药物晶体成核,有助于延长与维持药物的过饱和状态[6]。PVP每单体单元仅有一个羰基(氢键受体),HPMC每单体单位仅有一个羟基(氢键供体),而Soluplus每单体单元具有两个羟基。GEF富含氢键受体,与富含氢键供体的Soluplus之间氢键作用更强[7]。
通过35.7%的混合油相(Oleic acid : Capmul MCM C8=1:3)、35.7% Gelucire 44/14和17.8% PEG400组成SNEDDS,加入1.0% Soluplus,成功制备了新型的半固体过饱和的吉非替尼纳米自乳化药物递送系统。在非漏槽条件下的体外稀释试验表明,载药自乳化处方可在SGF中可较快乳化完全;在FaSSIF中,1.0 % Soluplus即可延长稀释后过饱和状态。本实验提供了一种可行的制备较高载药量并维持体内过饱和的半固体纳米自乳化药物递送系统的方法。
参考文献:
[1] Shahba A W, Mohsin K, Alanazi F K. The Studies of Phase Equilibria and Efficiency Assessment for Self-Emulsifying Lipid-Based Formulations [J]. Aaps Pharmscitech, 2012, 13(2):522-533.
[2] Biorelevant FaSSIF溶液配制指导说明书[Z]. 2017版. 上海起发实验试剂有限公司
[3] Shahba A W, Mohsin K. The Studies of Phase Equilibria and Efficiency Assessment for Self-Emulsifying Lipid-Based Formulations [J]. Aaps Pharmscitech, 2012, 13(2):522-533.
[4] Lee D R, Ho M J, Choi Y W, et al. A Polyvinylpyrrolidone-Based Supersaturable Self-Emulsifying Drug Delivery System for Enhanced Dissolution of Cyclosporine A [J]. Polymers, 2017, 9(4):124.
[5] Lee D R, Ho M J, Jung H J, et al. Enhanced dissolution and oral absorption of tacrolimus by supersaturable self-emulsifying drug delivery system [J]. International Journal of Nanomedicine, 2016, 11:1109-1117.
[6] Xu S, Dai W G. Drug precipitation inhibitors in supersaturable formulations [J]. International Journal of Pharmaceutics, 2013, 453(1):36-43.
[7] Quan G, Niu B, Singh V, et al. Supersaturable solid self-microemulsifying drug delivery system: precipitation inhibition and bioavailability enhancement [J]. International Journal of Nanomedicine, 2017, 12:8801-8811.

