外源性H2S对血管性痴呆大鼠海马MDA、SOD、Cyt C表达的影响*
刘雨霞, 郑 菊, 肖子宇, 张文萍, 李 毅, 吴昌学, 官志忠, 肖 雁*
(1.贵州医科大学 地方病与少数民族疾病教育部重点实验室, 贵州 贵阳 550004; 2.贵州医科大学 贵州省医学分子生物学重点实验室, 贵州 贵阳 550004)
血管性痴呆(vascular dementia,VaD)是指由缺血性、出血性及慢性缺氧缺血性脑血管疾病引起的脑功能障碍而产生的获得性智能损害综合征[1],被广泛认为是除阿尔茨海默病后第2种最常见的痴呆类型,其临床表现主要有神经认知障碍、行为症状及运动异常[2],其的主要发病机制包括炎症反应和氧化应激。硫化氢(hydrogen sulfide,H2S)在其生理作用被发现之前,被公认为是一种毒性气体[3],而近年的研究表明H2S是一种新型气体递质,可通过抗炎症[4]和抗氧化应激对心脑血管起到保护作用[5]。有研究指出,H2S对脑缺血小鼠的血脑屏障完整性起着保护作用[6]。现已证实H2S在氧糖剥夺再灌注诱导的神经元细胞凋亡中对保持线粒体功能具有一定的作用[7],但目前尚不清楚H2S对VaD大鼠保护作用的具体机制。本研究利用改良二血管法(2-vessel occlusion,2-VO)制作VaD模型,以NaSH做为H2S供体,探讨H2S对VaD大鼠的保护作用及机制。
1 材料和方法
1.1 动物、试剂及仪器
1.1.1动物 成年健康雄性SD大鼠70只,体质量220~250 g [购自贵州医科大学动物实验中心,合同号SCKY(黔)2018-0001]。
1.1.2试剂 NaSH购于美国Sigma公司,细胞色素C(cytochrome C,Cyt C) 抗体购自美国GeneTex公司,β-actin抗体购自美国Abcam公司,HRP标记的抗鼠二抗购于北京中杉金桥公司,HRP标记的抗兔二抗购于北京中杉金桥公司, BCA蛋白定量试剂、ECL-Plus发光液购于美国Thermo Fisher Scientific公司,丙二醛(malondialdehyde,MDA)检测试剂盒购于碧云天生物试剂公司,总超氧化物歧化酶(superoxide dismutase, SOD)活性检测试剂盒检测试剂盒购于碧云天生物试剂公司,组织提取分离试剂盒购于碧云天生物试剂公司,PVDF膜购于美国Millipore公司。
1.1.3仪器 ELX800UV 酶标仪(美国 Bio-Tec公司)、DMS2-Morris 水迷宫(中国医学科学院)、Western blot跑胶装置电源(北京百晶科技公司)、Varioskan LUX多通道酶标仪(美国Thermo Fisher Scientific公司)、GeneGnome XRQ 化学发光成像仪(英国SYNGENE公司)。
1.2 方法
1.2.1动物筛选及分组 70只雄性SD大鼠,保持室温25 ℃、清洁环境下以纯净水、标准饲料适应性喂养30 d,进行MORRIS水迷宫实验检测其学习记忆能力。第1~4天对大鼠的定项航行试验检测大鼠的学习能力项航行试验检测大鼠的学习能力:将Ⅰ~Ⅳ象限中点作为大鼠入水点,大鼠面向池壁放入水中,记录大鼠站上平台(第Ⅲ象限)的间(逃避潜伏期),若60 s内找到平台即结束实验,若未找到则引导其站至平台上并停留10 s结束实验。第5天行空间探索实验检测检测大鼠记忆能力:撤除平台,仍从各象限中点作为其入水点,记录其在60 s内第1次游经平台原位置所需时间(逃避潜伏期),以及60 s内大鼠穿越平台目标区域次数、目标象限内停留时间。选取时间,记忆力相近的SD大鼠60只随机分为假手术组(Sham)、模型组(VaD)、阳性对照组(Nimodipine)、NaSH低剂量组(Low-NaSH)及NaSH高剂量组(High-NaSH),每组12只。
1.2.2VaD大鼠模型制备 大鼠禁食禁水10 h,按照0.3 mL/100 g体质量的剂量经腹腔注射10%水合氯醛进行麻醉,仰卧位固定,颈部备皮,碘伏及75%酒精常规消毒,颈前正中线切口,分离暴露双侧颈总动脉,假手术组仅对双侧颈总动脉进行分离操作但不用手术线进行结扎,其他各组均使用手术线永久结扎双侧颈总动脉;手术切口使用青霉素粉喷洒预防伤口感染,缝合皮肤并作常规消毒。常规饮食清洁饲养。
1.2.3SD大鼠给药 造模结束后,Nimodipine组大鼠给予10 mg/(kg·d)的尼莫地平灌胃给药(5 g/L尼莫地平按2 mL/kg剂量给药)、NaSH低剂量组(Low-NaSH)及NaSH高剂量组(High-NaSH)分别30 μmoL/(kg·d) 、100 μmoL/(kg·d) NaSH灌胃给药(按2 mL/kg剂量给药),对模型组和假手术组大鼠用相同剂量的生理盐水(2 mL/kg)进行灌胃,共给药30 d。
1.2.4行为学实验 给药30 d时,各组分别取6只大鼠,按1.2.1项下方法检测大鼠学习记忆能力。
1.2.5样本制备 水迷宫测试结束后进行取材。称重后腹腔注射10%水合氯醛(0.45 mL/100 g),麻醉后用1×PBS心脏灌注取脑,冰上分离海马组织,部分用碧云天组织提取试剂盒提取海马胞浆蛋白,部分于-80 ℃冻存。
1.2.6CytC蛋白的表达 采用Western blot方法检测, 570 nm波长下测定胞浆BCA蛋白的吸光度值,计算胞浆BCA蛋白浓度,以12 μL/20 μg体系每孔上样于12%的SDS-PAGE凝胶,30 mA恒流进行电泳分离,200 mA转膜75 min,一抗4 ℃孵育过夜,恢复室温孵育1 h,1×TBST洗膜3次(10 min/次),二抗孵育1 h,1×TBST洗膜3次(10 min/次),于GeneGnome XRQ中曝光。β-actin作为内参。
1.2.7MDA含量测定 冻存组织用1×PBS制成10%匀浆,12 000 r/min、4℃离心10 min,取150 μL上清液加入300 μL TBA检测液中,沸水浴15 min;同时设置浓度为1、2、5、10、20、50 μmol/L的标准品制作标准曲线;1 000 g室温离心10 min,取上清200 μL置于96孔板,Varioskan LUX多通道酶标仪读取532 nm处吸光度值记为A532;用BCA蛋白定量法测定样本蛋白浓度记为C样本,结合标准曲线计算组织中MDA含量,MDA=[(A532-0.023 1)/0.049 9]÷C样本。
1.2.8SOD活性测定 冻存组织用SOD样本制备液制成10%匀浆,12 000 r/min、4 ℃离心5 min,取上清液20 μL置于96孔板,加入WST-8酶工作液160 μL及20 μL反应启动液,按说明书设置空白对照1、空白对照2、空白对照3,37 ℃孵育30 min;Varioskan LUX多通道酶标仪读取450 nm、600 nm处吸光度值,OD450nm-OD600nm读数即为实测读数A样本;抑制百分率=[(A空白1-A空白2)-(A样本-A空白3)]/(A空白1-A空白2),用BCA法测定样本蛋白浓度C样本,计算组织中SOD活力单位,SOD活力单位=[抑制百分率/(1-抑制百分率)]/ C样本。
1.3 统计学分析

2 结果
2.1 学习记忆能力
各组大鼠给药完成后进行Morris水迷宫测试,第1天~4天的定位航行实验结果(图1A)显示,Sham组大鼠的逃避潜伏期随实验天数增加而缩短,VaD组大鼠逃避潜伏期较Sham组长(P<0.01)、且随实验天数增加逃避潜伏期变化不明显;Nimodipine组、Low-NaSH组、High-NaSH组大鼠逃避潜伏期较VaD组大鼠短(P<0.01),且趋势与Sham组一致,但Low-NaSH组的逃避潜伏期较Nimodipine组及High-NaSH组长(P<0.01);第5天的空间探索实验结果显示(见图1 B~D),与Sham组比较,VaD组大鼠的逃避潜伏期显著延长、穿越平台次数显著减少、目标区域活动时间显著降低,差异有统计学意义(P<0.01);表明大鼠2-VO术后30 d学习记忆能力及定航能力下降;与VaD组比较,NaSH灌胃处理后大鼠的逃避潜伏期显著降低、穿越平台次数显著增加、目标区域活动时间显著延长,差异有统计学意义(P<0.01);与Low-NaSH组比较, High-NaSH组大鼠逃避潜伏期显著缩短、穿越平台次数显著增多、穿越目标区域活动时间显著增加,差异有统计学意义(P<0.01)。

注:A为第1~5天逃避潜伏期变化,B为逃避潜伏期,C为穿越平台次数,D为目标区域活动时间;(1)与假手术组比较,P<0.01;(2)与模型组比较,P<0.01;(3)与低剂量组比较,P<0.01图1 各组大鼠Morris水迷宫结果Fig.1 The effect of NaSh on learning and memory of rats with VaD
2.2 大鼠海马胞浆CytC表达
以β-actin做内参蛋白,用Western bolt方法检测各组大鼠海马胞浆蛋白中CytC表达(见图2),结果显示,与Sham组比较,VaD组CytC表达水平显著升高(P<0.01);与VaD组比较,Nimodipine组、High-NaSH组CytC表达水平显著降低(P<0.05),Low-NaSH 组降低最显著(P<0.01)。
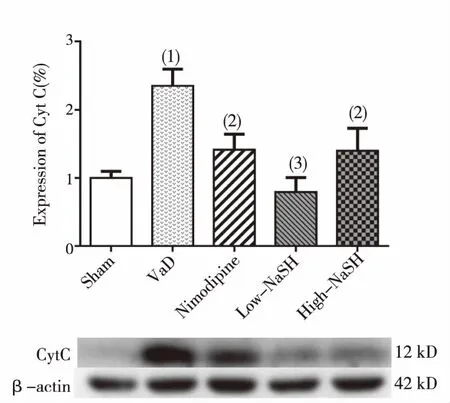
(1)与假手术组比较,P<0.01;(2)与模型组比较,P<0.05;(3)与模型组比较,P<0.01图2 各组大鼠海马胞浆CytC蛋白表达(Western bolt)Fig.2 The effect of NaSh on Cyt C expression
2.3 大鼠海马组织MDA含量
结果(见图3)显示,与Sham组比较,VaD组MDA含量显著升高,差异有统计学意义(P<0.01);与VaD组比较,Nimodipine组、Low-NaSH 组、High-NaSH组MDA含量显著降低,差异有统计学意义(P<0.01),High-NaSH组显著低于Low-NaSH 组,差异有统计学意义(P<0.05);提示NaSH对VaD大鼠的氧化应激损伤有保护作用。
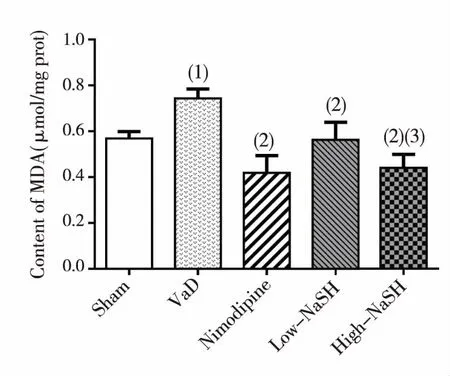
(1)与假手术组比较,P<0.01;(2)与模型组比较,P<0.01;(3)与低剂量组比较,P<0.01图3 各组大鼠脑组织中MDA含量(TBA法)Fig.3 The effect of NaSh on brain tissue MDA levels of rats with VaD
2.4 大鼠海马组织SOD酶活性
结果(见图4)显示,与比较,VaD组大鼠脑组织SOD酶活性显著升高,差异有统计学意义(P<0.01);与VaD组比较,Nimodipine组、Low-NaSH 组、High-NaSH组大鼠脑组织SOD酶活性显著降低,差异有统计学意义(P<0.01)。

(1)与假手术组比较,P<0.01;(2)与模型组比较,P<0.01图4 各组大鼠脑组织中SOD酶的活性(WST-8)Fig.4 The effect of NaSh on brain tissue SOD activity of rats with VaD
3 讨论
VaD患病人数占所有老年痴呆人数的15%,是最常见的老年期痴呆之一[8]。近年来,VaD的发病率随中国人口老龄化及生活节奏加快而逐年升高。缺血后慢性低灌注是VaD的常见诱因之一,脑卒中后的慢性低灌注导致脑血流量(cerebral blood flow,CBF)降低,缺氧导致氧化应激和引发炎症反应,氧化应激使血管内皮细胞,胶质细胞和神经细胞受损从而导致CBF进一步降低进一步减少,这些病理变化发生在大脑并导致VaD[9]。线粒体是细胞的能量发生器,在能量代谢、电子传递链及氧化磷酸化中起着至关重要的作用。同时还在氧自由基(reactive oxygen species,ROS)的产生中起主要作用,ROS是细胞信号传导和能量稳态的重要介质。线粒体膜电位有助于维持线粒体内膜和外膜的质子梯度,有助于腺苷三磷酸(adenosine triphosphate,ATP)的产生。在脑卒中后的慢性低灌注可引发神经系统中神经元细胞内的线粒体发生功能障碍[10]。线粒体损伤导致膜电位去极化,从而影响ATP的产生,造成氧化应激[11],导致细胞内脂质、蛋白质和DNA受损,激活各类促凋亡因子和凋亡因子[12],同时破坏ROS产生与细胞抗氧化酶的解毒和清除能力间的稳态,进一步级联放大脑组织内线粒体损伤并进一步加重缺血引起的组织损伤[13-14]。检测脂质过氧化的终产物MDA可以有效反映有机体中的氧化应激程度及自由基的含量。由于脑部结构的高脂质,它特别容易受到自由基介导的损伤从而产生脂质过氧化。缺血再灌注发生时线粒体膜通透性转换孔上的硫醇被氧自由基氧化而诱导开放从而导致线粒体膜电位发生去极化[15]。此时Cyt C从线粒体内释放至细胞浆中[16],并引发后续的神经细胞死亡[17]。SOD作为抗氧化酶之一,其活性具有清除ROS的能力,近期的很多研究表明心脏缺血、肝脏缺血、脑缺血均会导致SOD活性发生改变,且SOD酶活性与脑缺血所致的痴呆密切相关。近年来对VaD的发病机制的研究取得了很大的进展,但目前尚无对VaD的明确治疗方案。用抗氧化剂,抗炎剂或增加脑灌注的药剂治疗都未达到令人满意的结果。
本研究通过对SD大鼠进行双侧颈动脉永久性结扎制作2-VO法VaD动物模型。2-VO法可导致大鼠皮质区域整个CBF突然减少至35%~45%,并导致海马中CBF减少至60%[18-19],能最好的模拟人类衰老及卒中后发生的全脑慢性低灌注所致的VaD。从结果可以看出VaD大鼠的学习记忆能力及定航能力明显降低,且VaD大鼠脑组织中神经元细胞胞浆Cyt C表达量显著升高(P<0.01)、脑组织中MDA含量和SOD酶活性均显著升高(P<0.01)。这与VaD患者及中动脉闭塞VaD大鼠中血清及红细胞中SOD含量升高结果相似[20]。线粒体呼吸链酶易受脑缺血损伤,有研究发现在2-VO的VaD大鼠中,线粒体呼吸链复合酶活性降低,线粒体膜电位发生去极化,同时ROS含量升高[21],本研究结果也发现神经元胞浆中Cyt C表达量增加,提示大鼠脑缺血后大脑海马神经元细胞发生氧化应激且线粒体受到损伤。课题组前期研究发现VaD大鼠血浆H2S含量降低、学习记忆能力受损,NaSH处理后血浆及脑组织中H2S含量升高且学习记忆能力增强[22],但H2S改善VaD大鼠学习记忆能力的作用机制目前尚不明确。本研究结果显示NaSH灌胃处理后VaD大鼠的学习记忆能力及定航能力都得到改善,且大鼠脑组织中神经元细胞胞浆Cyt C表达量降低(P<0.05)、脑组织中MDA含量减少(P<0.01)、SOD酶活性降低(P<0.01),与阳性对照组趋势一致。推测NaSH可以通抑制脑缺血损伤造成的氧化应激,改善海马神经元中线粒体功能起到神经元保护作用,从而改善VaD大鼠的学习记忆能力。NaSH高低剂量组间比较,100 μmol/kg NaSH灌胃给药的NaSH高剂量组逃避潜伏期更短、穿越目标区域次数更多、目标区域停留时间更长(P<0.01),提示高剂量的NaSH对VaD大鼠的神经保护能力更强,且高剂量组脑组织中脂质氧化水平低于低剂量组(P<0.01)、说明高剂量NaSH处理能较好的降低VaD大鼠脑组织中氧化应激水平,但高剂量组海马胞浆中Cyt C表达量高于低剂量组,推测可能与大鼠神经细胞中线粒体的动态调节有关。
综上所述,NaSH作为外源性H2S的供体,可降低VaD大鼠脑组织的氧化应激程度,保护神经元细胞中线粒体功能,从而对神经元发挥保护作用,对于VaD的大鼠模型有很好的治疗作用。高剂量NaSH灌胃处理比低剂量NaSH对VaD大鼠学习记忆及定航能力有更好的改善作用,可能与高剂量NaSH能更好的改善VaD中线粒体损伤有关,但其中具体作用机制仍有待进一步研究。

