飞蝗LmGSTS2的酶学特性及其对马拉硫磷、 p,p’-DDT的代谢分析
马雯,刘娇,张学尧,申国华,秦雪梅,张建琴
飞蝗LmGSTS2的酶学特性及其对马拉硫磷、’-DDT的代谢分析
马雯1,刘娇2,张学尧2,申国华3,秦雪梅1,张建琴1
(1山西大学中医药现代研究中心,太原 030006;2山西大学应用生物学研究所,太原 030006;3山西省食品药品检验所,太原 030001)
【目的】将飞蝗()谷胱甘肽硫转移酶sigma2(glutathione--transferases sigma2,LmGSTS2)在大肠杆菌中原核表达后进行纯化,研究LmGSTS2的酶学特性,并分析其对马拉硫磷和’-DDT的代谢作用。结合飞蝗体内的RNA干扰及杀虫剂生物学测定,评估LmGSTS2对杀虫剂的代谢解毒能力,为飞蝗抗性治理及合理施药提供理论依据。【方法】将LmGSTS2在BL21(DE3)中表达,通过Ni-NTA亲和层析对LmGSTS2进行纯化,以CDNB为底物检测LmGSTS2在不同温度和pH条件下的酶活性变化。在最适条件下(pH=7,27℃),用纯化的LmGSTS2蛋白与马拉硫磷和’-DDT进行孵育,通过超高效液相色谱(UPLC)评估LmGSTS2对马拉硫磷和’-DDT的代谢解毒能力。进一步将3 μg ds注入2龄飞蝗若虫体内,24 h后检测目的基因的沉默效率,并结合杀虫剂生测试验分析飞蝗对杀虫剂敏感度的变化。【结果】将LmGSTS2在大肠杆菌中诱导表达,经SDS-PAGE检测后,发现与两个对照组pET28a/BL21(DE3)和未诱导的pET28a/BL21(DE3)-LmGSTS2相比,诱导后的pET28a/BL21(DE3)-LmGSTS2总蛋白在25 kD左右出现与目标蛋白大小相符的单一条带,表明LmGSTS2成功表达。对纯化后LmGSTS2蛋白的酶学特性研究结果表明,其最适反应pH范围为6—8,在pH=7时酶活性达到顶峰;最适反应温度范围为25—30℃,27℃时活性最高。在最适条件下,LmGSTS2分别与马拉硫磷和’-DDT进行孵育。UPLC结果显示,与3个对照组相比(GSH+insecticide、active LmGSTS2+insecticide及inactive LmGSTS2+GSH+ insecticide),LmGSTS2组马拉硫磷色谱峰面积分别降低83.6%、84.0%和84.6%,差异显著(<0.05),而’-DDT色谱峰面积与对照组相比无显著变化(>0.05),说明LmGSTS2可对马拉硫磷进行代谢,对’-DDT无代谢作用。进一步通过RNA干扰结合杀虫剂生测在飞蝗体内检测LmGSTS2蛋白对马拉硫磷的代谢解毒作用。将靶标基因的双链RNA注入2龄飞蝗若虫体内,24 h后可使飞蝗体内表达量抑制96%。飞蝗对马拉硫磷的敏感度检测发现,与对照组相比,基因沉默后飞蝗对马拉硫磷的敏感度增加,死亡率由29.9%上升至45.2%,表明LmGSTS2参与了马拉硫磷在体内的代谢解毒过程。【结论】将LmGSTS2在体外进行表达纯化,并以CDNB为底物检测到该酶最适反应条件为pH=7,27℃左右;对马拉硫磷的体内和体外检测结果显示,LmGSTS2参与马拉硫磷在飞蝗体内的代谢解毒过程;对’-DDT的体外研究结果显示该酶不参与’-DDT的代谢。
飞蝗;杀虫剂;谷胱甘肽硫转移酶;超高效液相色谱;RNA干扰
0 引言
【研究意义】飞蝗()是一类重要的农业害虫,主要以禾本科和莎草科植物(如小麦、水稻等)为食,严重危害我国中西部地区农业生产[1]。在控制蝗灾过程中,不同种类杀虫剂的使用,不仅污染了农作物及环境,而且杀虫剂残留还会影响人类健康,同时使飞蝗对杀虫剂的抗性逐渐增强[2]。马拉硫磷(malathion)为一种高效、低毒的有机磷杀虫剂,在农业生产中被广泛使用[3];滴滴涕(chlorophenothane,DDT)为一种高效、高毒的有机氯杀虫剂,由于其不易降解,目前已禁止在农业生产中应用,但其在土壤等环境的残留已导致中药材中有机氯农药的残留[4]。课题组前期研究表明,飞蝗马拉硫磷抗性品系的谷胱甘肽硫转移酶(glutathione-- transferases,GST,E.C.2.5.1.18)的活性显著提高[5]。谷胱甘肽硫转移酶是一类重要的Ⅱ相代谢酶,可参与昆虫体内物质代谢及生理功能的调节[6]。昆虫GST的存在部位主要为脂肪体、中肠、表皮、马氏管等组织内,其在重要解毒器官等组织中特异地高表达提示GST存在潜在的解毒功能[7-9]。大量的研究表明,昆虫体内GST可以通过脱氯化氢作用,将高毒的DDT代谢为无毒的DDE,以减小DDT对昆虫机体的毒害作用。因此,明确飞蝗体内解毒酶GST对杀虫剂的代谢特性,一方面对于建立新型的害虫防治体系、促进环境绿色友好及可持续发展具有重要意义[10],另一方面对于开发基于解毒酶的基因工程菌用于中药材农残脱除技术研究具有重要意义[4]。【前人研究进展】基于GST家族基因的序列相似性、底物特异性和免疫学特性,昆虫GST分为6类:sigma、epsilon、delta、theta、omega和zeta[11-13]。目前已经报道多种sigma、epsilon和delta家族的GST广泛参与昆虫对多种杀虫剂的代谢过程[14-16]。RIVERON等将不吉按蚊()GSTe2在果蝇中过表达后,增强了果蝇对DDT和氯菊酯的抗性,通过体外表达及纯化证实GSTe2可直接对氯菊酯进行代谢,并通过L119F点突变进一步证实了GSTe2对于DDT的解毒功能[17];LUMJUAN等发现埃及伊蚊()中GSTe2和GSTe5具有脱氯化氢酶活性,可将DDT代谢为无毒的DDE;通过RNAi技术证实GSTe7和GSTe2可能参与了拟除虫菊酯杀虫剂的代谢过程[18]。目前飞蝗中已知的GST共有32个,其中胞质GST共28个,包括10个sigma家族GST,5个epsilon家族GST,7个delta家族GST,3个omega家族GST,2个theta家族GST和1个zeta家族GST[7]。QIN等用溴氰菊酯处理飞蝗48 h后检测其体内GST表达量发现多种sigma家族GST表达量均上调,说明sigma家族GST很可能共同参与了飞蝗体内溴氰菊酯的代谢解毒[19]。另外,通过RNAi沉默后,飞蝗对于马拉硫磷和西维因的敏感度增加,死亡率分别上升28%和26%;沉默后,西维因对其致死率上升38.7%,表明sigma家族GST可能参与马拉硫磷和西维因的解毒过程[20-21]。【本研究切入点】sigma家族GST在各类杀虫剂的代谢解毒过程中均不同程度发挥着作用,但飞蝗中尚缺乏对GST解毒酶体内和体外代谢解毒能力的系统研究。ZHANG等[7]通过RT-qPCR研究发现(HM131837.1)在中肠、马氏管和脂肪体等负责消化和解毒的组织中表达量最高,因此,本文选择飞蝗sigma家族中的LmGSTS2(AEB91974.1)进行研究,将其在体外表达并纯化,通过超高效液相色谱(ultra performance liquid chromatography,UPLC)检测LmGSTS2对杀虫剂马拉硫磷和’-DDT的代谢能力,并在飞蝗体内对该结果进行验证。【拟解决的关键问题】LmGSTS2表达后,探索合适的纯化条件获得高纯度的蛋白,利用超高效液相色谱分别对马拉硫磷及’-DDT进行检测,分析LmGSTS2对杀虫剂的代谢能力。进一步通过RNAi沉默飞蝗体内的,检测其对杀虫剂的敏感度变化,从而通过体内、体外试验系统阐明LmGSTS2对杀虫剂的代谢解毒作用。
1 材料与方法
试验于2017—2018年在山西大学中医药现代研究中心及应用生物学研究所完成。
1.1 仪器、材料与试剂
仪器:ÄKTATMpure蛋白纯化系统购于GEHealthcare公司;Synergy MX Microplate Reader酶标仪购于BioTek公司;1290 Ⅱ超高效液相色谱仪购于Agilent公司;LightCycler®480购于ROCHE公司。材料:pET28a/BL21(DE3)-LmGSTS2质粒为实验室前期构建[22]。试剂:T7 RNA合成试剂盒购于NEB公司;SYBR®Green real-time PCR Master Mix购于TOYOBO公司;2×Taq PCR Master Mix购于天根公司;马拉硫磷、’DDT标准品购于CATO公司。
1.2 LmGSTs2的原核表达及纯化
将保存菌液划线于固体LB培养基中复苏。复苏后,挑取单菌落接种于液体LB培养基(含50 μg·mL-1卡那霉素)试管中,在37℃、200 r/min的振荡培养箱中培养14—16 h,作为种子菌液。按1﹕100的比例吸取种子菌液接种于液体LB培养基中(含50 μg·mL-1卡那霉素),置于37℃培养至OD600≈0.6,加入IPTG(终浓度为0.5 mmol·L-1),置于16℃培养,诱导目标蛋白大量表达;20 h后,离心收集菌体沉淀,经PBS(文中PBS均为0.1 mol·L-1,pH 7.0)清洗3遍;加入PBS 20 mL,置于冰上超声破碎至溶液透亮。12 000 r/min,4℃离心30 min,收集上清即为粗酶液。
经SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定LmGSTS2成功表达后,使用HisTrap FF预装柱,通过ÄKTATMpure蛋白纯化系统进行纯化。用含有不同浓度咪唑(60—250 mmol·L-1)的缓冲液洗脱。对粗蛋白及不同洗脱组分进行电泳检测,对含有较单一目的条带的洗脱组分通过PBS缓冲液进行超滤,-20℃冻存备用。
1.3 LmGSTS2的最适条件测定
1.3.1 酶活性测定 按照HABIG等[23]的方法进行LmGSTS2活性测定。取10 μL待测酶液与190 μL混合液(5 mmol·L-1GSH﹕200 mmol·L-1CDNB=188﹕2),立即用酶标仪在340 nm处记录OD值(每隔 10 s计数,共计数1 min)。10 μL PBS缓冲液作为空白对照,样品测定时设置3个重复。CDNB的摩尔消光系数为ε340=9.6 mmol·L-1·cm-1。
1.3.2 pH对LmGSTS2活性的影响 配制pH 为3—9的缓冲液,参照1.3.1以CDNB为底物测定LmGSTs2在不同pH缓冲液中的活性。以PBS作为空白对照,样品测定时设置3个重复。
1.3.3 温度对LmGSTS2活性的影响 取LmGSTs2酶液分装于多个PCR管内,分别置于20、30、40、50、60℃恒温水浴锅中保温30 min,4℃保存。参照1.3.1测定不同温度处理后LmGSTS2活性。样品测定时设置3个重复。
1.4 LmGSTS2对马拉硫磷和p,p’-DDT的代谢检测
1.4.1 超高效液相色谱方法的建立 样品检测色谱条件见表1。两种杀虫剂洗脱方式均为等度洗脱,流动相A为乙腈,B为0.1%甲酸水。
1.4.2 重组LmGSTS2蛋白对不同杀虫剂的代谢解毒功能分析 样品分为A、B、C和D 4组。A组为正常反应组(active LmGSTS2+GSH+insecticide);B组以PBS缓冲液代替蛋白,为无蛋白对照组(GSH+ insecticide);C组为不含GSH的对照组(active LmGSTS2+insecticide);D组将煮沸后的蛋白作为对照组(inactive LmGSTS2+GSH+insecticide)。混匀后,置于27℃,1 200 r/min,温育3 h;反应结束后加入400 μL乙腈,27℃,1 200 r/min,温育5 min终止反应;将样品于13 000 r/min,室温离心20 min,取上清液经0.22 μm微孔滤膜过滤后转移至1.5 mL色谱瓶,参照1.4.1方法进行检测。每个样品均平行制备3份,之后对不同组杀虫剂峰面积变化通过Student’s-test进行显著性分析。每组样品制备时设置2个重复。
1.5 LmGSTs2基因沉默后飞蝗对马拉硫磷的敏感度分析
1.5.1PCR扩增及dsRNA合成 根据已知的基因序列,使用Primer Premier5.0 软件设计dsRNA合成引物及RT-qPCR引物,引物的详细信息见表2,所有引物均由生工生物公司合成。
以含有目的基因全长cDNA 序列的菌液为模板,以dsRNA引物扩增双链DNA。取PCR产物,在1%的琼脂糖凝胶电泳检测目的片段大小,并进行回收纯化。参照T7 RNA合成试剂说明书合成ds,将其浓度调整为1.5 μg·μL-1左右,备用。

表1 超高效液相色谱检测杀虫剂条件

表2 LmGSTs2 dsRNA引物及RT-qPCR引物序列
小写字母表示T7启动子 The lowercases indicate T7 promoters
1.5.2 ds24 h干扰效率检测 选取飞蝗2龄第3天大小均一、健康状况良好的若虫为试虫。使用微量注射器沿第2—3腹节节间膜处注射,试验组注射2 μL(3 μg)目的基因dsRNA,对照组注射2 μL ddH2O,每组注射12头若虫,24 h后收集飞蝗,3头为一个生物学重复,共4个生物学重复。提取RNA通过RT-qPCR检测ds沉默效率。
RT-qPCR反应体系(20 μL):4.0 μL cDNA(10倍稀释),上、下游引物各0.4 μmol·L-1,10 μL SYBR®Green real-time PCR Master Mix,其余体积以ddH2O补足。反应程序:95℃ 1 min;40 cycles:95℃ 15 s,60℃ 31 s;95℃ 1 min,55℃ 1 min,97℃ continuous;37℃ 30 s。内参基因为。
1.5.3 ds沉默后飞蝗对马拉硫磷敏感度变化检测 试验分为两组:对照组(注射2 μL ddH2O),试验组(注射3 μg ds),每组注射50头2龄若虫,每个生物学重复12—14头,共3个生物学重复。在注射dsRNA后的24 h,使用移液枪在虫体腹部侧面第2—3腹节的右侧点滴马拉硫磷(0.1 mg·mL-1)3 μL。点滴杀虫剂后的24 h,记录各组虫体死亡数。采用Student’s-test对数据进行统计分析。
2 结果
2.1 LmGSTS2的原核表达及纯化
采用SDS-PAGE法检测LmGSTS2的表达,结果显示相对于BL21(DE3)感受态细胞、转染pET-28a空载体的BL21(DE3)感受态细胞及未诱导的pET28a/ BL21(DE3)-LmGSTS2,诱导后的pET28a/BL21(DE3)- LmGSTS2在25 kD左右出现一条明显的条带(黑色箭头所指位置),为LmGSTS2目的条带(图1-A)。
Ni-NTA亲和层析不同洗脱组分电泳结果显示,在纯化时,泳道2(过柱穿透液)中无目的条带,说明LmGSTS2基本与Ni柱完全结合;经不同浓度咪唑缓冲液洗脱后,杂蛋白主要在60—200 mmol·L-1咪唑缓冲液洗脱组分(3—8泳道)中洗脱,目标蛋白(黑色箭头所指位置)在250 mmol·L-1咪唑缓冲液洗脱组分(9—12泳道)中洗脱,条带单一,可用于后续活性检测(图1-B)。

M:10—180 kD蛋白分子量标准 10-180 kD protein molecular weight standards。A:LmGSTS2的表达 Expression of LmGSTS2。1:BL21(DE3);2:pET28a/BL21(DE3);3:未诱导pET28a/BL21(DE3)-LmGSTS2 pET28a/BL21(DE3)-LmGSTS2before induction;4:诱导后的pET28a/BL21(DE3)-LmGSTS2 pET28a/BL21(DE3)-LmGSTS2after induction。B:LmGSTS2的纯化 Purification of LmGSTS2。 1:未纯化的LmGSTS2总蛋白Total protein of LmGSTS2 before purification;2:过柱穿透液 Flow through fraction;3—12:不同浓度咪唑缓冲液洗脱组分Elution components with different concentrations of imidazole buffer
2.2 LmGSTS2酶活性的最适条件测定
将纯化后的蛋白通过超滤进行脱除咪唑及NaCl,以1-氯-2,4-二硝基苯(1-chloro-2,4-dinitrobenzene,CDNB)为底物研究LmGSTS2在不同条件下的酶活性变化,用OriginPro 8.0进行曲线拟合(采用B-Spline连接方式),其结果见图2。由图2-A可知,LmGSTS2最适pH范围为6—8,pH=7时活性最高。在pH<5时几乎没有活性,pH介于5—7时随着pH的上升活性逐渐升高,pH>7时随着pH的上升酶活性逐渐降低。由图2-B可知,在25—30℃LmGSTS2活性较高,27℃左右时活性最高,温度>30℃时活性逐渐降低,在50℃时几乎完全丧失活性。因此,LmGSTS2的最适反应条件为pH=7,27℃左右。
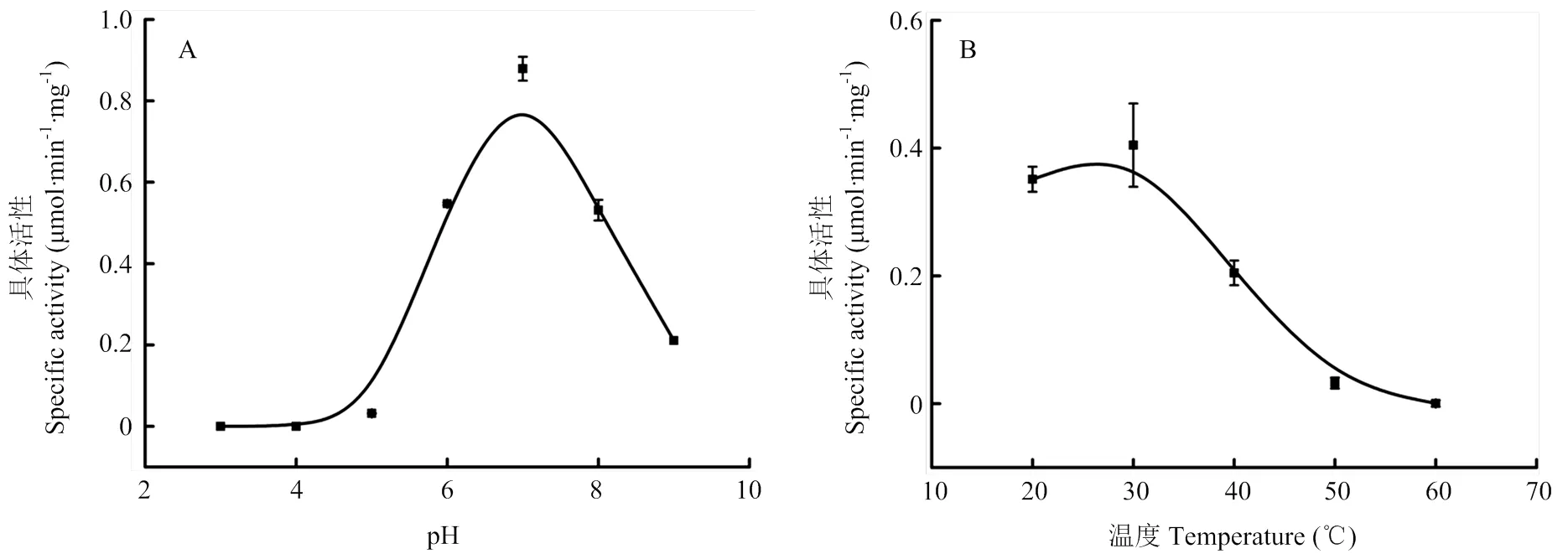
图2 不同条件下LmGSTS2活性变化
2.3 LmGSTS2对杀虫剂的代谢检测
将LmGSTS2与马拉硫磷反应,通过UPLC检测不同组别代谢物。与对照组B—D相比,A组中马拉硫磷色谱峰降低(保留时间2.13 min)(图3),且A组峰面积分别降低83.6%、84.0%和84.6%,差异显著(<0.05)(表3)。而B、C和D 3组间马拉硫磷峰面积均无明显变化,说明在3 h反应时间内,LmGSTS2和GSH共同作用,可将大部分马拉硫磷代谢。但在色谱图中未发现产物峰。
将LmGSTS2与’-DDT反应,通过UPLC检测不同组别代谢物。与对照组B—D相比,A组中’-DDT(保留时间3.14 min)峰无明显差异,且没有新的产物峰出现(图4),各组间峰面积无显著变化,表明LmGSTS2不代谢’-DDT(表3)。
2.4 LmGSTs2基因沉默后飞蝗对马拉硫磷敏感度分析
向2龄飞蝗若虫注射3 μg ds,24 h后检测其沉默效率,结果显示与对照组相比,处理组表达量显著降低,目标基因的沉默效率达96%(图5-A)。
沉默飞蝗体内的后,点滴马拉硫磷, 24 h后检测飞蝗敏感度变化,结果显示靶标基因沉默后,飞蝗死亡率由29.9%上升至45.2%(图5-B)。

A: active LmGSTS2+GSH+malathion; B: GSH+malathion; C: active LmGSTS2+ malathion; D: inactive LmGSTS2+GSH+malathion

表3 不同组间杀虫剂色谱峰面积
表中数值为平均值±标准误(=3),*表示与A组相比差异显著(<0.05)
Data in the table are mean±SE (=3). * indicates significantly different compared with group A (<0.05)
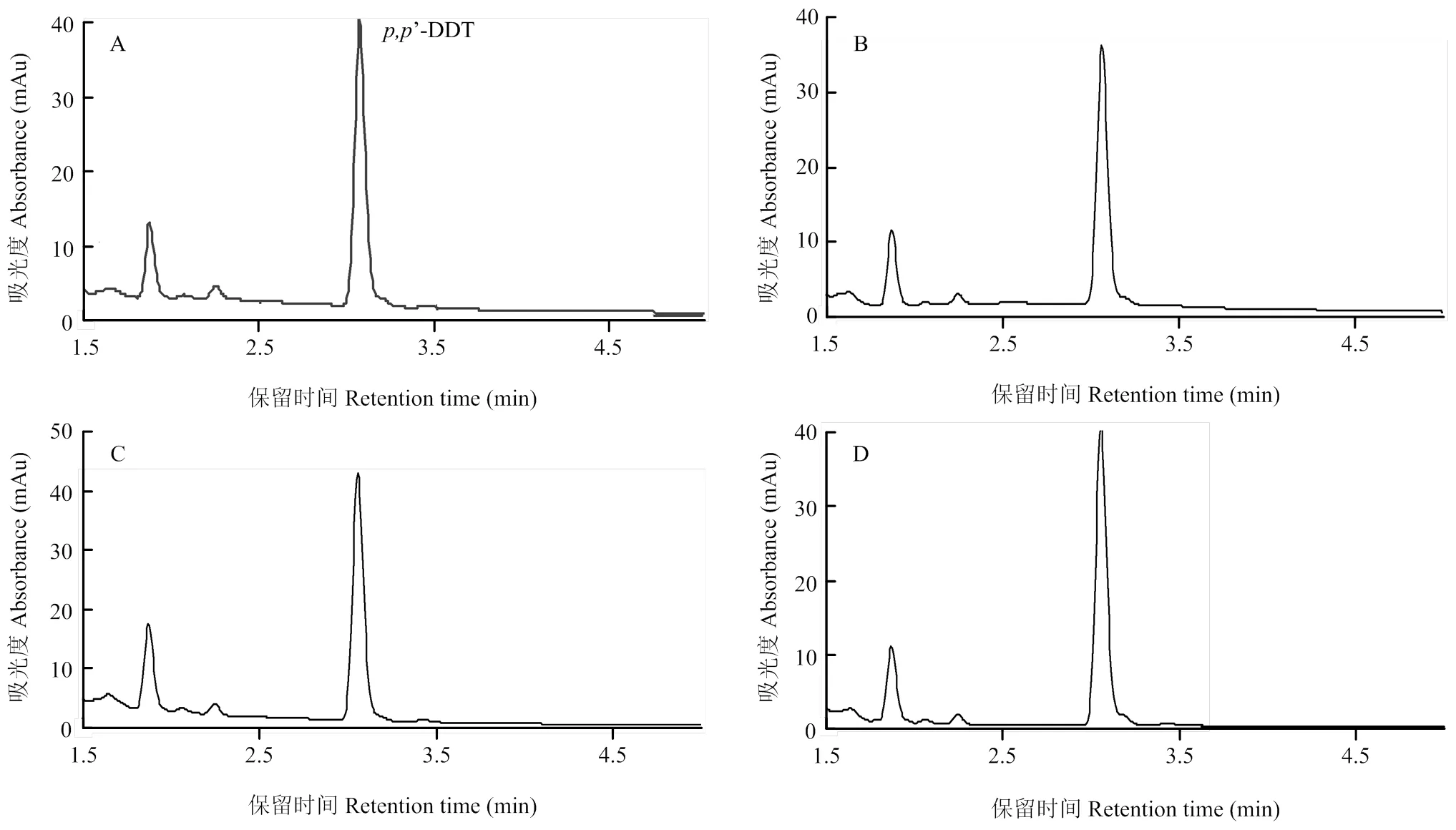
A: Active LmGSTS2+GSH+ p,p’-DDT; B: GSH+ p,p’-DDT; C: Active LmGSTS2+ p,p’-DDT; D: Inactive LmGSTS2+GSH+ p,p’-DDT

A:dsLmGSTs2沉默效率 Silencing efficiency of dsLmGSTs2。**: P<0.01 (t-test);B:飞蝗对马拉硫磷敏感度分析 Sensitivity of L. migratoria to malathion。*: P<0.05 (t-test)
3 讨论
解毒酶在体外超表达对于更好地研究酶学性质及其对杀虫剂的代谢作用具有重要意义。WAN等[24]将甜菜夜蛾()中的SeGSTe在体外进行表达,发现重组后的SeGSTe对重金属Cu2+和Cd2+敏感,且酶活性被多种农药显著抑制,进而推测SeGSTe可能参与体内的氧化应激及杀虫剂的解毒过程;LIAO等[25]将柑橘全爪螨()中的PcGSTm5在体外进行原核表达后,确定其对CDNB及GSH具有代谢活性,并通过dsRNA干扰试验进一步验证了表达与杀虫剂阿维菌素(abamectin)抗性间的相关性;ZHANG等[7]对飞蝗LmGSTS2的前期研究中,检测了LmGSTS2在不同底物下的活性及其组织分布,发现在中肠、马氏管和脂肪体等具有消化和解毒的组织中表达量最高,推测LmGSTS2可能参与飞蝗体内和体外物质代谢。为进一步深入阐明LmGSTS2对农药的代谢作用,本研究将LmGSTS2成功在大肠杆菌中表达,通过Ni-NTA亲和层析获得单一的LmGSTS2蛋白,分析了酶的最适反应条件,研究了LmGSTS2对马拉硫磷和’-DDT等杀虫剂的代谢作用,并通过RNAi结合马拉硫磷生物学测定,进一步在飞蝗体内验证了LmGSTS2对马拉硫磷的代谢解毒特性。
经IPTG诱导后,LmGSTS2成功表达。通过Ni-NTA亲和层析纯化获得单一的目的条带。对其在不同条件下的活性进行检测发现,LmGSTS2在pH=7,27℃左右时活性最高。飞蝗的体液pH为7.0左右,最适生长温度为28—30℃,其生活条件为体内酶发挥作用提供了最适条件。QIN等[20]对LmGSTs5的酶学特性研究发现,其最适反应pH为6—9,温度为20—40℃;李帅等[26]检测到梨小食心虫()中GmolGST6在pH=7.5和40℃时活性最高;HIROWATARI等[27]检测到斜纹夜蛾()中SlituGST7和SlituGST20的最适反应范围为pH 6—8,30—50℃。不同物种间GST最适反应条件不同,可能与昆虫自身生理条件及蛋白的组织分布相关。
目前杀虫剂代谢检测方式主要有液相、气相及色谱-质谱联用技术[28-31],本研究将纯化的LmGSTS2蛋白在体外分别与马拉硫磷和’-DDT进行孵育,通过超高效液相色谱对反应物进行检测。结果表明,LmGSTS2可代谢马拉硫磷,但不能代谢’-DDT。进一步通过RNAi沉默后,飞蝗对马拉硫磷的敏感度增加15.3%,表明LmGSTS2参与马拉硫磷在飞蝗体内的代谢解毒过程,从飞蝗体内验证了体外代谢的结果。GST参与外源及内源毒性物质代谢作用主要分为4种:(1)GST可以催化GSH与杀虫剂的结合,生成毒性较小的可溶性缀合物[32-33]。NAKKA等[34]通过HPLC检测发现长芒苋()中的GST可催化GSH与阿拉特津结合生成缀合物,从而对除草剂表现出抗性;(2)GSH作为辅助因子可特异性地催化DDT直接代谢为无毒DDE,从而完成对DDT的解毒[35-36],WANG等[35]发现冈比亚按蚊()中的agGSTe2具有DDT代谢活性,agGSTe2结合GSH后对DDT发起亲核攻击将其代谢为DDE从而消除毒性;(3)GST可以减少由杀虫剂摄入引起的氧化应激所产生的有毒过氧化物,因而表现出过氧化物酶特性[37]。LUMJUAN等[38]发现埃及伊蚊()重组后的GSTE2-2酶除了参与杀虫剂解毒作用之外,还可参与脂质过氧化终产物的代谢,具有过氧化物酶活性;(4)GST可通过结合并包裹杀虫剂,从而使昆虫产生抗药性[11,18]。本研究中,LmGSTS2对马拉硫磷代谢过程中未检测到产物生成,可能是目前采用的色谱条件不适合马拉硫磷代谢产物的分离,后续需进一步对色谱条件进行优化进而鉴定产物。GONZALEZ等[39]对黑腹果蝇()中GSTD2进行蛋白结晶及结构解析,通过分子对接模拟分析了天然杀虫剂异硫氰酸酯(isothiocyanates,ITC)与GSTD2三维结构的相互作用;LOW等[40]通过蛋白晶体结构分析预测了黑腹果蝇中GSTD1、GSH与DDT的作用位点,并通过二维核磁共振1H、15N对结合前后构象进行解析,从而阐明GSTD1、GSH与DDT的作用方式。因此,在今后的研究中,将通过蛋白晶体结构解析,进一步阐明LmGSTS2对马拉硫磷的代谢解毒机制。
4 结论
将LmGSTS2在体外进行表达纯化,并以CDNB为底物检测到该酶最适反应条件为pH=7,27℃左右,该条件与飞蝗体内环境较为一致,表明飞蝗体内环境为酶发挥作用提供了最适条件;通过超高效液相色谱分析表明LmGSTS2可代谢马拉硫磷,进一步RNAi和杀虫剂的生测试验结果显示基因沉默后飞蝗对马拉硫磷的敏感度增加,表明在飞蝗体内LmGSTS2对马拉硫磷具有一定的代谢作用。据此分析,LmGSTS2对马拉硫磷的代谢活性可能是飞蝗对马拉硫磷产生抗药性的原因之一。研究结果可为飞蝗抗性治理和合理施用杀虫剂提供重要依据。
[1] 张龙. 国内外蝗害治理技术现状与展望. 应用昆虫学报, 2011, 48(4): 804-810.
ZHANG L. Advances and prospects of strategies and tactics of locust and grasshopper management., 2011, 48(4): 804-810. (in Chinese)
[2] NAQQASH M N, GÖKÇE A, BAKHSH A, SALIM M. Insecticide resistance and its molecular basis in urban insect pests., 2016, 115(4): 1363-1373.
[3] YANG M L, ZHANG J Z, ZHU K Y, XUAN T, LIU X J, GUO Y P, MA E B. Mechanisms of organophosphate resistance in a field population of oriental migratory locust,(Meyen)., 2009, 71(1): 3-15.
[4] 马雯, 薛晓利, 秦雪梅, 张建琴. 中药材农药残留及脱除方法研究进展. 中草药, 2018, 49(3): 745-753.
MA W, XUE X L, QIN X M, ZHANG J Q. Research progress on pesticide residues in Chinese medicinal materials and pesticide removal methods., 2018, 49(3): 745-753. (in Chinese)
[5] CHEN X D, GILL T A, NGUYEN C D, KILLINY N, PELZ- STELINSKI K S, STELINSKI L L. Insecticide toxicity associated with detoxification enzymes and genes related to transcription of cuticular melanization among color morphs of Asian citrus psyllid., 2018, doi: 10.1111/1744-7917.12582.
[6] 杨海灵, 聂力嘉, 朱圣庚, 周先碗. 谷胱甘肽硫转移酶结构与功能研究进展. 成都大学学报(自然科学版), 2006, 25(1): 19-24.
YANG H L, NIE L J, ZHU S G, ZHOU X W. Structure and catalytic mechanism of the glutathione transferases., 2006, 25(1): 19-24. (in Chinese)
[7] ZHANG X Y, WANG J X, ZHANG M, QIN G H, LI D Q, ZHU K Y, MA E B, ZHANG J Z. Molecular cloning, characterization and positively selected sites of the glutathione--transferase family from., 2014, 9(12): e114776.
[8] 余泉友. 家蚕谷胱甘肽-S-转移酶基因的功能研究[D]. 重庆: 西南大学, 2008.
YU Q Y. Study on the glutathione S-transferase superfamily in the silkworm,[D]. Chongqing: Southwest University, 2008. (in Chinese)
[9] 宣涛. 东亚飞蝗谷胱甘肽S-转移酶基因克隆、基因表达及蛋白纯化[D]. 太原: 山西大学, 2009.
XUAN T. Gene clone, gene expression and protein purification of glutathione-transferase in(Meyen)[D]. Taiyuan: Shanxi University, 2009. (in Chinese)
[10] 黄菁, 乔传令. 昆虫解毒酶解毒机理及其在农药污染治理中的应用. 农业环境保护, 2002, 21(3): 285-287.
HUANG J, QIAO C L. Mechanism and application of insect detoxification enzyme in bioremediation of pesticide contamination., 2002, 21(3): 285-287. (in Chinese)
[11] ENAYATI A A, RANSON H, HEMINGWAY J. Insect glutathione transferases and insecticide resistance., 2005, 14(1): 3-8.
[12] 房守敏. 昆虫谷胱甘肽-S-转移酶的基因组学研究及其介导的抗药性. 蚕学通讯, 2010, 30(4): 28-35.
FANG S M. Genomic studies of glutathione S-transferase in insects and insecticide resistance mediated by it., 2010, 30(4): 28-35. (in Chinese)
[13] 张学尧, 王建新, 郭艳琼, 张建珍, 马恩波. 飞蝗谷胱甘肽-转移酶基因克隆、序列分析及表达特征. 昆虫学报, 2012, 55(5): 520-526.
ZHANG X Y, WANG J X, GUO Y Q, ZHANG J Z, MA E B. Cloning, sequence analysis and expression profiling of glutathione-transferase omega 1 gene from(Orthoptera: Acridoidea)., 2012, 55(5): 520-526. (in Chinese)
[14] XU Z B, ZOU X P, Zhang N, Feng Q L, Zheng S C. Detoxification of insecticides, allechemicals and heavy metals by glutathione-transferase SlGSTE1 in the gut of., 2015, 22(4): 503-511.
[15] MATZKIN L M. The molecular basis of host adaptation in cactophilic Drosophila: molecular evolution of a glutathione-transferase gene () in., 2008, 178(2): 1073-1083.
[16] HAN J B, LI G Q, WAN P J, ZHU T T, MENG Q W. Identification of glutathione S-transferase genes inand their expression patterns under stress of three insecticides., 2016, 133: 26-34.
[17] RIVERON J M, YUNTA C, IBRAHIM S S, DJOUAKA R, IRVING H, MENZE B D, ISMAIL H M, HEMINGWAY J, RANSON H, ALBERT A, WONDJI C S. A single mutation in thegene allows tracking of metabolically based insecticide resistance in a major malaria vector., 2014, 15(2): R27.
[18] LUMJUAN N, RAJATILEKA S, CHANGSOM D, WICHEER J, LEELAPAT P, PRAPANTHADARA L A, SOMBOON P, LYCETT G, RANSON H. The role of theEpsilon glutathione transferases in conferring resistance to DDT and pyrethroid insecticides., 2011, 41(3): 203-209.
[19] QIN G H, JIA M, LIU T, XUAN T, ZHU K Y, GUO Y P, MA E B, ZHANG J Z. Identification and characterization of ten glutathione-transferase genes from oriental migratory locust,(Meyen)., 2011, 67(6): 697-704.
[20] QIN G H, JIA M, LIU T, ZHANG X Y, GUO Y P, ZHU K Y, MA E B, ZHANG J Z. Characterization and functional analysis of four glutathione-transferases from the migratory locust,., 2013, 8(3): e58410.
[21] QIN G H, JIA M, LIU T, ZHANG X Y, GUO Y P, ZHU K Y, MA E B, ZHANG J Z. Heterologous expression and characterization of a sigma glutathione-transferase involved in carbaryl detoxification from oriental migratory locust,(Meyen)., 2012, 58(2): 220-227.
[22] 王建新. 飞蝗谷胱甘肽硫转移酶基因克隆及表达特征[D]. 太原: 山西大学, 2013.
WANG J X. Gene clone and characterization analysis of glutathione-transferase from[D]. Taiyuan: Shanxi University, 2013. (in Chinese)
[23] HABIG W H, PABST M J, JAKOBY W B. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation., 1974, 249(22): 7130-7139.
[24] WAN H, ZHAN S, XIA X, XU P, YOU H, JIN B R, LI J. Identification and functional characterization of an epsilon glutathione-transferase from the beet armyworm ()., 2016, 132: 81-88.
[25] LIAO C Y, XIA W K, FENG Y C, LI G, LIU H, DOU W, WANG J J. Characterization and functional analysis of a novel glutathione-transferase gene potentially associated with the abamectin resistance in(McGregor)., 2016, 132: 72-80.
[26] 李帅, 苏丽, 李伯辽, 李怡萍, 李广伟, 仵均祥. 梨小食心虫谷胱甘肽-转移酶GmolGST6的基因克隆、原核表达和酶学特征. 昆虫学报, 2018, 61(4): 398-409.
LI S, SU L, LI B L, LI Y P, LI G W, WU J X. cDNA cloning, prokaryotic expression and enzymatic characteristics of the glutathionetransferase GmolGST6 in(Lepidoptera: Tortricidae)., 2018, 61(4): 398-409. (in Chinese)
[27] HIROWATARI A, CHEN Z, MITA K, YAMAMOTO K. Enzymatic characterization of two epsilon-class glutathione-transferases of., 2018, 97(3): e21443.
[28] 王岙, 高茜, 王晓丽, 徐自力, 李鱼. 高效液相色谱法同时测定水体中马拉硫磷和阿特拉津. 吉林大学学报(理学版), 2008, 46(1): 157-161.
WANG A, GAO Q, WANG X L, XU Z L, LI Y. Simultaneous determination of malathion and atrazine in water by high performance liquid chromatography., 2008, 46 (1): 157-161. (in Chinese)
[29] SAAFAN A E, AZMY A F, AMIN M A, AHMED S H, ESSAM T M. Isolation and characterization of two malathion-degradingsp. in Egypt., 2016, 15(31): 1661-1672.
[30] TONG Z, WU Y C, LIU Q Q, SHI Y H, ZHOU L J, LIU Z Y, YU L S, CAO H Q. Multi-residue analysis of pesticide residues in crude pollens by UPLC-MS/MS., 2016, 21(12): 1652.
[31] GIL GARCÍA M D, MARTÍNEZ GALERA M, UCLÉS S, LOZANO A, FERNÁNDEZ-ALBA A R. Ultrasound-assisted extraction based on QuEChERS of pesticide residues in honeybees and determination by LC-MS/MS and GC-MS/MS., 2018, 410(21): 5195-5210.
[32] YAMAMOTO K, YAMADA N. Identification of a diazinon- metabolizing glutathione-transferase in the silkworm,., 2016, 6: 30073.
[33] PAVLIDI N, KHALIGHI M, MYRIDAKIS A, DERMAUW W, WYBOUW N, TSAKIRELI D, STEPHANOU E G, LABROU N E, VONTAS J, VAN LEEUWEN T. A glutathione--transferase (TuGSTd05) associated with acaricide resistance indirectly metabolizes the complex II inhibitor cyflumetofen., 2017, 80: 101-115.
[34] NAKKA S, GODAR A S, THOMPSON C R, PETERSON D E, JUGULAM M. Rapid detoxification via glutathione-transferase (GST) conjugation confers a high level of atrazine resistance in Palmer amaranth ()., 2017, 73(11): 2236-2243.
[35] WANG Y, QIU L, RANSON H, LUMJUAN N, HEMINGWAY J, SETZER W N, MEEHAN EJ, CHEN L. Structure of an insect epsilon class glutathione-transferase from the malaria vectorprovides an explanation for the high DDT- detoxifying activity., 2008, 164(2): 228-235.
[36] ARAVINDAN V, MUTHUKUMARAVEL S, GUNASEKARAN K. Interaction affinity of Delta and Epsilon class glutathione-s- transferases (GSTs) to bind with DDT for detoxification and conferring resistance in, a malaria vector., 2014, 51(1): 8-15.
[37] YAMAMOTO K, NAGAOKA S, BANNO Y, ASO Y. Biochemical properties of an omega-class glutathione S-transferase of the silkmoth,., 2009, 149(4): 461-467.
[38] LUMJUAN N, MCCARROLL L, PRAPANTHADARA L A, HEMINGWAY J, RANSON H. Elevated activity of an Epsilon class glutathione transferase confers DDT resistance in the dengue vector,, 2005, 35(8): 861-871.
[39] GONZALEZ D, FRAICHARD S, GRASSEIN P, DELARUE P, SENET P, NICOLAÏ A, CHAVANNE E, MUCHER E, ARTUR Y, FERVEUR J F, HEYDEL J M, BRIAND L, NEIERS F. Characterization of aglutathione transferase involved in isothiocyanate detoxification., 2018, 95: 33-43.
[40] LOW W Y, FEIL S C, NG H L, GORMAN M A, MORTON C J, PYKE J, MCCONVILLE M J, BIERI M, MOK Y F, ROBIN C, GOOLEY P R, PARKER M W, BATTERHAM P. Recognition and detoxification of the insecticide DDT byglutathione-transferase D1., 2010, 399(3): 358-366.
Enzymatic Characteristics and Metabolic Analysis to Malathion and’-DDT of LmGSTS2 from
MA Wen1, LIU Jiao2, ZHANG XueYao2, SHEN GuoHua3, QIN XueMei1, ZHANG JianQin1
(1Modern Research Center For Traditional Chinese Medicine, Shanxi University, Taiyuan 030006;2Institute of Applied Biology, Shanxi University, Taiyuan 030006;3Shanxi Provincial Institute for Food and Drug Control, Taiyuan 030001)
【Objective】Glutathione-transferase sigma2 (LmGSTS2) fromwas expressed inand purified in order to analyze the enzymatic characteristics. The objective of this research was to study the effect of LmGSTS2 on malathion and’-DDT metabolism. The detoxification ability of LmGSTS2 was assessed by usingRNA interference (RNAi) and insecticide bioassay. It will provide a theoretical basis for management of locust resistance and rational insecticide application.【Method】LmGSTS2 was expressed in BL21 (DE3) cells and purified by Ni-NTA affinity chromatography. The activities of LmGSTS2 under different conditions (temperature and pH) were detected using CDNB as substrate. Under the optimal conditions (pH 7, 27℃), malathion and’-DDT were incubated with purified LmGSTS2 protein. The metabolic detoxification ability of LmGSTS2 to malathion and’-DDT was evaluated by ultra performance liquid chromatography (UPLC). Furthermore, 3 μg of dswas injected into 2nd instar nymph,RNAi efficiency ofwas tested at 24 h after dsinjection and the sensitivity ofto malathion was analyzed at 24 h after malathion exposure.【Result】LmGSTs2 was induced to express in. After SDS-PAGE detection, it was found that an extra band around 25 kD in the total protein of pET28a/BL21 (DE3)-LmGSTS2 after induction compared with pET28a/BL21(DE3) and uninduced pET28a/BL21(DE3)-LmGSTS2, which is regarded as the target protein size, indicating that LmGSTS2 was successfully expressed in the bacteria. The results of the study on the enzymatic characteristics of the purified LmGSTS2 protein showed that the optimum reaction pH was 6-8, the enzyme activity reached the peak at pH=7, the optimum reaction temperature was 25-30℃, and the activity was the highest at 27℃. LmGSTS2 was exposed to malathion and’-DDT respectively at pH 7, 27℃. The results of UPLC showed that the peak area of malathion after incubation with LmGSTS2 decreased by 83.6%, 84.0% and 84.6%, respectively, compared with GSH+insecticide, active LmGSTS2+insecticide and inactive LmGSTS2+GSH+insecticide (<0.05). However, there was no significant change in the peak area of’-DDT compared with the control group (>0.05), indicating that LmGSTS2 could metabolize malathion, but had no effect on the metabolism of’-DDT. The role of LmGSTS2 in the detoxification process of malathion was further verified by RNA interference. The dsRNA of the target gene was injected into the 2nd instar nymph. After 24 h, the mRNA expression ofwas inhibited by 96%. The sensitivity test showed that compared with the control group, the sensitivity ofto malathion increased after gene silencing, and the mortality increased from 29.9% to 45.2%, indicating that LmGSTS2 was involved in the detoxification process of malathion in. 【Conclusion】LmGSTS2 was expressed and purified, and the optimal reaction condition of the enzyme was pH=7, 27℃using CDNB as substrate.andassays for malathion metabolism showed that LmGSTS2 was involved in themetabolic detoxification in.assay for’-DDT metabolism showed that LmGSTS2 was not involved in the metabolism of’-DDT.
; insecticide; glutathione--transferases; ultra performance liquid chromatography (UPLC); RNA interference (RNAi)
10.3864/j.issn.0578-1752.2019.08.009
2018-11-23;
2018-12-27
国家自然科学基金国际合作项目(30810103907)、山西省应用基础研究项目(201601D202058)、2016省级配套国家科研项目(226546001)、地产中药功效物质研究与利用山西省重点实验室(201605D111004)
马雯,E-mail:15135902986@163.com。 通信作者秦雪梅,E-mail:qinxm@sxu.edu.cn。通信作者张建琴,E-mail:jiangqinzh3@sxu.edu.cn
(责任编辑 岳梅)

