腹腔镜下胰体尾切除术治疗胰腺良性与交界性肿瘤的临床效果
佘明杰,徐永建,张佩君,付强,卢伟,刘小虎
(安徽省亳州市人民医院 普通外科,安徽 亳州 236800)
腹腔镜下胰体尾切除术(laparoscopic distal pancreatectomy,LDP)自1996年第1例报道以来,逐渐成为普外科届公认的胰体尾部肿块切除的主要手术方式,并广泛地应用于包括诊断性腹腔镜探查、胰十二指肠切除及胰体尾切除等诊疗中[1]。由于其操作难度不高,在多种良性及低度恶性的疾病中均有广泛的应用[2]。解剖学显示,脾与胰脏的体尾部联系甚密,两者往往被视为同一个解剖单元,在进行胰体尾部切除时往往将脾脏亦随之切除[3]。随着人类对脾的功能认识进一步加深,保留脾脏,避免无辜性脾切除成为了医师与患者的共同诉求[4]。然而由于胰体尾处器官之间解剖结构复杂、血管关系密切,给操作带来了较大的难度[5-6]。为探讨保脾的腹腔镜下胰体尾切除术(laparoscopic spleen-preserving distal pancreatectomy,LSPDP)的疗效及应用价值,笔者对本院进行的LSPDP与行脾切除的腹腔镜胰体尾整块切除术(laparoscopic distal pancreatectomy with splenectomy,LDPS)的患者资料进行了比较研究,现将研究结果总结分析如下。
1 资料与方法
1.1 一般资料
回顾性分析本院2014年8月—2018年8月间21例良性及交界性胰体尾肿瘤行LDP的患者资料,其中12例行LSPDP,9例行LDPS。两组患者的性别、年龄、体质量指数(body mass index,BMI)、肿块最大径及组织学诊断差异均无统计学意义(均P>0.05),具有可比性(表1)。
1.2 手术方法
所有患者均接受吸入性全身麻醉,并采取头高脚低大字右倾卧位,左侧可适当垫高使胰腺充分抬高。于脐下作一约10 mm的切口,向其中插入套管并充入CO2建立气腹,气腹压约13 mmHg(1 mmHg=0.133 kPa),向其中置入30°腹腔镜。于平脐的水平线与左右锁骨中线的交点偏上方分别作12 mm的切口,在右侧锁骨中线肋缘下作5 mm切口,剑突下4 cm处作5 mm切口。根据术中操作的暴露需要,经由12 mm套管插入腹腔镜或作为主操作口,随后对腹膜表面及各脏器的表面情况进行探查,确认肿瘤是否存在转移征象。将大网膜塞入左肝下方,利用超声刀联合Ligsure打开胃结肠韧带及脾结肠韧带,理清胰腺及病灶的位置或毗邻关系。LDPS组:胰腺完全显露后进行胰体尾+脾切除术。打开位于胰腺上下缘的后腹膜,暴露位于肠系膜上静脉左侧的脾动静脉,将血管进行结扎后切断。应用无损钳夹起胰腺组织,应用超声刀将胰腺后方组织分离,置入Endo-GIA将胰腺横断,并分离胰腺与脾脏之间及胰腺远端后方的组织及韧带,充分游离胰体尾部并分离,最后放入标本袋取出。LSPDP组:将脾动静脉及胰腺分支血管充分暴露,应用超声刀凝断血管使得胰腺与脾脏血管之间的血供关系断开,完全分离,但当脾动脉难以保留,可采用Warshaw保留脾。再将胰腺应用Endo-GIA进行切除,应用标准袋取出。将患者创面止血后放置引流管于胰腺残端,自左下的操作孔中取出并固定(图1)。
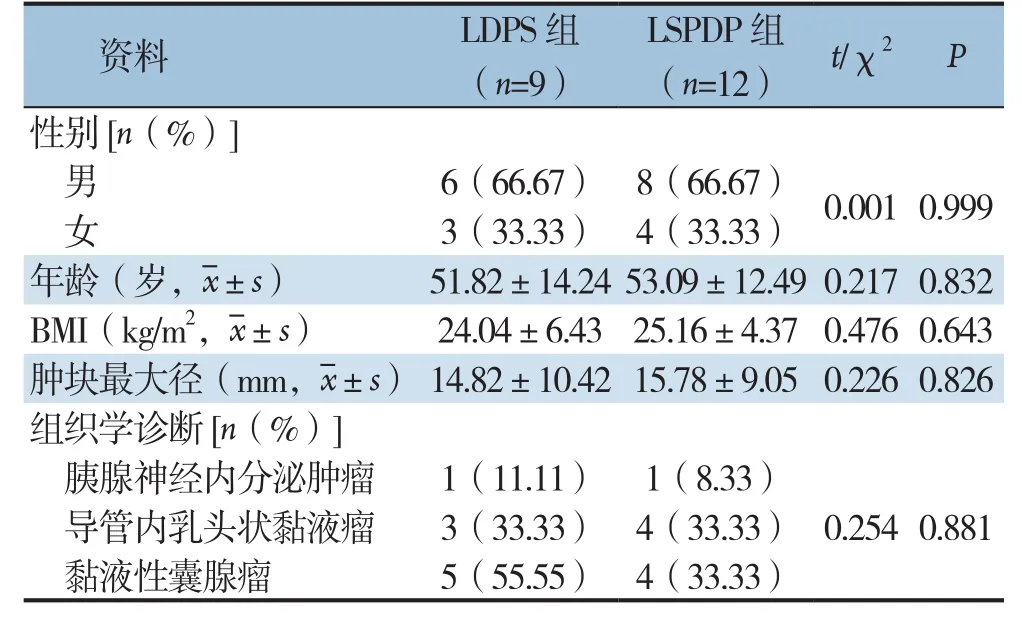
表1 两组患者基线资料对比Table1 Comparison of the general information of the groups of patients
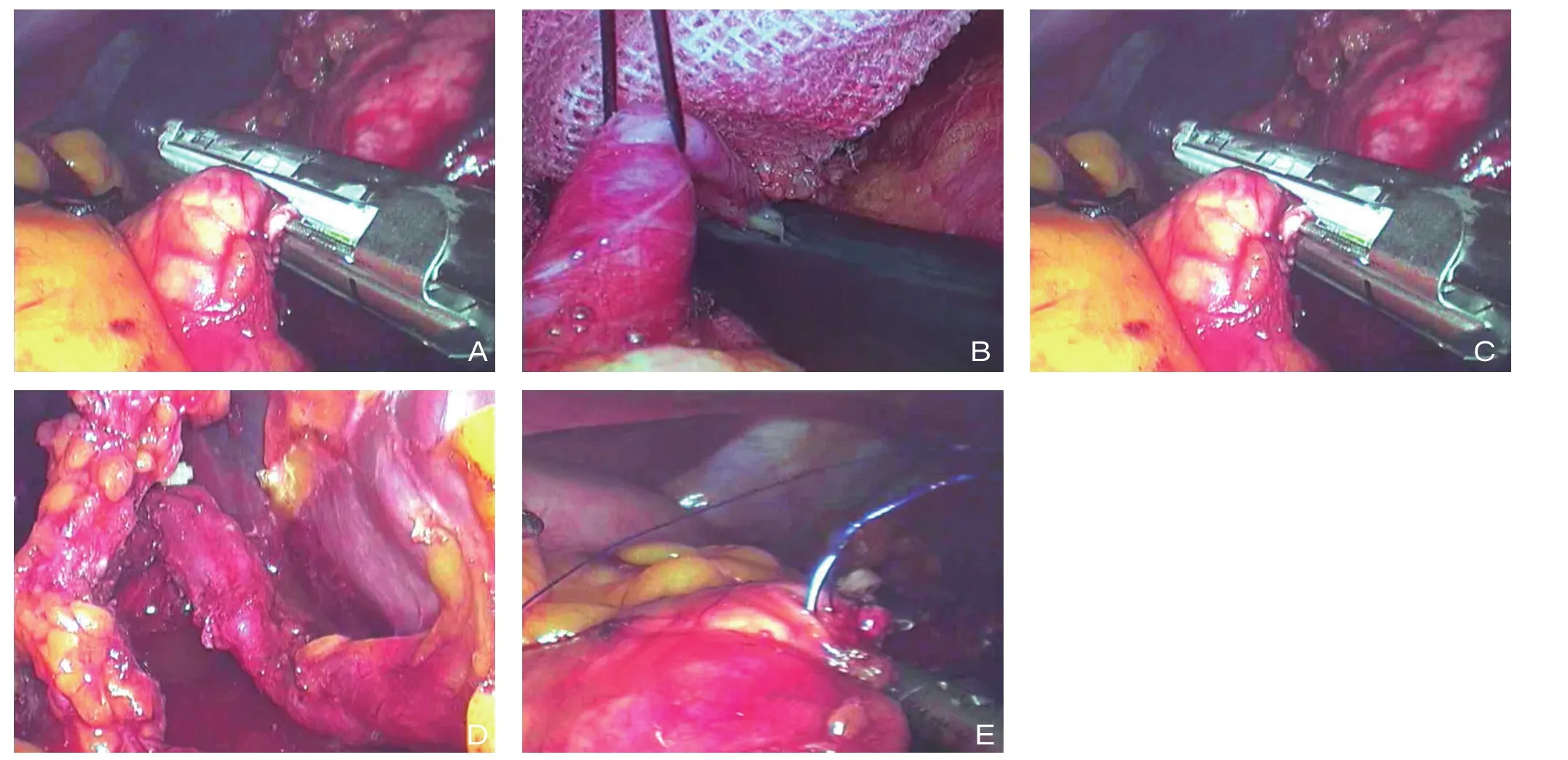
图1 LSPDP术中照片 A:腹腔镜下游离胰腺肿瘤下缘和十二指肠间隙;B:丝线牵拉保护脾动脉主干;C:Endo-GIA断离胰腺;D:完整保护脾动脉主干;E:Porlene线缝合胰腺残端Figure1 Intraoperative views of LSPDP A: Laparoscopic dissociation of the space between the inferior margin of the tumor and the duodenum; B: Protection of the main trunk of the splenic artery by lifting it with a thread; C: Division of the pancreas by Endo-GIA;D: Full protection of the main trunk of the splenic artery; E: Suture of the pancreatic stump with Porlene
1.3 观察指标
围术期指标:两组患者的手术时间、术中出血量和术后住院时间等。术后病理及实验室检测:两组患者的病理诊断、血液白细胞和血小板水平等。随访及并发症:患者在出院后均接受为期1~36个月的电话或复诊随访,记录所有患者在住院期间或出院后的胰瘘、切口感染、腹腔积脓、假性囊肿等并发症。胰瘘诊断标准:术后≥3 d,引流液≥10 mL/d,引流液中淀粉酶浓度≥375 U/L或影像学检查可见腹部积液,穿刺检查其淀粉酶浓度≥375 U/L,持续≥3 d。腹腔感染诊断标准:患者术后发热≥3 d,体温≥38℃,血常规检查可见白细胞升高,影像学检查可见腹腔内局部病灶,引流液或穿刺液培养出细菌或真菌。假性囊肿诊断标准:上腹部持续疼痛,饱胀不适,右上腹囊性包块,B超或CT可进一步确诊。
1.4 统计学处理
采用SPSS 16.0软件对数据进行分析,计数资料应用χ2检验,当频数<1时采用Fisher确切概率法;计量资料以均数±标准差(±s)表示,组间比较采用t检验;生存分析应用Kaplan-Meier法进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者围术期指标比较
两组患者的手术时间、术中出血和住院时间的差异均无统计学意义(均P>0.05)。LDPS组有1例术中输血,LSPDP组则有2例术中输血,两组术中输血例数差异无统计学意义(P>0.05)(表2)。
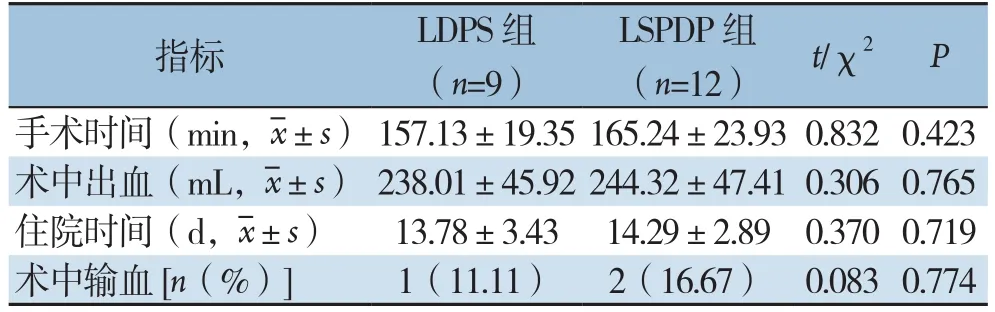
表2 两组患者围术期指标的对比Table2 Comparison of the perioperative variables between the two groups of patients
2.2 两组患者术后实验室指标
两组患者术后1、7 d的白细胞和中性粒细胞水平,术后1、3 d的腹水淀粉酶水平差异均无统计学意义(均P>0.05),而术后2周和3个月的血小板水平,LDPS组明显高于LSPDP组,差异均有统计学意义(均P<0.05)(表3)。
2.3 两组患者术后并发症情况
LDPS组术后发生胰瘘1例(11.11%),切口感染2例(22.22%),腹腔积脓1例(11.11%),假性囊肿2例(22.22%);LSPDP组分别为生胰瘘1例(8.33%),切口感染3例(25.00%),腹腔积脓1例(8.33%),假性囊肿3例,两组术后总并发症发生率差异无统计学意义(P>0.05)(表4);所有并发症均在对症治疗后2~8周恢复。
表3 两组患者术后实验室指标比较(±s)Table3 Comparison of the variables of laboratory tests between the two groups of patients (±s)

表3 两组患者术后实验室指标比较(±s)Table3 Comparison of the variables of laboratory tests between the two groups of patients (±s)
项目 LDPS组(n=9)LSPDP组(n=12) t P白细胞(×109个/L)术后1 d 12.01±3.53 13.26±4.21 0.720 0.487术后7 d 9.76±2.15 9.87±2.53 0.105 0.918中性粒细胞(%)术后1 d 83.67±8.32 85.06±7.73 0.395 0.701术后7 d 79.74±4.69 81.02±5.04 0.593 0.565血小板(×109个/L)术后2周 412.54±110.35194.62±78.25 8.241 0.000术后3个月 357.13±109.24169.24±81.98 4.513 0.001腹水淀粉酶(U/L)术后1 d 479.24±53.33 489.24±28.55 0.555 0.590术后3 d 145.27±27.24 158.53±19.39 1.306 0.218

表4 两组患者术后并发症比较[n(%)]Table4 Comparison of the postoperative complications between the two groups of patients [n (%)]
3 讨 论
在腹部手术中,胰腺由于其位置较深,周围器官组织解剖关系复杂,因此在腹腔镜下胰腺手术的进展较其他的手术更为落后。随着腹腔镜技术的发展,超声刀、Endo-GIA和腹腔镜超声等仪器设备的广泛应用,腹腔镜下的胰腺手术也呈现增多的趋势[7-8]。但对于行胰腺手术是否保脾仍存在争议:对比常规的胰体尾联合脾脏切除术,有研究认为保留脾脏的术式对于术后的感染和患者的恢复均具有积极的意义[9-11],但也有学者[12]认为保脾手术增加了手术难度和延长手术时间,一定程度增加了术后并发症,再加上患者存在解剖异常、凝血功能异或手术操作失误等容易发生难以控制的脾血管出血,不可避免的中转开腹手术[13-14],因此应联合脾脏切除。
对于上述争议,本研究纳入了21例行LDP患者,其中12例行LSPDP,9例行LDPS。两组的围术期指标对比显示,手术时间、术中出血、住院时间和术中输血等均无统计学差异,但LSPDP组的手术时间稍长,因为脾血管的解剖位置较深,处理不便,因而需较长时间进行分离并处理。术后实验室检查结果显示,两组患者术后1、7 d的白细胞和中性粒细胞水平差异无统计学意义,术后1、3 d的腹水淀粉酶水平差异无统计学意义,但术后2周和3个月的血小板水平,LDPS组均显著高于LSPDP组,差异具有统计学意义,可能原因在于脾脏作为免疫器官,除了可以起到抗感染和抗肿瘤的作用,还可降低术后深静脉血栓、肺栓塞和血液系统疾病的发生率[15-16]。尽管有证据显示,腹腔镜对比其它手术途径不会增加胰体尾切除后的胰瘘发生率[17-18],但两组术后均发生了胰瘘、切口感染、腹腔积脓和假性囊肿等并发症,两组术后并发症差异无统计学意义,且经对症治疗均有不同程度地恢复。由此可见,本研究纳入的21例患者为胰腺良性或交界性肿瘤,行LDPS和LSPDP的疗效相当,但LDPS可能影响凝血系统,术后需密切关注。
与LDPS不同,LSPDP术也存在难点或不足[19-25]:⑴ 脾血管处理是最为关键的步骤,保脾的术式有Kimura法和Warshaw法,前者可以将脾动静脉完整保留,但操作较为复杂,后者可简单离断脾动静脉,但会增加术后的脾梗死及胃底食管静脉曲张的风险,除了个别案例采用Warshaw法,笔者本次主要选用Kimura法,避免术后再次出血。为缩短手术时间,尽快处理血管,在术前应采用影像学检查的方法,将患者胰脏肿瘤血管及周围组织的排布及走行关系进行分析,CT和MRI在术中进行较大的操作如游离、夹闭较大的脾血管或静脉穿支血管时具有引导的效果[14]。⑵ 术者进行操作时,应注意动作轻柔,避免过度牵引血管和组织,为此可采用小纱条协助游离,并能在出血时起到压迫止血的作用。⑶ 充分对大血管进行预暴露可以有助于出血时的紧急处理。一旦出现出血,可以尽快吸净积血,并将破口钳夹住。再视破口大小选择钛夹固定或者缝线缝合。若暂时无法准确定位出血点,可以暂时应用压迫止血的方式,尽快切除标本,待标本切除后,暴露更多的视野并进行止血。⑷ LSPDP主要用于良性病变,晚期患者肿瘤侵犯范围广,难以排除脾转移的可能。
综上所述,LDPS和LSPDP均可用于良性及低度恶性的胰体尾肿瘤,相对于LDPS,LSPDP在稳定血小板方面有一定优势,但本研究纳入病例较少且随访时间较短,仍需进一步增大样本量并延长随访时间进行研究。

