共振散射光谱法测定食盐中亚铁氰化钾
刘梯楼,罗聪,汤俊颖,孙双姣
(邵阳学院 药学院,湖南 邵阳,422000)
亚铁氰化钾具有防止固体结块,保持食物疏松的作用。该物质在医药和食品中有一定的应用[1],是食盐中应用较多的一种抗结剂[2]。亚铁氰化钾本身毒性低,但在高温时会分解出氰化钾,遇酸会产生氢氰酸,遇氢氧化钠会产生氰化钠,而这些物质均是剧毒物,可通过口吸入或皮肤黏膜吸收进入体内,低剂量的长期接触会导致帕金森综合征、意识错乱和智力衰退等神经系统损伤[3],高剂量食入可引起呼吸短促、昏厥、失去意识甚至死亡[4]。因此亚铁氰化钾使用不当或使用过量会对人体健康产生危害,该物质在某些国家(如日本)是禁用的食品添加剂。为了加强食品安全管理和食品出口需要,对食品中亚铁氰化钾的检测具有一定的意义。共振散射光谱分析由于仪器简便、灵敏度高、选择性好而在食品、药品、生化、环境等分析领域得到了广泛的应用[5-8]。目前报道的测定亚铁氰化钾的方法有高效液相色谱法[9]、电化学传感器法[10]、分光光度法[11-13]。用亚铁氰化钾与铁离子反应生成普鲁士蓝的共振散射分析也有报道[14]。亚铁氰化钾与锌离子作用可生成K2Zn3[Fe(CN)6]2粒子[15]。本研究首次利用亚铁氰化钾与锌离子作用生成K2Zn3[Fe(CN)6]2的共振散射光谱测定了食盐中的亚铁氰化钾,该法具有操作简便、灵敏度高的特点。
1 实验部分
1.1 仪器与试剂
F97PRO荧光分光光度计(上海棱光技术有限公司),测定参数:狭缝宽度调节为10nm;PHS-3C酸度计(上海精密科学仪器有限公司)。
K4[Fe(CN)6](长沙市湘科精细化工厂)标准溶液:配置成0.01mol/L的储备溶液,使用时稀释为1.0×10-4mol/L的工作液。ZnSO4(衡阳市凯信化工试剂服务有限公司)配置成1.0×10-3mol/L的工作液。HCl(衡阳市凯信化工试剂股份有限公司),配制成1.0mol/L的溶液。本实验所用试剂均为分析纯,实验用水为超纯蒸馏水(18.2 MΩ)。
1.2 实验方法
在10.0mL具塞比色管中一次加入1.5mL HCl 溶液,1.0mL ZnSO4工作液和适量的亚铁氰化钾,用超纯水稀释定容至10.0mL,室温混匀放置10min, 在荧光分光光度计上于220~600nm范围同步扫描激发光和发射光(λex=λem)得出体系的共振散射光谱。于共振散射峰 360nm处分别测定分析体系的共振散射光强度IRLS和试剂空白IRLS(b),共振散射光强度变量ΔIRLS=IRLS-IRLS(b)。
2 结果与讨论
2.1 体系的共振散射光谱谱图
体系的共振散射光谱图如图1所示,结果表明,锌离子(曲线a)与亚铁氰化钾(曲线b)在酸性溶液中水溶性强,与水之间不能形成界面,共振散射光信号均很弱。在锌离子中加入亚铁氰化钾后由于生成了K2Zn3[Fe(CN)6]2粒子,形成了固液界面[16],导致体系的共振散射急剧增强,且随着亚铁氰化钾浓度的增加,生成的K2Zn3[Fe(CN)6]2粒子增多,共振散射强度随之增强。体系在360nm的共振散射峰最强,实验选择360nm作为定量分析的测定波长。
2.2 反应介质的选择
为了避免锌离子和亚铁氰化钾中Fe(II)发生水解,实验选择在酸性介质中进行。相同条件下,分别试验了1.0mL 0.2mol/L和1.0mol/L的HCl溶液对体系ΔIRLS的影响。结果表明,1.0mol/L的HCl溶液为反应介质时,体系的ΔIRLS相对较大。试验了不同1.0mol/L HCl用量对体系ΔIRLS的影响,实验结果如图2所示,酸性较高时,[Fe(CN)6]4-与H+结合增强不利于K2Zn3[Fe(CN)6]2粒子的生成,酸度较低时,锌离子与[Fe(CN)6]4-的结合能力降低,体系的ΔIRLS相对较小。当1.0mol/L的HCl用量为1.5mL,即浓度为0.15mol/L时,体系具有最强的ΔIRLS,实验选择0.15mol/L的HCl为体系反应的介质。

HCl+0.10mmol/L ZnSO4+10.0μmol/L K4[Fe(CN)6]图2 盐酸用量对体系ΔIRLS的影响Fig.2 Effect of the HCl volume on ΔIRLS
2.3 ZnSO4用量的选择
试验了不同1.0mmol/L ZnSO4用量对体系ΔIRLS的影响,实验结果如图3所示,当ZnSO4用量小于0.5mL时,ZnSO4的浓度不足以使[Fe(CN)6]4-反应完全,ΔIRLS较小;当ZnSO4用量大于或等于0.5mL时,[Fe(CN)6]4-与锌离子反应完全,体系的ΔIRLS相差不大且比较稳定。实验选择加入ZnSO4的体积为1.0mL,即浓度为0.10mmol/L。

0.15mol/L HCl+ ZnSO4+10.0μmol/L K4[Fe(CN)6] 图3 硫酸锌用量对体系ΔIRLS的影响Fig.3 Effect of the ZnSO4 volume on ΔIRLS
2.4 反应温度与时间的选择
按照实验方法,考察了反应时间对5.0μmol/L和50.0μmol/L亚铁氰化钾两个反应体系IRLS的影响,结果表明,亚铁氰化钾浓度较低的体系在3min内反应完全,亚铁氰化钾浓度较高的体系于8min内反应完全,反应完全后体系的IRLS相对稳定且在100min内无明显变化。实验选择反应体系在室温下反应10min后才开始测定。
2.5 试剂加入顺序的影响
将1.0mL 0.1mmol/L亚铁氰化钾、1.0mL 1.0mmol/L ZnSO4溶液,1.5mL 1.0mol/L的HCl改变加入的顺序并按实验方法测定360 nm处的IRLS。结果表明,试剂的加入顺序不影响体系的IRLS。
2.6 离子强度的影响
通过改变5.0mol/L的 NaCl溶液用量考察了离子强度对体系ΔIRLS的影响,实验结果如图4所示,当NaCl浓度大于1.4mol/L时,由于离子氛的影响变大,导致[Fe(CN)6]4-与锌离子的有效浓度降低较大,生成的K2Zn3[Fe(CN)6]2粒子减少,体系ΔIRLS降低。

0.15mol/L HCl+0.10mmol/L ZnSO4+10.0μmol/L K4[Fe(CN)6+NaCl图4 NaCl用量对体系ΔIRLS的影响Fig.4 Effect of the NaCl volume on ΔIRLS
2.7 共存离子的影响

2.8 工作曲线及检出限
按照实验方法,研究了亚铁氰化钾的浓度与360 nm处的ΔIRLS的关系。实验结果表明,在0.074~18.421μg/mL范围内,亚铁氰化钾浓度与其对应的共振散射强度ΔIRLS之间存在良好的线性关系。当亚铁氰化钾浓度取0.074μg/mL、0.184μg/mL、0.368μg/mL、1.842μg/mL、3.684μg/mL、7.368μg/mL、11.052μg/mL、14.737μg/mL、18.421μg/mL时, 回归方程为ΔIRLS=208.11ρ-0.550 3,相关系数R为0.999 4,检出限(3σ)为0.032μg/mL。
3 样品分析
称取食盐15g于小烧瓶中,用容量瓶准确配制成100.0mL溶液,摇匀。取4.00mL按实验方法进行测定,平行测定5次,配制的溶液测定结果如表1。从表中数据可算出四川深井盐、湖南天然钙盐、湖南低钠盐中的亚铁氰化钾的含量分别为5.44mg/kg、4.77mg/kg与4.60mg/kg。
表1 样品中K4[Fe(CN)6]测定结果(n=5)
Table 1 The determination results of K4[Fe(CN)6] in samples(n=5)
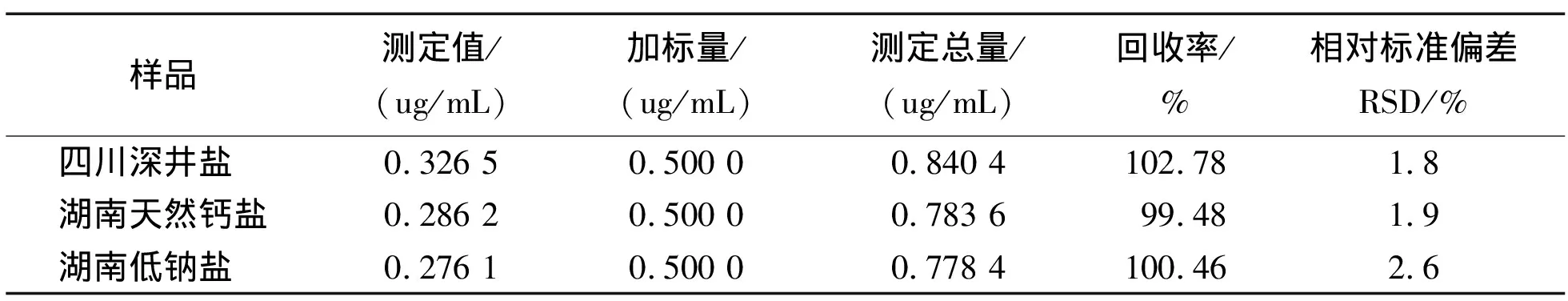
/(ug/mL)/(ug/mL)/(ug/mL)/%RSD/% 0.326 50.500 00.840 4102.781.80.286 20.500 00.783 699.481.9 0.276 1 0.500 00.778 4100.462.6
4 结论
K4[Fe(CN)6与Zn2+反应生成K2Zn3[Fe(CN)6]2,体系的共振散射效应明显增强,在优化实验条件下,体系在360nm处的共振散射光强度ΔIRLS与亚铁氰化钾在0.074~18.421μg/mL范围内呈良好的线性关系,由此建立了测定K4[Fe(CN)6]的共振散射光谱分析新方法,检出限(3σ)为0.032μg/mL。该方法仪器为普通的荧光分光光度计,具有仪器简便、试剂简单、灵敏度高等特点,用于食盐中K4[Fe(CN)6]含量的测定,回收率在99.48%~102.78%之间,结果满意,同时该法也可用于其他食品中K4[Fe(CN)6]的测定。

