低氧诱导因子对胃食管反流小儿并发反流性食管炎的诊断作用
孙颖,吴嶛
小儿胃食管反流是食管括约肌出现障碍或相关结构出现异常导致括约肌压力低下而出现的反流,临床常见有腹痛、呕吐、烧心及哮喘反复发作等症状,对小儿的生长发育及生活质量产生严重影响[1-2]。食管括约肌障碍及相关结构出现异常会引发消化道动力障碍,导致酸性胃液及碱性肠液反流至食管并发反流性食管炎[3]。目前临床诊断胃食管反流并发反流性食管炎时缺乏特异性表现,诊断难度较大,因此对该疾病的诊断已成为小儿内科领域重点关注的问题之一。在人和哺乳动物的细胞内普遍存在低氧诱导因子,其中HIF-1α主要在肝[4]、胃[5]、胰腺[6]等脏器中表达,在反流性食管炎的诊断中具有一定价值。目前对低氧诱导因子的研究多集中于HIF-1α,认为其参与并维持低氧状态下的细胞代谢、干细胞分化,但HIF-2α对干细胞分化及细胞代谢的调控作用尚未明确。为此本研究观察胃食管反流并发反流性食管炎患儿血清HIF-2α水平,并尝试分析HIF-2α检测对小儿胃食管反流并发反流性食管炎的诊断价值。
1 资料与方法
1.1 一般资料
选取我院2015年4月至2016年4月收治的43例胃食管反流并发反流性食管炎患儿纳入研究对象,设为A组;另外选取43例体检健康儿童纳入研究对象,设为B组,其中男45名,女41名;年龄3~10岁,平均(6.04±2.50)岁;收缩压(systolic blood pressure,SBP) 88~108 mmHg,平均(98.50±8.10)mmHg;舒张压(diastolic blood pressure,DBP) 57~70 mmHg,平均(63.15±5.02)mmHg。本次研究经我院伦理委员会同意后实施。
1.2 纳入与排除标准
纳入标准:A组经胃食管反流诊断问卷[7]确诊为胃食管反流同时符合《反流性食管炎诊断及治疗指南(2003年)》[8]中反流性食管炎相关诊断标准;1~12岁。B组1~12岁,为我院体检正常儿童。两组儿童家属对本次研究知情同意并签署知情同意书。
排除标准:①心肝肾功能障碍或血液疾病者;②近3个月有胃肠促动药物、质子泵抑制剂使用史者;③伴有其它严重并发症,如食管狭窄、上消化道出血。
1.3 方法
A组患儿及B组志愿者儿童入院后即抽取清晨空腹静脉血5mL,经离心后送检,检测低氧诱导因子2α(hypoxia-inducible factor-2α,HIF-2α)、低氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)、过氧化物酶体增殖物激活受体-γ (peroxisomeproliferator-activated receptor-gamma,PPAR-γ)水平。HIF-2α、HIF-1α检测使用从美国Bio-Tek公司引进的EXL-200型酶标仪以ELISA法检测,试剂盒由武汉中美科技有限公司生产;PPAR-γ使用ELISA法检测,试剂盒由上海源叶生物科技有限公司生产;各项指标检测严格遵守试剂盒操作说明书进行。随后对比两组基础资料(性别、年龄、SBP、DBP)及实验室指标(HIF-2α、HIF-1α、PPAR-γ),并将有差异指标纳入ROC分析其诊断反流性食管炎的价值。
1.4 统计学方法
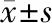
2 结果
2.1 两组基础资料及实验室指标对比
两组性别、年龄、SBP、DBP对比差异无统计学意义(P>0.05),A组HIF-2α、HIF-1α、PPAR-γ水平显著高于B组,差异有统计学意义(P<0.05),见表1。
2.2 HIF-2α、HIF-1α、PPAR-γ诊断小儿胃食管反流并发反流性食管炎的ROC分析
HIF-2α、HIF-1α、PPAR-γ的ROC曲线下面积分别为0.969、0.947、0.951,见表2。HIF-2α、HIF-1α、PPAR-γ各指标的曲线图见图1~3。
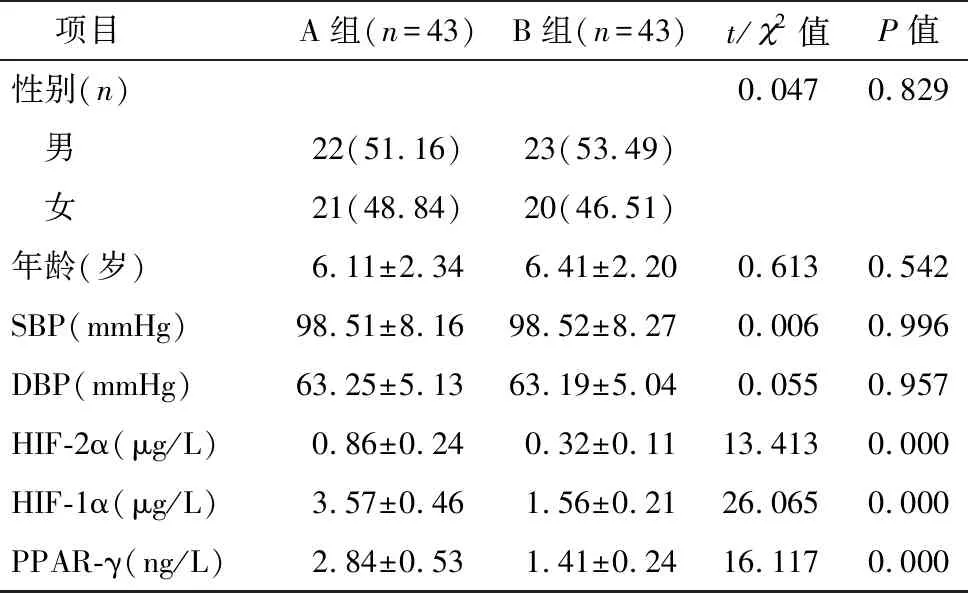
表1 两组基础资料及实验室指标对比

表2 HIF-2α、HIF-1α、PPAR-γ诊断小儿胃食管反流并发反流性食管炎的ROC分析
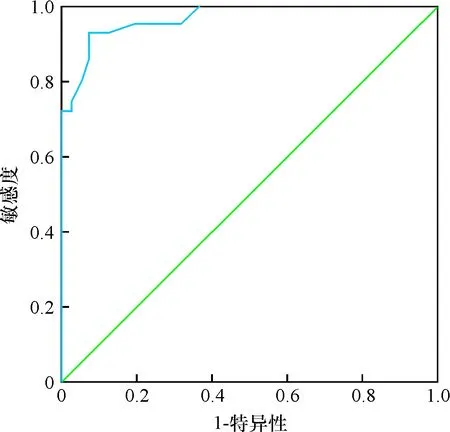
图1 HIF-2α诊断小儿胃食管反流并发反流性食管炎的ROC曲线
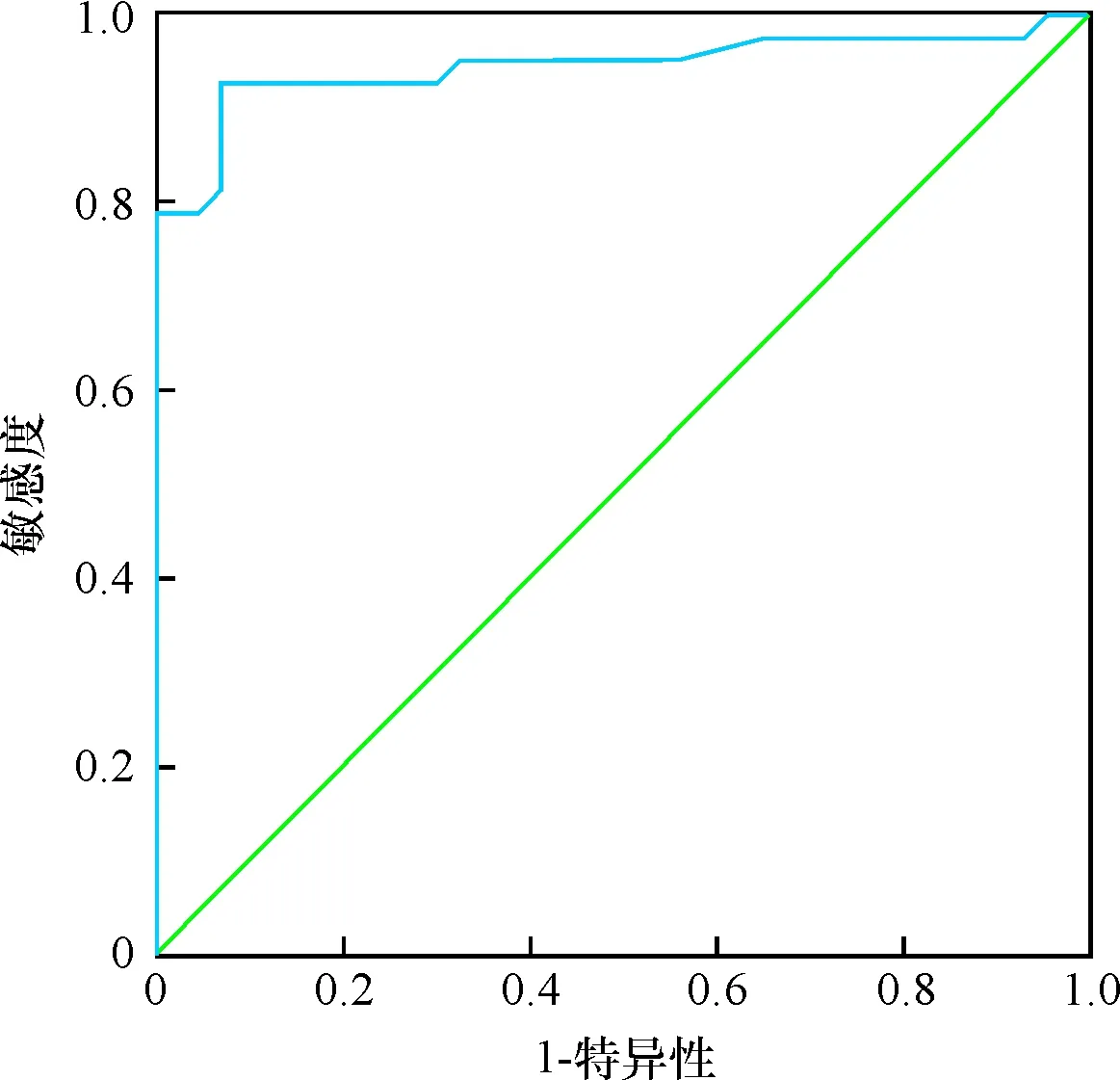
图2 HIF-1α诊断小儿胃食管反流并发反流性
食管炎的ROC曲线
3 讨论
胃食管反流指胃或十二指肠内的容物反流至食管而出现的疾病,同时食管黏膜还会出现炎症、糜烂、溃疡等病变,其发病率为5.77%[9-11]。胃食管反流发病后部分患者伴有反流性食管炎,据资料显示胃食管反流患者中约有1/3经内镜检查食管黏膜有损伤[12],且反流性食管炎的发病率为1.99%[13]。目前临床诊断胃食管反流并发反流性食管炎时易出现漏诊及误诊,对该疾病的治疗产生不利影响,因此本研究对胃食管反流并发反流性食管炎患儿及体检健康儿童血清HIF-2α、HIF-1α、PPAR-γ水平进行对比,并使用ROC分析HIF-2α、HIF-1α、PPAR-γ诊断小儿胃食管反流并发反流性食管炎的价值,为小儿胃食管反流并发反流性食管炎的诊断提供依据。
本次研究结果显示,A组HIF-2α、HIF-1α、PPAR-γ水平显著高于B组,表明HIF-2α、HIF-1α、PPAR-γ在胃食管反流并发反流性食管炎患儿体内呈现出高表达。笔者分析HIF-2α、HIF-1α、PPAR-γ水平高表达原因如下:①PPAR-γ在内皮细胞[14]、血管平滑肌细胞[15]、肝脏[16]等多种细胞中均可表达,能够参与炎症、发育等多种生理、病理过程[17-18],患儿发病后食管黏膜出现炎症、糜烂、溃疡等一些列病变,此时PPAR-γ参与其中,因此A组患儿PPAR-γ水平显著高于B组健康儿童;②低氧诱导因子具有不同的亚型,包括HIF-1α、HIF-2α,其中HIF-2α主要在肾[19]、肺[20]、血管内皮细胞[21]中表达,两者均具有干细胞分化及细胞代谢的调控作用[22],但目前对低氧诱导因子的研究多集中于HIF-1α[23-24],反流性食管炎可引起食管黏膜的损伤,而HIF-2α、HIF-1α均可参与到食管黏膜的损伤和修复过程,此时患儿体内HIF-2α、HIF-1α呈高表达状态,故A组患儿HIF-2α、HIF-1α水平显著高于B组。赵东梅[25]等观察反流性食管患者体内HIF-1α、PPAR-γ表达时指出HIF-1α、PPAR-γ均会参与到食管黏膜组织的修复与损伤过程,与本次研究结果基本相符。
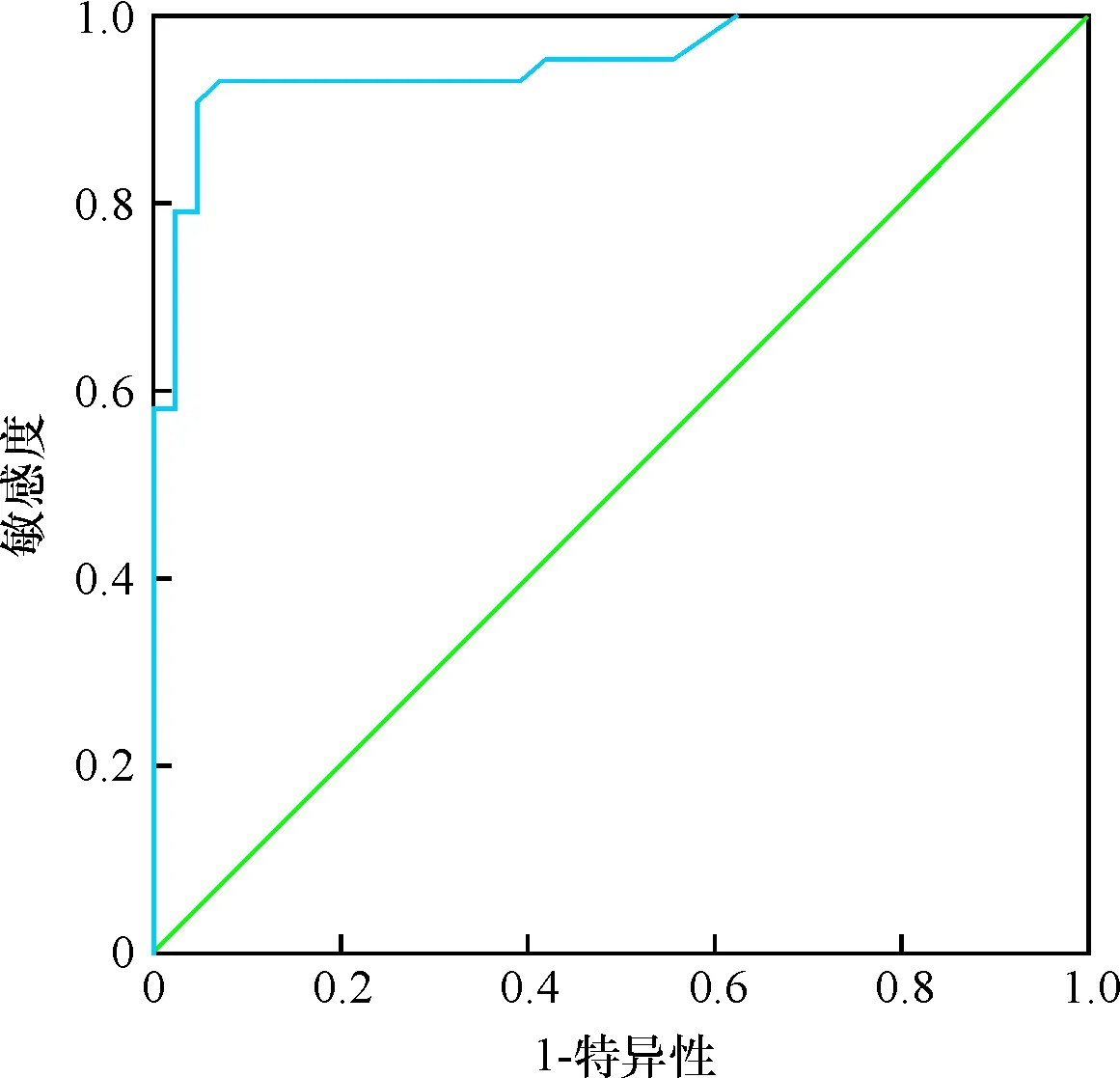
图3 PPAR-γ诊断小儿胃食管反流并发反流性食管炎的ROC曲线
另外,经ROC分析HIF-2α、HIF-1α、PPAR-γ的曲线下面积分别为0.969、0.947、0.951,表明HIF-2α、HIF-1α、PPAR-γ检测对小儿胃食管反流并发反流性食管炎的诊断具有较高价值。HIF-2α、HIF-1α、PPAR-γ诊断小儿胃食管反流并发反流性食管炎的敏感度分别为0.930、0.930、0.907,特异性分别为0.927、0.860、0.953,提示以上指标可用于该疾病的诊断,为临床诊治提供指导。
综上,胃食管反流并发反流性食管炎患儿体内HIF-2α、HIF-1α、PPAR-γ水平呈高表达,同时经ROC分析HIF-2α、HIF-1α、PPAR-γ检测对小儿胃食管反流并发反流性食管炎的诊断具有重要意义,可能为该疾病的诊断提供帮助,临床上应给予重视。

