内镜下黏膜剥离及切除术治疗早期直肠癌的预后比较
蒋静,刘美宏,李丹,董利平,吴娜
直肠癌是消化道常见恶性肿瘤,对于早期直肠癌患者,既往多认为应通过外科根治性手术,切除肠段并清扫局部淋巴结才能达到根治效果[1]。但根治性手术切除肠段多,手术创面大,术后恢复慢,尤其是老年患者,术后生活质量较差,近年来有报道显示早期直肠癌可不存在肠系膜和肠旁淋巴结转移,有指南将早期非典型增生性直肠癌纳入黏膜内癌范畴[2-3]。因而,有学者提出内镜下切除癌变组织,目前,临床主要有内镜黏膜剥离术(endoscopic submucosal dissection,ESD)和内镜黏膜切除术(endoscopic mucosal resection,EMR)两种术式[4-5],但有关两种术式的临床价值及应用范围,临床尚未有规范性指导意见。本研究回顾性分析本院90例老年早期直肠癌患者临床资料,分析两种术式对患者预后的影响。报道如下。
1 资料与方法
1.1 一般资料
回顾性分析本院2013年7月至2015年7月90例老年早期直肠癌患者临床病历资料,根据手术方法不同将90例患者分为观察组(ESD)和对照组(EMR),其中观察组45例,对照组45例。两组患者性别、年龄及体重指数(body mass index,BMI)比较,差异均无统计学意义(P>0.05),见表1。本研究经我院伦理委员会批准同意。
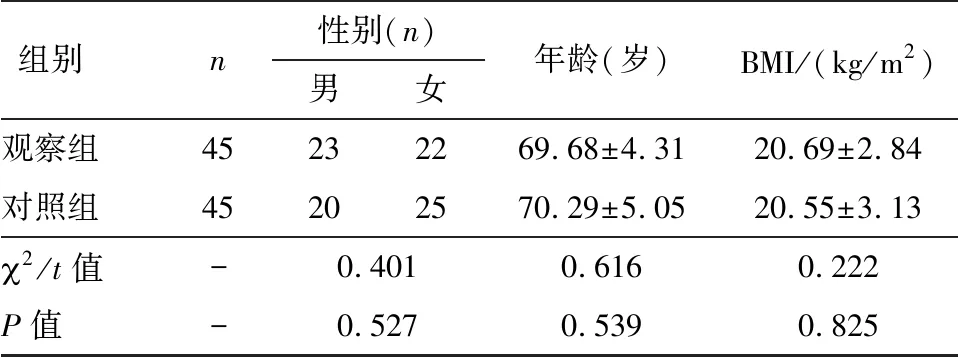
表1 两组基本资料比较
1.2 入选标准
纳入标准:①均经术前MRI和内镜切除术证实为早期直肠癌,仅侵及黏膜下层[6];②病历资料完整;③年龄>65岁。排除标准:①肿瘤浸润深度达到或超过固有肌层;②发生淋巴结转移者;③中转开腹者;④合并有严重溃疡性结肠炎或直肠良性肿瘤者。
1.3 手术方法
观察组:行全身静脉麻醉,连接心电监护,在内镜指引下,寻找肿瘤病灶,确定病灶部位、大小及形态,并在肠段病灶外缘0.5 cm处以电凝方式多点点灼标记(见图1)。沿内镜活检孔道置入注射针,在每个标记点处注射肾上腺素混合液各1~3 mL(混合液配方:肾上腺素1 mL+0.9%氯化钠溶液100 mL+玻璃酸钠5 mL+靛胭脂5 mL),以使病灶处黏膜均匀抬高隆起为度。在内镜指引下,用针刀切开病灶周围黏膜,然后用IT刀将黏膜下层与固有肌层分离,将病灶整块剥离(图2),剥离完成后对创面进行电凝止血(图3),创面较深者用钛夹夹闭(图4),将病灶标本送检。对照组:麻醉和标记处理同观察组,标记后沿内镜活检通道置入圈套器,将病变肠段完全套入圈套器内,利用圈套器切除病变肠段,然后进行创面止血。
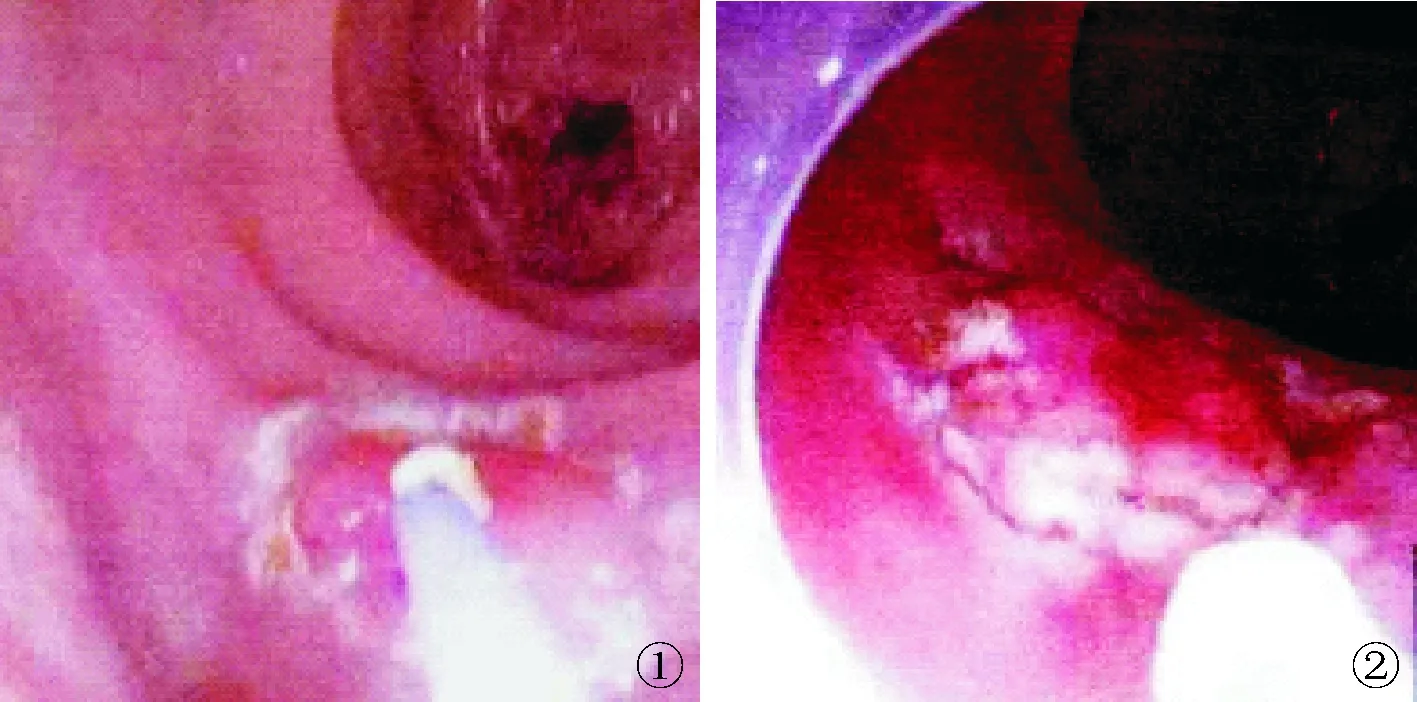
图1 以电凝方式在病灶外缘0.5 cm处做电灼标记;图2 用IT刀剥离黏膜下层和固有肌层
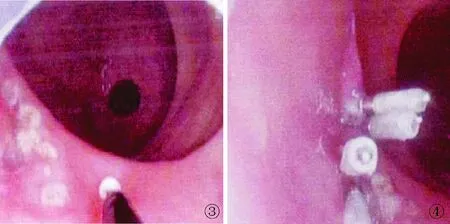
图3 对创面进行电凝止血; 图4 用钛夹夹闭缝合创面
1.4 观察指标
比较两组患者病理资料,包括肿瘤病理分型、肿瘤分期、肿瘤距肛缘距离、分化程度及肿瘤直径。手术相关指标包括手术时间、术中出血量及并发症发生情况。随访记录两组患者预后,比较两组术后3年无进展生存率和总生存率。根据是否发生并发症,将观察组45例患者分为并发症组和无并发症组,比较两组患者基本资料和病理特点,分析各指标预测并发症的价值。
1.5 统计学方法
选用SPSS 17.0软件处理数据,计数资料以%表示,组间比较行2检验;计量资料以表示,组间比较行t检验;术后生存情况采用KaplanMeier描述,组间比较行Logrank2检验;预测价值采用受试者工作曲线(receiver operative curve,ROC)分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组病理资料比较
两组患者肿瘤位置、肿瘤分期、病理分型、分化程度及肿瘤直径比较,差异均无统计学意义(P>0.05)。见表2。
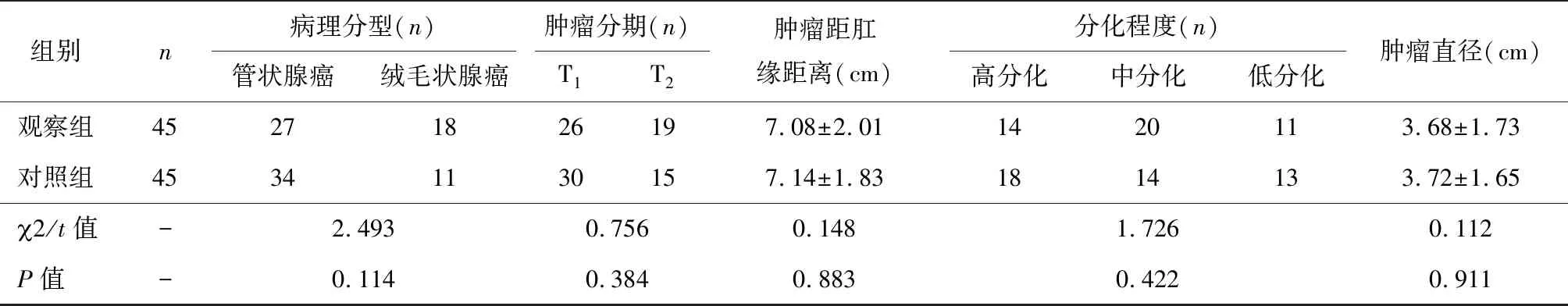
表2 两组病理资料比较
2.2 两组手术相关指标比较
观察组手术时间较对照组显著延长,术中出血量显著多于对照组,术后并发症发生率显著高于对照组,差异均有统计学意义(P<0.05),见表3。
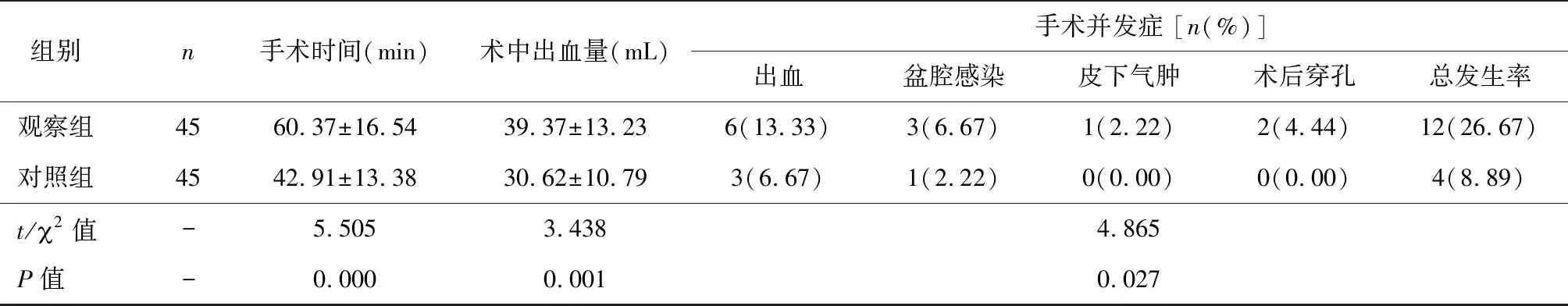
表3 两组手术相关指标比较
2.3 两组预后比较
两组患者术后随访3年,观察组肿瘤进展5例,总生存41例。对照组肿瘤进展12例,总生存38例。观察组术后3年肿瘤无进展生存率显著高于对照组,差异有统计学意义(Logrank2=3.783,P=0.047),两组术后3年总生存率差异无统计学意义(Logrank2= 0.945,P= 0.331),见图1-2。
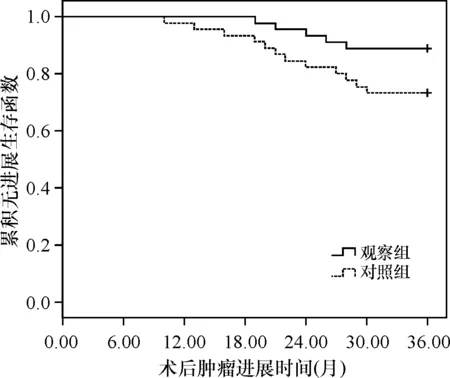
图1 两组术后3年无进展生存函数比较
2.4 ESD患者并发症比较
观察组中12例有并发症,为并发症组,另33例为无并发症组。并发症组患者肿瘤直径显著高于无并发症组,差异有统计学意义(P<0.05)。经ROC分析显示,肿瘤直径判断观察组患者发生并发症的AUC为0.718(标准差=0.087,95%CL=0.549-0.888,P= 0.026),敏感度为0.583,特异度为0.788,最佳截断值为2.82 cm(见图3)。并发症组和无并发症组患者性别、年龄、BMI、肿瘤部位、分期、病理分型及分化程度比较,差异均无统计学意义(P>0.05),见表4。
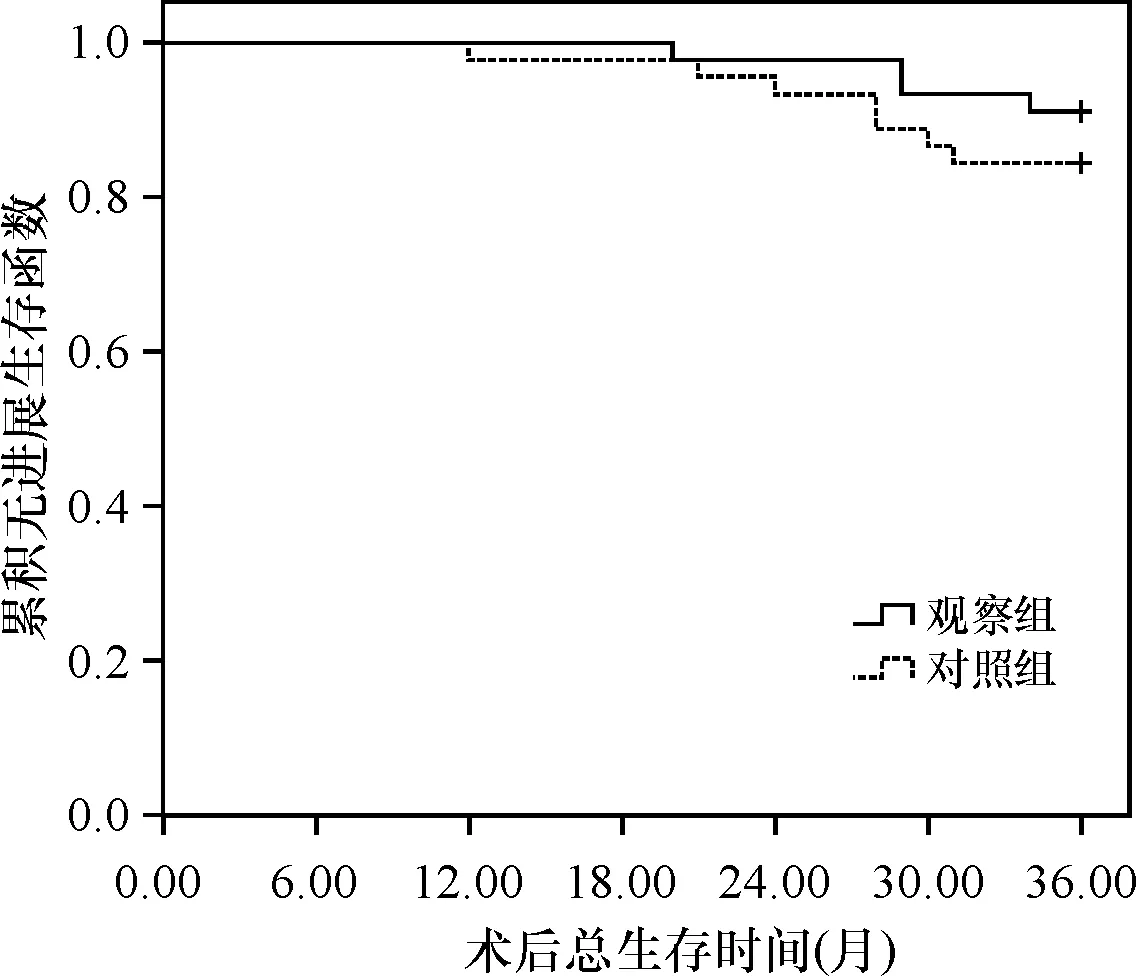
图2 两组术后3年总生存函数比较
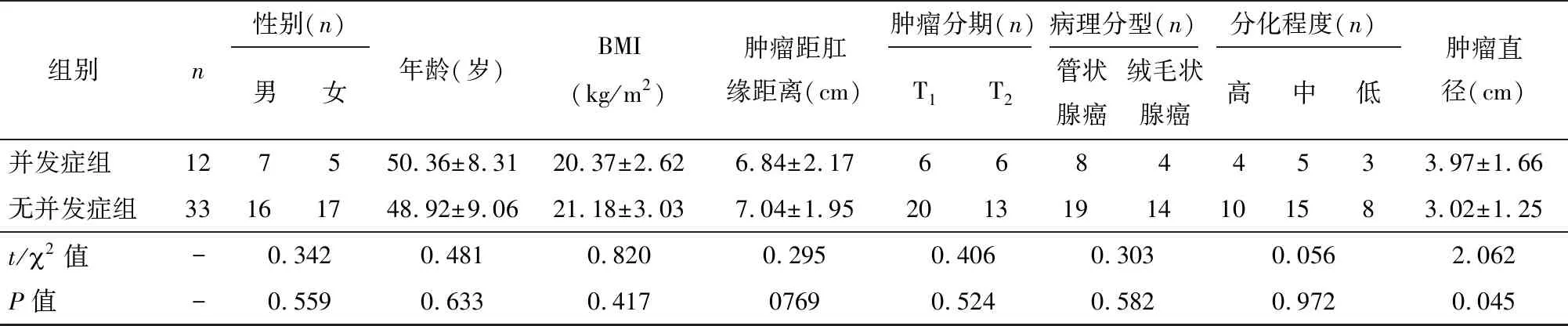
表4 并发症组与无并发症组患者分布特点比较
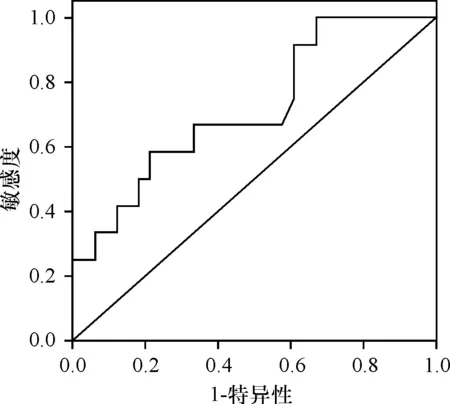
图3 肿瘤直径预测ESD手术并发症的ROC分析
3 讨论
随着医学影像技术的进步,直肠癌早期检出率得到显著改善[7-8],目前,临床多主张对于早期直肠癌患者行根治性手术,可获得良好的生存率[9-10]。但近年来报道显示根治术后多存在肛门排便功能障碍问题,影响患者术后生活质量[11-12]。2008年第二届欧洲直肠癌共识会议指出,对于肿瘤仅局限于黏膜下层的早期直肠癌患者,可施行内镜下切除术[13]。目前,EMR和ESD是内镜下切除术两种主要的术式,EMR将内镜黏膜切除与注射结合,EMR关键在于足量黏膜下注射和肿瘤病灶抬举[14-15],在标记准确后,在清晰的视野下才能准确套扎、彻底切除病变肠段,保证手术的根治性。ESD由EMR演变而来,本研究采用IT刀可一次性整块切除病灶,这有助于获得准确的肿瘤组织分期和病灶残留情况[16]。另外,因EMR术中注射液不能在黏膜下层和固有基层流动[17-18],这可能影响肿瘤病灶彻底切除效果,而ESD可完整切除病灶,因而可降低术后复发率,Martelli M G等[19]研究也显示ESD术后复发率低于EMR,与本文报道一致。
但本研究显示ESD并发症发生率高,手术时间长,这可能与ESD手术操作难度较大有关,倪阵等[20]多因素分析也显示术者经验是影响患者术后并发症的独立因素。为进一步分析ESD术后并发症的发生规律,为ESD在早期直肠癌中的合理应用提供参考,本研究对比观察组并发症发生特点,结果显示两组肿瘤直径差异有统计学意义,ROC分析显示肿瘤直径对预测手术并发症具有较高的准确性,提示肿瘤直径是影响ESD手术并发症的因素。出血是ESD主要的并发症[21-23],肿瘤直径增加出血风险的原因可能与肿瘤血供有关,随着肿瘤直径的增加,血供更加丰富,使术中操作更易引起出血,本研究也显示肿瘤直径超过2.82 cm可显著增加出血等并发症机率,廖斐等[24]也认为对于肿瘤直径超过2 cm的结直肠肿瘤患者应谨慎应用,术中尤其注意操作步骤,注重医护间的配合,尽量减少操作时间,术后则应密切监视大便性状,若发现暗红色或鲜红色,则应引起重视,必要时行钛夹止血,以防治术后出血。
综上,ESD治疗老年早期直肠癌较EMR疗效更好,但手术操作难度较大,术后并发症多,尤其是对于肿瘤直径较大的患者,应注意医护配合,做好防治措施。

