新辅助同步放化疗对食管癌腔镜术患者肿瘤组织细胞活性的影响
罗孟亚男,苏文利,李有强,何贵省,段源成
目前,临床针对食管癌已有多种治疗方式,包括免疫、放疗、化疗、手术等[1]。研究表明任何单一治疗方式的效果均不够理想,如单纯手术治疗的5年内生存率不超过40%,晚期患者治愈率约10%~20%[2]。术前化疗或放疗虽然能使肿瘤切除率提高,但并未使远期生存期延长[3]。近年来,研究发现新辅助同步放化疗对改善手术疗效具有一定价值,其目的在于使肿瘤体积缩小,减轻负荷,下调临床分期,便于提高成功率。然而临床研究中关于新辅助治疗是否会影响患者的肿瘤组织细胞活性尚无定论[4]。肿瘤细胞活性参与了肿瘤细胞侵袭、转移过程,与患者的预后密切相关[5]。为了寻求更好的治疗方案,本次研究纳入116例食管癌患者为研究对象,分析新辅助同步放化疗用于食管癌腔镜术对患者肿瘤组织细胞活性的影响。
1 资料与方法
1.1 一般资料
纳入我院2014年3月至2016年3月收治的食管癌患者116例,根据随机数字表法分成两组,各58例。对照组患者采用食管癌腔镜术治疗,观察组患者在食管癌腔镜术前进行新辅助同步放化疗。对照组男31例,女27例,年龄36~79岁,平均(55.94±12.63)岁;肿瘤部位:胸上段6例、胸中段45例、胸下段7例;病理分型:鳞癌48例、腺癌8例、腺鳞癌2例;cTNM分期:ⅡB期19例、ⅢA期37例、ⅢB期2例。观察组男33例,女25例,年龄35~79岁,平均(54.67±13.49)岁;肿瘤部位:胸上段7例、胸中段42例、胸下段9例;病理分型:鳞癌43例、腺癌11例、腺鳞癌4例;cTNM分期:ⅡB期16例、ⅢA期39例、ⅢB期3例。研究方案经我院医学伦理委员会通过,两组基线资料比较无统计学意义(P>0.05)。
1.2 纳入与排除标准
1.2.1 纳入标准 ①符合中国抗癌协会食管癌专业委员会编撰的《食管癌规范化诊治指南·第2版》[6]中的诊断标准,经病理穿刺证实;②无食管癌腔镜术禁忌;③既往无抗肿瘤治疗史;④无凝血功能障碍;⑤认知功能、意识状态良好;⑥患者及家属知情同意。
1.2.2 排除标准 ①病灶已侵犯到心、肝、肾等重要脏器;②放、化疗敏感性欠佳或不耐受;③血红蛋白<90 g/L,血小板计数 <100×109/L,白细胞计数<4.0×109/L;④既往有精神病史,无法配合研究。
1.3 治疗方法
1.3.1 新辅助放化疗 在给药前常规行超声内镜、腹部增强CT等检查,进一步评估病情。给药方案:第1天,多西他赛(浙江海正药业股份有限公司,国药准字H20093092)静滴,60 mg/m2;第1~3天,顺铂(南京制药厂有限公司,国药准字H20030675)静滴,75 mg/m2;以3周为1疗程,治疗2疗程。放疗:在CT模拟机(飞利浦Brilliance CT Big Bore)下进行定位,层厚为5 mm,将图像上传至治疗计划系统,按照胸部CT定位结果对靶区进行勾画。由2名治疗医师确定靶区。经医用直线加速器(北京M9-XHA600C)进行放疗,剂量2 Gy/次,5次/周,总剂量46 Gy,照射野为在肿瘤病灶与淋巴引流区。
1.3.2 手术治疗 在新辅助同步放化疗后3周行食管癌腔镜术,均行全麻,选取左侧半俯卧位,术者站于病人腹侧,于腋中线、剑突水平线间行切口,以该切口作为胸腔镜观察孔,以腋前线第4肋间行切口,将其作为主操作孔,以肩胛下、腋后线交界处第5、7肋间行切口便于辅助操作。利用胸腔镜对胸腔进行探查,分析是否存在粘连,若有粘连,则逐步分离。观察肿瘤病灶部位,并确定是否存在转移。将纵膈胸膜打开,观察肿瘤形态、位置,并将胸中下段食管分离,达奇静脉弓,采用超声刀将奇静脉弓离断,并对胸上段食管进行分离,操作过程中注意保护喉返神经、胸导管等组织。然后对纵隔淋巴结予以清扫,清扫顺序为上纵膈淋巴结、气管旁淋巴结、主肺动脉窗淋巴结、隆突下淋巴结。最后重建消化道,于剑突下行切口,将该处淋巴结、胃小弯切除,并对管状胃进行制作,行颈部食管胃吻合。术毕对胸腔进行冲洗,关腹。术后常规留置引流管、抗感染。
1.4 观察指标
1.4.1 临床疗效 参考《食管癌规范化诊治指南.第2版》[6]在术后3个月评估,将疗效分为完全缓解、部分缓解、稳定、进展4个等级。完全缓解:经X线检查提示病灶彻底消失;部分缓解:与治疗前相比,病灶缩小≥50%;稳定:与治疗前相比,病灶缩小25%~49%;进展:与治疗前相比,病灶缩小不足25%,或有新病灶形成。总缓解率=(完全缓解+部分缓解)/n×100%。
1.4.2 肿瘤组织细胞活性 分别在新辅助同步放化疗前、疗程结束后测定。取局部肿瘤组织作为标本,置于液氮罐内,加酶溶液反应30 min,在这一过程中对EP管进行震荡,确保二者充分接触。制备悬液,收集细胞行荧光染色,采用流式细胞仪(北京德利卡生物技术有限公司,Attune NXT型)检测食管癌细胞DNA指数(DI)、细胞增殖指数(PI)、S期细胞百分率(SPF)。
1.4.3 免疫功能 分别在新辅助同步放化疗前、疗程结束后各测1次。取3 mL空腹静脉血,离心15 min(3 000 rpm),分离血清,采用流式细胞仪测定CD3+、CD4+、CD8+细胞含量。
1.4.4 远期预后 在患者术后随访24个月,记录远期局部复发率、远处转移率、生存率,参考《食管癌规范化诊治指南.第2版》[6]进行评估。
1.5 统计学方法
2 结果
2.1 两组临床疗效比较
观察组总缓解率为77.59%,显著高于对照组的60.34%,差异有统计学意义(P<0.05),见表1。

表1 两组临床疗效比较 [n(%)]
注:*与对照组比较,2=4.028,P=0.045
2.2 两组治疗前后肿瘤细胞增殖活性比较
两组治疗前PI、SPF、DI比较无统计学意义(P>0.05);观察组治疗后PI、SPF、DI均低于治疗前及对照组,差异有统计学意义(P<0.05),见表2、图1。
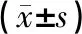
表2 两组治疗前后肿瘤细胞增殖活性比较
注:与治疗前比较,*P<0.05
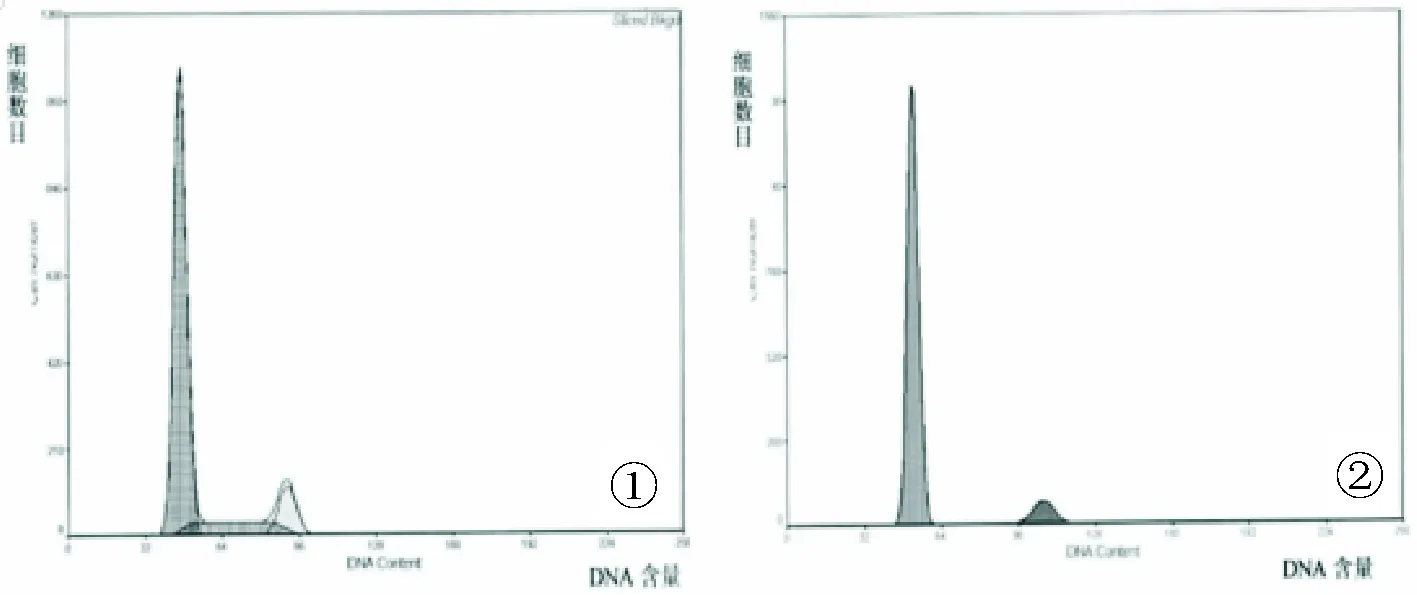
①左峰为G0/G1期细胞,右峰为G2/M期细胞,两者中间平缓地带为S期细胞;②左峰G0/G1期细胞,右峰G2/M期细胞,未见S期细胞
图1 食管癌DNA直方图
2.3 两组治疗前后免疫功能比较
两组治疗前血清CD3+、CD4+、CD8+、CD4+/CD8+水平比较无统计学意义(P>0.05);观察组治疗后血清CD3+、CD4+、CD4+/CD8+水平高于治疗前及对照组,血清CD8+水平低于治疗前及对照组,差异均有统计学意义(P<0.05),见表3。
2.4 两组远期预后比较
观察组局部复发率、24个月内生存率分别为20.69%、63.79%,对照组分别为39.66%、44.83%。观察组局部复发率低于对照组,24个月内生存率高于对照组,差异均有统计学意义(P<0.05),见表4。
表3 两组治疗前后免疫功能比较
注:与治疗前比较,*P<0.05。
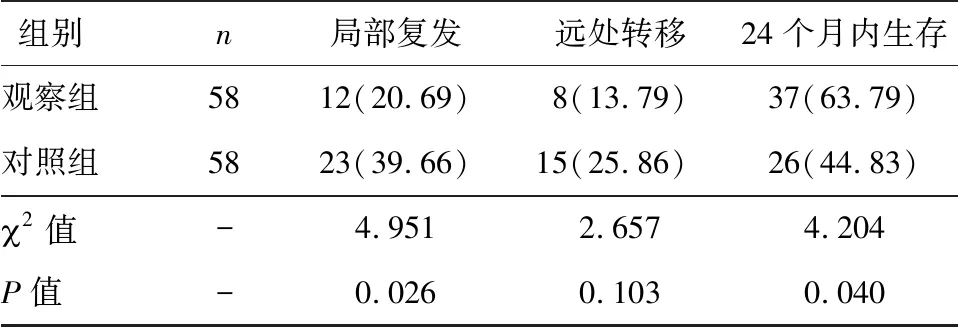
表4 两组远期预后比较[n(%)]
3 讨论
食管癌在我国患病率较高,以食管胸中段居多,上段、下段相对较少[7]。该病早期无特异性症状,大部分患者在出现明显症状后入院就诊,而此时病情往往已进展为中、晚期,治疗难度非常大[8-9]。胸腔镜手术在食管癌治疗中应用非常广泛,但已有研究证实单纯手术治疗并不能取得满意的远期疗效,死亡率仍非常高[10]。
本次研究为了改善食管癌患者的预后,纳入116例患者为研究对象,并设计了两种治疗方案,所有患者均行食管癌腔镜术,其中观察组术前行新辅助同步放化疗,对照组则不进行干预。本研究结果提示术前行新辅助同步放化疗能提高近期总缓解率。本研究中使用的新辅助化疗药物为多西他赛联合顺铂。研究表明多西他赛抗肿瘤活性显著,它对腺癌、鳞癌的治疗均有较高价值,且安全性高,不会引起严重胃肠道副作用[11-12]。顺铂可导致肿瘤组织DNA被破坏,对细胞有丝分裂有抑制作用,抗瘤谱广[13-14]。术前采用多西他赛联合顺铂行新辅助化疗,有利于抑制瘤体进展,为手术治疗提供条件[15-16]。此外,术前同步进行放疗,能将转移至淋巴结内病灶杀死,从而促使肿瘤分期降低,提高病灶切除率[17-18]。因此,术前新辅助同步放化疗能提高手术疗效。
研究表明癌症患者预后情况在很大程度上受DNA拷贝数的影响,二者密切相关,除此之外,S期细胞与病灶分化程度、大小、转移等存在关联,这提示DNA拷贝数以及S期细胞对评估患者肿瘤组织活性具有重要意义[19-20]。本研究发现与对照组相比,观察组治疗后PI、SPF、DI值显著下降,表明术前新辅助同步放化疗能抑制肿瘤组织活性。究其原因可能在于多西他赛联合顺铂能破坏微管网状结构,从而抑制肿瘤增殖活性,将癌灶细胞杀死。而同步放疗则能巩固化疗药物的疗效,进一步抑制肿瘤细胞增殖,从而降低肿瘤组织活性[21-22]。肿瘤是机体组织出现异常恶变所致,它可导致免疫功能下降,机体脏器功能无法充分发挥作用,为肿瘤进展提供了有利条件[23-24]。本研究发现患者术前行新辅助同步放化疗后,T淋巴细胞亚群紊乱状态显著改善,机体免疫能力增强。这可能的机制在于术前新辅助同步放化疗能抑制肿瘤细胞活性,从而减轻病灶对机体功能造成的损害,有利于促进免疫修复。笔者通过24个月的随访,发现术前新辅助同步放化疗能降低远期局部复发率,提高远期生存率,进一步证实这种治疗方案的可靠性。李雷蕾等[25]以直肠癌患者为研究对象,也证实术前新辅助同步放化疗能改善远期预后,与本研究结论基本符合。
综上,本研究证实在术前行新辅助同步放化疗,能抑制肿瘤组织细胞活性,从而改善机体免疫与远期预后。本次研究也存在局限性,如病例纳入时间短,导致样本量较少,在未来的研究中,将扩大样本量,对此进行更深入分析。

