蝙蝠葛苏林碱通过拮抗缓激肽诱导的胞内钙升高发挥神经保护作用
郭华丽,李祖铭,余玲,丁杰,郭莲军
钙离子是细胞内信号传导的重要信使物质之一,神经细胞内钙离子浓度增高可使多种钙依赖性降解酶活性增强;如蛋白酶激活可引起细胞骨架受损,核酸内切酶激活可导致核酸分解。中枢神经系统多种疾病如痴呆、卒中等,均与神经细胞内钙离子的调节紊乱有关[1-4]。
蝙蝠葛苏林碱(daurisoline,DS)从防己科植物蝙蝠葛苏林的根茎中提取,属双苄基异喹啉类生物碱,对多种动物实验性心律失常具有拮抗作用[5,6],并对谷氨酸引起的大鼠大脑皮质神经元损伤有保护作用[7]。目前尚无关于DS影响神经细胞内钙的研究。本研究采用原代培养的大鼠皮质神经细胞,用缓激肽(bradykinin,BK)处理建立胞内钙失衡,诱导神经细胞损伤模型,观察DS对胞内钙增加的作用,探究其对神经细胞的保护作用及可能的机制。
1 材料与方法
1.1 主要试剂与材料
SD乳鼠由华中科技大学同济医学院实验动物中心提供,合格证编号为SCXK(鄂)2014-0007。DS纯度>98%,由华中科技大学同济医学院药理学系提供,用1 mmol/L盐酸溶解,再用2 mol/L NaOH调pH至6.8,配成母液4℃保存。BK、Fur-2/AM、Triton X-100、EGTA、HEPES、DMSO购于Sigma公司,DMEM/F12培养基、胎牛血清、牛血清白蛋白购于Gibco公司;其他试剂均为市售分析纯。
1.2 方法
1.2.1 大鼠皮质神经元原代培养[8]取1~3 d龄的SD乳鼠8~10只,消毒后断头取全脑,分离大脑皮质,人工脑脊液清洗后置于安剖瓶,加2 mL D-Hank’s液,剪成2×2×2 mm3块状物,放于刻度试管内加入0.25%胰酶(1:1),37℃孵育15~20 min后,用吸管吹打混匀,加入少许完全培养基终止消化,用200目筛网过滤后,加入基础培养基至10 mL,1 000 rpm离心10 min 2次;去上清,加入完全培养基,调整细胞密度为5.0×105/mL,分别种植于预先用0.1%多聚赖氨酸包被的96孔板或小盖玻片上,置CO2培养箱内(37℃,5%CO2)培养。培养至第5天,培养液中加阿糖胞苷(终浓度为5 μg/mL)抑制非神经细胞的生长。阿糖胞苷作用48 h后,更换新鲜的完全培养基继续培养,每2天半量换液。培养至第10天时,将细胞分别用于细胞内钙测定和细胞活性检测。
根据处理方式的不同,将细胞分为对照组,BK(1µmol/L)组,DS低(1×10-6mol/L DS+1µmol/L BK)、中(1×10-5mol/L DS+1 µmol/L BK)、高(1×10-4mol/L DS+1µmol/L BK)剂量组,各8个样本。对照组不做任何处理;BK组给予1µmol/L的BK处理;DS低、中、高剂量组分别给予相应浓度的DS预孵育3 min,然后给予1µmol/L的BK处理。
1.2.2 神经元[Ca2+] i测定 以Fura-2/AM为钙指示剂,用细胞内双波长荧光钙成像系统(TILL,德国)进行[Ca2+] i测定。细胞培养至第10天时,取出生长于盖玻片上的细胞,加入荧光探针Fura-2/AM(终浓度1 μmol/L),避光孵育45 min。孵育后的细胞洗涤3次,将贴有细胞的盖玻片放入细胞浴槽中,通过TILL测量系统分别用340 nm和380 nm波长的激发光激发细胞内的Fura-2,检测产生的荧光强度,R值(F340nm/F380nm)与[Ca2+] i正相关,以R值变化表示[Ca2+] i变化。采样频率为1 Hz。胞内钙的变化率计算:[Ca2+] i变化率/%=(胞内钙峰值-基础值)/基础值×100%;基础值为给药前的稳定值,胞内钙峰值为药物处理后的最大值。
DS低、中、高剂量组分别给予相应浓度的DS预孵育3 min后测量基础值。基础值测量完成50 s后,BK组及DS低、中、高剂量组均加入1µmol/L的BK。对照组不作处理。BK加入后立即观察胞内钙变化,记录峰值,计算[Ca2+] i变化率。
1.2.3 细胞形态学与细胞活性检测 将培养至第10天的细胞按以上分组处理,细胞加入BK后继续培养12 h,在显微镜下观察细胞形态学变化。
采用MTT法检测细胞活性。在培养细胞的96孔板中加入MTT(200 μL/孔),37 ℃孵育4 h,去上清,每孔加入150 μL二甲基亚砜,气浴震荡10 min,全自动酶标仪测定各孔在570 nm处的OD值。细胞存活率/%=(实验组OD570-空白对照组OD570)/(正常对照组OD570-空白对照组OD570)×100%。
1.3 统计学处理
2 结果
2.1 DS对BK诱导胞内钙离子浓度升高的影响
加入BK后,培养的细胞胞内钙离子浓度迅速升高,于15~20 s达峰值,随后又逐渐回复至初始水平。DS预处理对BK引起的细胞内钙离子浓度升高有明显的抑制作用,且抑制作用呈浓度依赖性,见表1。
表1 DS对BK诱导的胞内钙离子浓度升高的影响(%,±s)
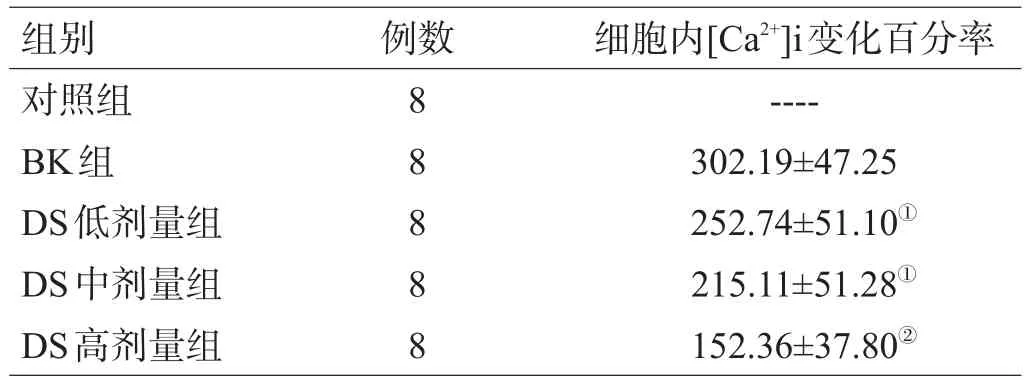
表1 DS对BK诱导的胞内钙离子浓度升高的影响(%,±s)
注:与BK组比较,①P<0.05,②P<0.01
组别对照组BK组DS低剂量组DS中剂量组DS高剂量组例数8 8 8 8 8细胞内[Ca2+] i变化百分率----302.19±47.25 252.74±51.10①215.11±51.28①152.36±37.80②
2.2 DS对BK诱导胞内钙离子升高所致神经损伤的影响
实验结果显示,BK可诱导培养的大鼠皮质细胞受损。BK处理12 h后,神经元数量明显减少,细胞膜不完整、胞体膨胀甚至破裂、细胞核固缩、折光性差;DS各剂量处理组细胞数量明显增加,见图1。MTT结果显示,对照组神经元存活率为100.00%,BK组为(50.61±5.48)%,明显低于对照组(P<0.05);DS低、中、高剂量组的存活率分别为(67.53±8.41)%、(71.50±7.54)%和(89.08±3.23)%,均高于BK组(P<0.05),见图2。
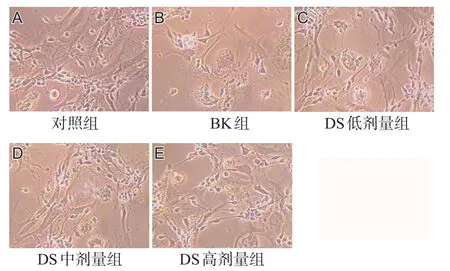
图1 各组经BK处理后的细胞形态
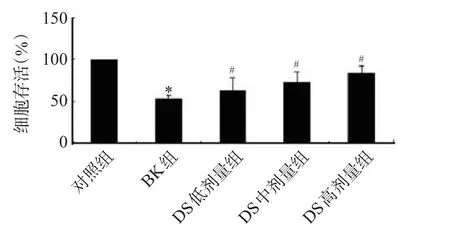
图2 各组细胞存活率柱状图
3 讨论
BK是CaMII特异性激动剂,可与细胞膜上的B2受体结合,通过G蛋白介导激活磷脂酶C,经肌醇磷脂代谢途径,使IP3二酰甘油增加,促使内钙释放和继发性外钙内流,从而导致胞内钙离子浓度升高[9,10]。细胞内钙离子超载,可激活钙依赖性的钙调蛋白,改变细胞的结构和功能,导致细胞损伤。本研究用BK诱导建立胞内钙失衡的细胞模型,采用DS预处理拮抗BK诱导的神经细胞胞内钙离子浓度升高,探讨DS对神经细胞内钙稳态失调的拮抗作用及细胞保护作用。结果显示,DS可浓度依赖性的抑制BK引起的胞内钙离子浓度升高,对BK引起的细胞损伤具有一定的保护作用。但本研究样本量偏少,后续将增加样本量,进一步对其机制进行深入研究。

