原发性胰腺癌的免疫表型研究
邱春燕 郑楷炼 张火俊
1海军军医大学附属长海医院放疗科,上海 200433;2海军军医大学附属长海医院普外科,上海 200433
胰腺癌具有高度侵袭性,发病率为4.2/10万,约60%的患者确诊时已远处转移,5年生存率低, 中位生存时间仅为6~9个月[1-2]。虽然根治性手术是治愈胰腺癌的唯一机会,多项研究表明,化疗和放疗相结合可以最大限度地提高患者的生存率,并显著缓解腹痛等临床症状[3]。随着细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte antigen-4, CTLA-4)及程序性死亡受体1及其配体(programmed death 1/programmed death-ligand 1, PD-1/PD-L1)免疫检查点抑制剂如伊匹单抗、纳武单抗、派姆单抗等在黑色素瘤、非小细胞肺癌和肾细胞癌的治疗研究中显示出较好的效果[4-6],具有潜在治疗价值的免疫检查点分子也被逐步开发,其中包括13个免疫共刺激分子[7-12]及10个免疫共抑制分子[13-16]),这些分子大多尚处于临床试验阶段[17],因此对胰腺癌免疫微环境的全面分析以及分型可能为未来的免疫治疗提供一定的生物学依据。enbabaoglu等[18]利用已发表的特征基因的表达水平来量化肿瘤内24种免疫细胞类型的相对浸润水平,并由MHC-I类基因(HLA-A/B/C、B2M)和参与抗原加工处理的基因(TAP1、TAP2和TAPBP)组成抗原呈递体系(antigen presenting machinery, APM)评分,以及总体免疫浸润评分(immune infiltration score, IIS,包括先天性和适应性免疫细胞的浸润评分)、T细胞浸润评分(T cell infiltration score, TIS,包括CD8+T细胞、Th1、Th2、Th17、Treg、效应性记忆T细胞、中枢性记忆T细胞、T辅助细胞和T细胞等9种T细胞的总体评分)。Yu和Wang[19]利用IIS、TIS和APM评分对肺腺癌、肺鳞癌转录组表达水平进行聚类分析而实现对肺癌的免疫分型。本研究首次利用IIS、TIS和APM评分聚类分析胰腺癌免疫表型,以期为胰腺癌治疗提供生物学依据。
资料与方法
一、一般资料与分组
纳入癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库中的177例原发性胰腺癌患者的临床资料。llumina HiSeq 2000平台保留的标准化3级RNA测序数据及临床数据从https://cancergenome.nih.gov获得。使用版本3.3.2的R软件(http://www.r-project.org)合并数据,利用edgeR包对RNA表达数据标准化后进行log2转化以用于后续分析。
二、免疫细胞亚型浸润分析
基于去卷积的原理,利用算法CIBERSORT对样品中22种肿瘤浸润性免疫细胞亚群的相对纯度进行计算[21-22]。这22种肿瘤浸润性免疫细胞亚群包括中性粒细胞、嗜酸性粒细胞、活化型肥大细胞、休眠型肥大细胞、活化型树突状细胞、休眠型树突状细胞、M2型巨噬细胞、M1型巨噬细胞、M0型巨噬细胞、单核细胞、活化型NK细胞、休眠型NK细胞、γδT淋巴细胞、调节性T淋巴细胞(Tregs)、辅助性滤泡T淋巴细胞、活化型CD4+记忆T淋巴细胞、休眠型CD4+记忆T淋巴细胞、幼稚型CD4+T淋巴细胞、CD8+T淋巴细胞、浆细胞、记忆型B淋巴细胞、幼稚型B淋巴细胞。
三、免疫检查点分子的表达分析
统计TCGA数据库两组患者共刺激分子CD28、ICOSL、ICOS、CD40L、CD40、CD27L、CD27、4-1BBL、4-1BB、OX40L、OX40、GITRL、GITR及共抑制分子CTLA-4、PD-L1、PD-L2、PD-1、VISTA、LAG-3、TIGIT、Galectin-9、 TIM-3、IDO-1 的log2转化后表达水平,并进行Wilcoxon检验。
四、免疫功能的评价
运用Rooney等[23]的方法,使用细胞杀伤活性(cytolytic activity, CYT)对肿瘤中免疫细胞的CYT进行量化,CYT值为穿孔素1和颗粒酶A表达量的几何平均值。利用12种趋化因子CCL2、CCL3、CCL4、CCL5、CCL8、CCL18、CCL19、CCL21、CXCL9、CXCL10、CXCL11和CXCL13表达谱检测肿瘤内部的淋巴细胞聚集状态,并作为免疫激活的标志物。参考Strom等[24]的方法对12种趋化因子表达值进行主成分分析(principal component analysis,PCA),所得的PC1值作为抗肿瘤免疫激活水平的度量。
五、统计学分析
结 果
一、患者的临床病理特征
TCGA数据库的177例胰腺癌患者中男性97例(54.8%),女性80例(45.2%),白人、黑人、亚裔分别为156例(88.1%)、6例(3.4%)、11例(6.2%),平均年龄(64±11)岁。57.0%患者有饮酒史,72.3%无慢性胰腺炎病史,61.0%无糖尿病史。78.0%患者的肿瘤位于胰头部,82.5%为导管腺癌,59.3%切缘阴性,93.8%临床分期为Ⅰ~Ⅱ期,53.2%病理分级为G2级,肿瘤最大直径为(3.86±1.65)cm,平均阳性淋巴结数为(2.91±3.32)个。76.3%采用Whipple术式,63.8%行术后化疗,50.3%行靶向治疗,18.1%行术后放疗。
二、免疫成分高组及低组患者的免疫细胞亚型浸润分析
无监督聚类分析对177例样本的IIS、TIS、APM评分的ssGSEA分析值显示两个主要簇,一个簇(86例)显示出更高的IIS、TIS、APM评分,为免疫成分高组(immune high),另一簇(91例)IIS、TIS、APM评分较低,为免疫成分低组(immune low,图1A)。放疗人群中免疫成分高组生存率略高于免疫成分低组,但差异无统计学意义(P=0.11,图1 B)。
CIBERSORT评估22种免疫细胞的相对浸润程度结果显示,所有177例样本中休眠型CD4+记忆T淋巴细胞、M2型巨噬细胞、M0型巨噬细胞、幼稚型B淋巴细胞和休眠型肥大细胞的相对浸润比例均最高(图1C)。与免疫成分低组比较,免疫成分高组有明显较多的中性粒细胞(63.4%比36.6%)、嗜酸性粒细胞(75.5%比24.5%)、活化型CD4+记忆T淋巴细胞(80.7%比19.3%)、幼稚型CD4+T淋巴细胞(81.2%比18.8%)以及幼稚型B淋巴细胞(59.5%比40.5%);而免疫成分低组有明显较多浸润的活化型NK细胞(67.3%比32.7%)、调节性T淋巴细胞(68.9%比31.1%)、辅助性滤泡T淋巴细胞(67.7%比32.3%)以及活化型肥大细胞(62.9%比37.1%,图1D)。其他免疫细胞亚型,包括休眠型肥大细胞、活化型树突状细胞、休眠型树突状细胞、M2型巨噬细胞、M1型巨噬细胞、M0型巨噬细胞、单核细胞、休眠型NK细胞、γδT淋巴细胞、休眠型CD4+记忆T淋巴细胞、CD8+T淋巴细胞、浆细胞、记忆型B淋巴细胞在两组的相对浸润程度较为一致。
三、免疫成分高组与低组的免疫检查点分子表达
与免疫成分高组比较,免疫成分低组的共刺激分子CD28、ICOS、CD40、CD40L、CD27、CD27L、4-1BB、OX40、GITR以及共抑制分子CTLA-4、PD-L2、PD-1、VISTA、LAG-3、TIGIT、Galectin-9、TIM-3、IDO-1显著高表达,差异均有统计学意义(P值均<0.05,图2)。而共刺激分子ICOSL、4-1BBL、OX40L、GITRL以及共抑制分子PD-L1在两组中的表达差异无统计学意义。
四、免疫成分高组与低组的免疫功能评价
免疫成分高组的12种趋化因子CCL2、CCL3、CCL4、CCL5、CCL8、CCL18、CCL19、CCL21、CXCL9、CXCL10、CXCL11和CXCL13的PC1值显著高于免疫成分低组,差异均有统计学意义(P值均<0.001);免疫成分高组的CYT值也显著高于免疫成分低组,差异有统计学意义(P<0.001,图3)。
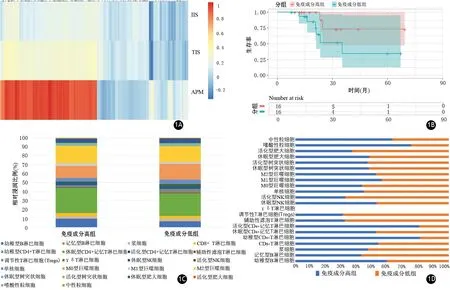
图1 免疫细胞浸润分析的IIS、TIS、APM评分的无监督聚类分析(图1A);放疗患者中免疫成分高组与低组患者的生存曲线及log-rank检验(图1B);22种免疫细胞相对浸润程度的累积条形图(图1C);免疫成分高组与低组的免疫细胞浸润比较(图1D)

图2 免疫成分高组及低组的免疫检查点共刺激分子(2A)和共抑制分子(2B)的表达

图3 免疫成分高组及低组的免疫活性趋化因子PCA的PC1值(3A)和CYT(3B)
讨 论
有研究阐明,活化型CD4+记忆T淋巴细胞[25]、活化型NK细胞[26]在抗肿瘤免疫中有正向调节作用,而调节性T淋巴细胞[27]、活化型肥大细胞[28]在抗肿瘤免疫中有负向调节作用,推测这些不同功能的免疫细胞亚型浸润程度的差异或多或少引起不同免疫表型的功能差异。事实上,前期研究已发现具有Th1表型和细胞毒性模式的记忆T细胞的强烈浸润是肿瘤复发和转移的最强预测因子,这一现象在肿瘤内趋化因子能形成有效免疫反应的结直肠癌中得到验证[29]。本研究纳入的177例TCGA数据库的胰腺癌样本,按照IIS、TIS和APM评分的ssGSEA分析值进行无监督聚类分析,主要区分出免疫成分高组和免疫成分低组两簇。这两组中的休眠型CD4+记忆T淋巴细胞、M2型巨噬细胞、M0型巨噬细胞、幼稚型B淋巴细胞和休眠型肥大细胞的相对浸润比例均最高。免疫成分高组的中性粒细胞、嗜酸性粒细胞、活化型CD4+记忆T淋巴细胞、幼稚型CD4+T淋巴细胞以及幼稚型B淋巴细胞的浸润程度显著高于免疫成分低组,而免疫成分低组的活化型NK细胞、调节性T淋巴细胞、辅助性滤泡T淋巴细胞以及活化型肥大细胞的浸润程度显著高于免疫成分高组。其中的潜在关联尚需更多的体内外实验研究。
目前肿瘤样本上的免疫组织化学检测PD-L1表达水平仍是用于筛选可能对治疗有反应的患者最常用的生物标志物。本研究结果显示,大部分共刺激分子以及共抑制分子均在免疫成分低组显著高表达,提示免疫检查点阻断剂治疗可能对该组人群有效[30]。另外,这种共刺激与共抑制分子的协同表达验证了先前报道的多个免疫检查点分子在T细胞上共表达的结果,为免疫检查点抑制剂或激活剂组合策略的运用提供一定生物学依据[31]。
Rooney等[23]首次对肿瘤中的免疫细胞CYT进行量化,指出CYT值为穿孔素1和颗粒酶A表达量的几何平均值。穿孔素1和颗粒酶A由细胞毒性淋巴细胞分泌的毒素并行使效应功能,不同于诸如PD-L1等基于肿瘤浸润性淋巴细胞的浸润及表达标记,因此CYT值是评价肿瘤浸润免疫细胞功能的指标。研究表明CYT在治疗反应和肿瘤进展的免疫调节中起重要作用。在使用CTLA-4抗体治疗的黑素瘤患者的研究中发现,肿瘤的CYT与肿瘤中的CD8+T细胞浸润程度以及参与MHC I类抗原加工、呈递途径的基因表达密切相关[32]。
12种趋化因子CCL2、CCL3、CCL4、CCL5、CCL8、CCL18、CCL19、CCL21、CXCL9、CXCL10、CXCL11和CXCL13基因是从一系列免疫、炎症相关的基因中筛选而出[33],与结直肠癌和转移性黑色素瘤患者中肿瘤局部异位淋巴结的存在相关,并与患者的生存期改善有关[34]。本研究结果显示,免疫成分高组的趋化因子表达水平PCA的PC1值以及CYT值均显著高于免疫成分低组,反映了免疫成分高组具有更高的免疫激活水平及免疫细胞毒性。这个现象与免疫成分高组具有较高的总体IIS、TIS和APM评分一致,与前述大部分共刺激与共抑制分子在免疫成分低组协同高表达的结果相结合,说明共刺激与共抑制分子虽然协同表达,但共抑制分子在免疫调节中起到决定性作用[35]。
本研究结果还显示,放疗人群中的免疫成分高组患者的生存率略高于免疫成分低组,虽然无统计学差异,但反映了免疫成分高组可能与放疗具有协同作用[36]。因此免疫成分高组人群中行放疗可能使该人群获益,但这一结果尚需要在更大样本人群中进一步验证。
利益冲突所有作者均声明不存在利益冲突

