基于生信分析预测人参-茯苓药对治疗结直肠癌的分子机制*
周小英,苗大兴,符中柱,龚超超,袁盛兰,熊 浩
(1.贵州中医药大学,贵州 贵阳 550002;2.贵州中医药大学第一附属医院,贵州 贵阳 550001)
结直肠癌(colorectal cancer,CRC)在全球范围内是发病率排名第3的癌症,也是全球第2的死亡原因,其中亚洲的死亡率最高,达52.4%[1]。目前CRC的发病率仍处于上升趋势,过去几十年中发病率增加了2倍[2]。目前结直肠癌的治疗主要为手术治疗、放化疗及靶向治疗,但不可避免的存在治疗费用昂贵、副作用大的弊端[3]。祖国医学对结直肠癌研究历史悠久,属中医“锁肛痔”“积聚”“脏毒”“肠蕈”等范畴。在控制疾病的进展,延长患者生存时间,减少不良反应和改善生活质量等有着重要的作用[4]。
人参-茯苓药对来源于四君子汤,为贵州省名中医符中柱教授治疗结直肠癌的经典药对,被广泛应用于CRC的治疗[5]。人参始载于《神农本草经》,主补五脏、安精神、定魂魄、除邪气等功效。临床多被用于抗肿瘤、抗衰老、抗疲劳、调节免疫力及抗菌等[6]。茯苓始载于《神农本草经》,具有利水渗湿、健脾宁心等功效。具有利尿、抗氧化、抑菌、抗炎、抗肿瘤、美白、降血脂、抗癫痫及免疫调节等药理作用[7]。两者合用共筑益气补血、补益脾胃等功效,对结直肠癌后期脾胃气虚型效果显著。目前针对中医药治疗CRC的相关研究越来越多,但仍集中于单味药和复方中药,对药对研究较少。本药对中的人参皂苷、人参多糖等都被证明具有抗肿瘤作用[8],且茯苓的茯苓酸、茯苓新酸等也被证明对肿瘤有很好的抑制作用[9]。但中药的化学成分较多,单成分的研究不能反映中药的多成分、多靶点的作用特点。网络药理学是以网络学方法分析药对、疾病和靶点之间“多成分、多靶点、多途径”作用关系的药理学学科,有利于推进中药现代药理学研究进程。本研究对人参-茯苓药对活性成分的作用靶点及信号通路与CRC疾病的发生发展进行探索,从而阐明人参-茯苓药对治疗CRC的可能作用机制。
1 材料与方法
1.1 结直肠癌的基因数据芯片获取 在基因表达数据库 GEO(https://www.ncbi.nlm.nih.gov/geo/)下载与结直肠癌相关的GSE128449基因表达谱,由Angel Esteban-Gil等提交,实验平台是基于GPL4133平台。总共包含了36个样本,样本都来自于受试者的息肉基因,其中正常组5个样本,结直肠癌31个样本。
1.2 差异基因的获取与分析 使用在线分析软件GEO2R对基因进行分组分析,分为结直肠癌组和正常人组。设置P值和差异倍数(fold change,FC)进行差异基因的筛选。认为当P<0.01并∣log2FC∣>1.5时差异具有统计学意义。使用ImageGP(www.ehbio.com/ImageGP/index.php/Home/Index/)在线制作火山图,Morpheus在 线 工 具(https://software.broadinstitute.org/morpheus/)制作热图。
1.3 人参-茯苓药对成分靶点的获取 使用BATMAN-TCM数据库中输入人参、茯苓,设置预测候选目标积分>20,P<0.05,获得人参-茯苓药对的化合物和可能干预的靶基因。
1.4 关键靶点的筛选及构建蛋白作用网络 将人参、茯苓及结直肠癌的靶基因取交集获取核心靶点基因,并制作韦恩图,将核心靶基因在使用PPI分析数据库STRING构建蛋白相互作用网络,设置人种为“Homo sapiens”,最低互作阈值为 0.4,制作 PPI网络。
1.5 靶点及其对应有效成分的预测 将1.4所获取的核心靶点基因导入BATMAN-TCM系统,得到每个靶点对应的有效成分,使用Cytoscape软件构建疾病-靶点-药物有效成分网络。在生成的网络中节点代表化合物、蛋白质或疾病,连线代表相互作用关系。
1.6 核心靶点的GO分析和KEGG通路富集分析使用R语言对“人参-茯苓”药对治疗CRC的关键靶点进行GO分析与京都基因与基因组百科全书(KEGG)通路富集分析,设置 P<0.05,Q<0.05.分析结果以气泡图展示,仅展示前20个。
1.7 核心蛋白的聚类功能模块分析 将STRING所获得的PPI网络导入Cytoscape软件,使用MCODE插件对差异基因进行模块化分析,筛选积分较高的核心基因,并对核心基因进行生物过程GO分析和KEGG分析,以P<0.05表示具有统计学意义。
2 结果
2.1 结直肠癌差异基因收集结果 CRC患者和正常人之间共有892个差异基因,其中上游基因307个,下游基因585个。图1展示了差异基因的火山图,图3只展示了前30个上调基因和前30个下调基因的热图。
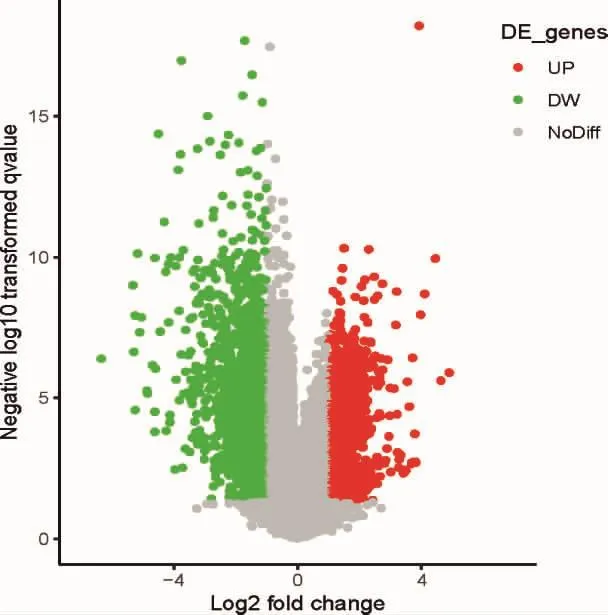
图1 结直肠癌差异基因的火山图分析
2.2 关键靶点的筛选 从BATMAN-TCM中设置预测候选目标积分>20,P<0.05,获得人参的化合物有293个,其中155个化合物含有结构信息,可能干预的靶基因有1 338个;茯苓的化合物共54个,其中21个化合物含有结构信息,可能干预的靶基因有503个;将它们与结直肠癌的差异基因取交集共获得关键基因23个,分别为:LEP、APOE、HTR3A、NPPA、TNF、PTGS2、HMBS、CREB1、AKR1C1、NFKB1、COX5A、 RXRA、 CAMK2D、 PPARG、 HDAC9、GABRA2、IL6、MAOB、 NFIB、 RAB3B、 GRIN1、ADK、RRM2B。结果见图2。
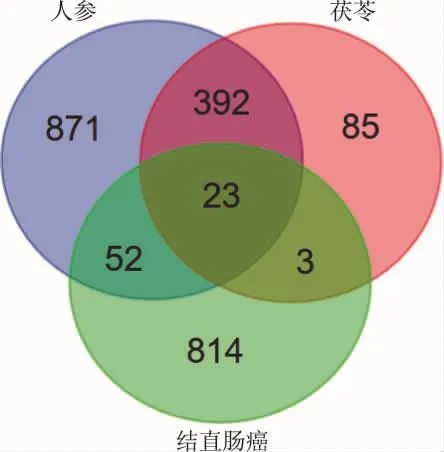
图2 核心基因寻找韦恩图
2.3 化合物分子-靶点相互作用网络图构建 在设置核心靶点基因的积分>20后,筛选靶点基因的化合物,共获得人参相关的化合物有53个,β-榄香烯、δ-榄香烯、草烯、三磷酸腺苷、蝙蝠葛碱、腐胺、腺苷、木糖、鼠李糖、石竹胺、蔗糖、棕榈酸、3,5-二甲基-4-甲氧基苯甲酸、腺嘌呤、γ-谷甾醇、甘露糖、Ginsenol、棕榈酸甲酯、20(S)-原人参二醇、原人参二醇、原人参三醇(皂苷)、尿苷、香茅醇、胆碱、榄香素等。其中的20(S)-原人参二醇、原人参二醇、原人参三醇是人参皂苷的特征类型,已被实验证明有助于肿瘤的治疗[10]。茯苓相关的化合物有11个,分别为齿孔醇、麦角胺、八仙花酸、脱氢苯甲酸、对羟基苯甲醇、腺嘌呤、多孔酸B、麦角固醇、茯苓酸、Undecan-2-Ol、月桂醛,其中茯苓酸已经被证明可调节诱导细胞周期停止和细胞凋亡来达到抗癌作用[11]。如图4所示,将化合物和核心靶点基因构建网络图形,连线代表相关性,分析网络图共含有87个节点,其中代表人参活性成分的节点有53个,茯苓的活性成分节点有11个,节点与节点之间的作用关系共209条,其中腺嘌呤(Adenine)为人参、茯苓共有的化合物。
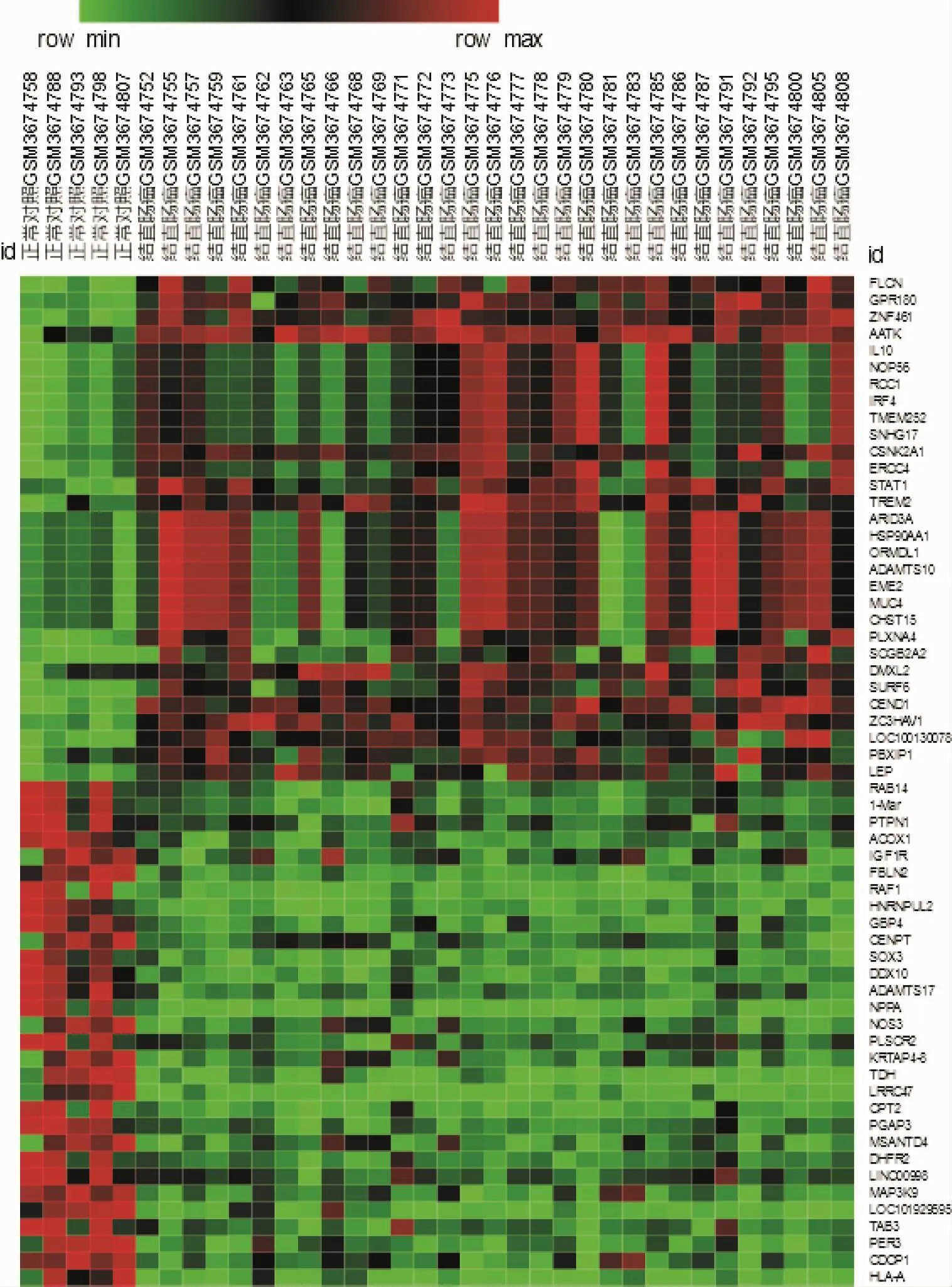
图3 前60个结直肠癌差异表达基因的热图分析
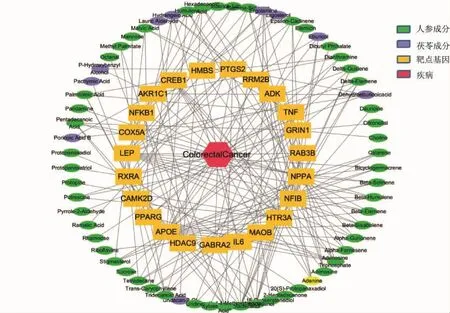
图4 人参-茯苓活性成分-靶点网络
2.4 关键基因的PPI网络构建 将所获得的23个靶点基因输入STRING数据库,构建蛋白互作网络,如图5所示。PPI网络中共包含节点23个,38条相互作用关系。
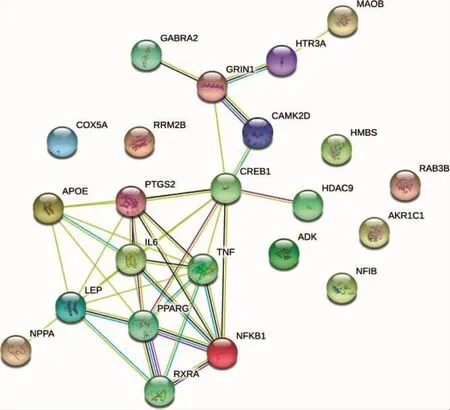
图5 PPI网络图
2.5 GO生物过程分析和KEGG通路分析 对23个关键靶点进行细胞组分、分子功能与生物过程富集分析,其主要富集于发射器门控离子通道活动、发射机门控通道活动、单羧酸结合、激素受体结合、羧酸结合、细胞外配体门控离子通道活性、肌动蛋白结合、核受体活动、转录因子活性,直接配体调节序列特异性DNA结合、类固醇激素受体活性、受体配体活性、抑制转录因子结合、激活转录因子结合等生物学过程。见图6,展示了前20位GO分析结果(气泡大小代表基因富集个数,颜色深浅代表P值大小)。
人参-茯苓药对治疗CRC的关键靶点基因进行KEGG分析,其主要富集于TNF信号通路、HIF-1信号通路、Toll样受体信号通路、NF-κB信号通路、NOD样受体信号通路、PI3K/Akt信号通路、癌症中的转录失调、病毒致癌作用、AMPK信号通路、PPAR信号通路、IL-17信号通路等,以上通路对CRC的发病、进展、侵袭、转移都有着关键性的作用。见图7,展示了前20位KEGG信号通路富集分析。
2.6 核心蛋白基因筛选 通过Cytoscape中Cyto-Hubba插件进行Hub(核心)基因的筛选,使用MCC算法,显示前10个积分较高的基因,分别为TNF、PPARG、CREB1、PTGS2、IL6、LEP、APOE、NFKB1、RXRA、GRIN1。见图 8,其中颜色越深,积分越高。后续对核心基因进一步PPI分析,得出其主要富集于TNF信号通路、Toll样受体信号通路、破骨细胞分化、PI3K/Akt信号通路、癌症中的转录失调、NOD样受体信号通路、NF-κB信号通路等,主要参与生物合成过程和代谢过程的积极调节、甾醇运输、炎症反应、细胞凋亡、细胞死亡、细胞增殖的负调节以及RNA代谢过程的积极调节等生物过程。
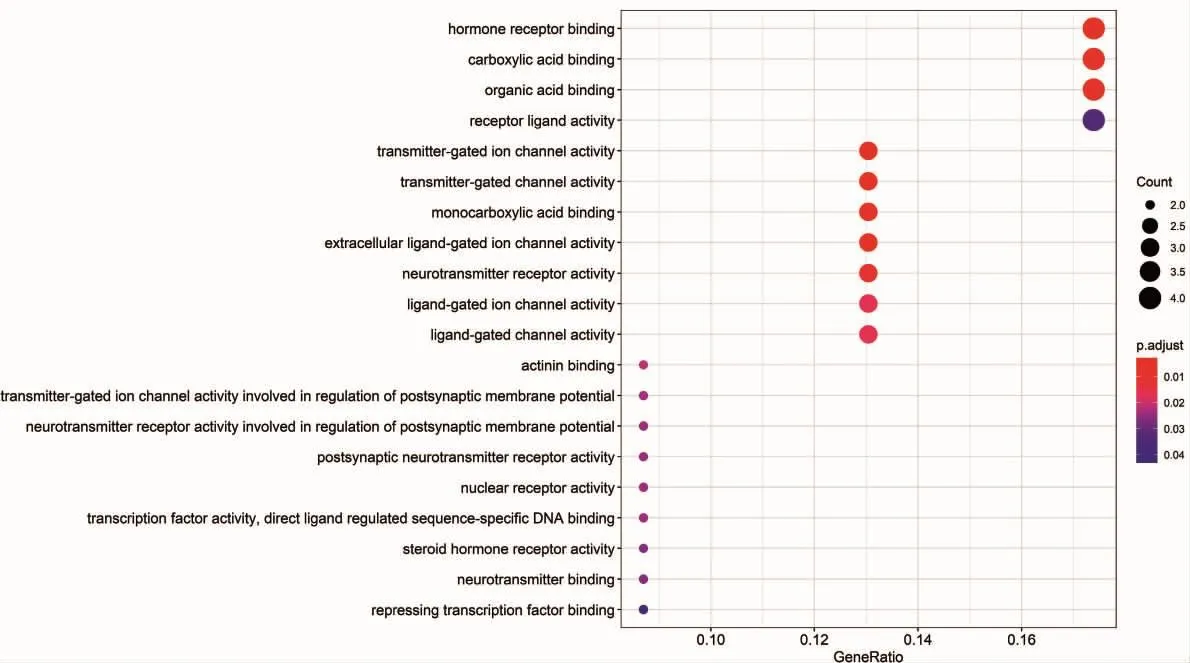
图6 关键靶点的GO分析结果
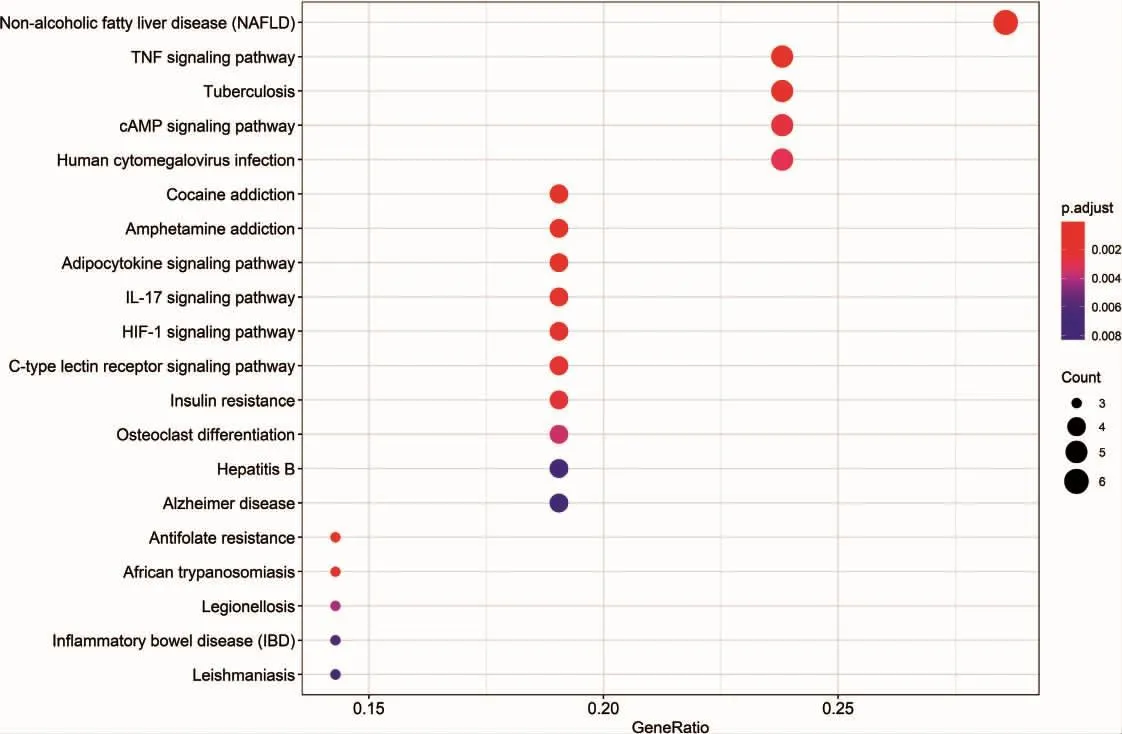
图7 关键靶点的KEGG分析结果
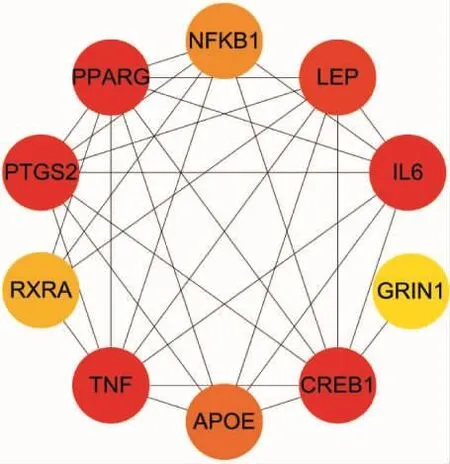
图8 核心基因筛选
图9 TNF信号通路
3 讨论
中医学认为CRC属于“锁肛痔”“积聚”“脏毒”“肠蕈”等范畴。《灵枢·水胀》说:“肠覃何如?岐伯曰:寒气客于肠外,与卫气相搏,……肉乃生。其始也,大如鸡卵,稍以益大,至其成也,如怀子之状,久者离岁,按之则坚,推之则移,……”中医认为结直肠司糟粕传送,CRC的发生是因正气亏虚,邪毒入侵,正气已虚,无力抗邪,致邪气留内,气、瘀、毒停滞于大肠,大肠传导失司,日久则积聚于肠内,发为大肠癌。故结直肠癌与正气亏虚、外邪入侵密切相关,补虚兼以解毒散结是治疗CRC的主要治法。人参、茯苓作为常用的补气健脾中药,合用能益气补血、健脾和胃,使正气得以恢复,在中医药防治CRC中被广泛运用。近年来大量研究都表明,人参、茯苓对CRC有着较好的防治效果[12-14]。
本研究共筛选出63个有效成分,关键靶点基因23个,通过有效成分-靶点基因-疾病网络,共得到87个节点,相互作用关系连线209条。对关键的靶点基因进行GO分析和KEGG通路分析发现其作用主要涉及代谢途径、细胞凋亡、细胞增殖、癌症传导路径等多个方面。
通过文献分析,发现人参的有效成分β-榄香烯可通过下调miR-191改善结直肠癌细胞对5-FU的抗性,抑制Wnt/β-catenin途径,诱导细胞凋亡,从而治疗结直肠癌[15]。有实验证明δ-榄香烯可调节细胞凋亡途径,诱导恶性肿瘤细胞周期停滞[16]。蝙蝠葛碱是人参的活性成分,广泛应用于炎症性疾病中,近年来也发现可用于防治结直肠癌,其途径是通过抑制NF-κB活性及其下游基因的表达影响细胞增殖、侵袭和诱导细胞凋亡[17]。腐胺是细胞合成或从饮食或肠道细菌中获得的小阳离子胺。有研究发现外源性多胺可能对结直肠的健康有益,提示了人参中的腐胺可能是治疗结直肠癌的有效化合物[18]。有研究证明腺苷可通过甲基化途径,抑制细胞增殖,促进结直肠细胞凋亡[19]。有研究表明甘露糖受体(MR)在结直肠癌组织中显著高表达,可作为结直肠癌患者的新型生物标记物[20]。原人参二醇是一种肠道细菌产生的人参代谢产物,可干扰脂质代谢并诱导内质网应激和p53促进结直肠癌细胞的凋亡[21]。另有实验证明原人参二醇可增加化疗药物尿嘧啶对结直肠癌的抑制作用[22]。有效化合物中20(S)-原人参二醇、原人参二醇和原人参三醇都是人参中皂苷的特征类型,已被实验证明有助于癌症的治疗[10]。胆碱是人体必需的营养素,对从细胞维持到产生神经递质的各种功能都是必需的,有研究发现血清胆碱水平对预测所有解剖亚位点的结直肠癌风险具有很强的预后价值,较高的血清胆碱水平与结直肠癌风险增加有关[23]。而茯苓的有效成分麦角甾醇的过氧化物也被发现能下调β-连环蛋白信号传导,影响CRC细胞的增殖和凋亡,从而发挥其多癌症的防治作用[24]。茯苓新酸B属茯苓中三萜类成分,可以抑制癌症细胞的活性,抑制肿瘤的生成[14]。其他有效成分虽尚未发现与结直肠癌有直接关系,但可作为未来深入研究的内容。
通过对关键基因进行筛选,获得积分最高的10个基因,分别为肿瘤坏死因子(TNF)、过氧化物酶体增殖物激活受体γ(PPARG)、CAMP响应元件结合蛋白 1(CREB1)、前列腺素内过氧化物合酶 2(PTGS2)、白细胞介素 6(IL6)、瘦素(LEP)、载脂蛋白 E(APOE)、核因子 kappa b 亚单位 1(NFKB1)、维甲酸X受体α(RXRA)、谷氨酸离子型受体NMDA型亚基1(GRIN1)。其中TNF是多功能促炎细胞因子,主要由巨噬细胞分泌,参与细胞增殖、分化、凋亡等生物过程,与其相关的疾病包括自身免疫、癌症等,在众多试验中被证明是癌症进展的重要因素,也是癌症中重要的检测指标,减少TNF基因的表达可以延缓肿瘤的生长、侵袭和转移[25,26]。PPARG是脂肪细胞分化的调节因子,通过抑制NF-κB介导的促炎反应,作为肠内稳态的关键调节剂,与癌症密切相关。研究发现PPARG基因的多态性可能是CRC的保护因子,会降低整体患CRC的风险[27]。PTGS2是前列腺素生物合成的关键酶,在癌细胞中PTGS2是前列腺素E2(PGE2)产生的关键步骤,其在调节运动性、增殖和对细胞凋亡的抗性中起重要作用,研究表明其是CRC预防和治疗的靶标[28]。IL6是炎症和B细胞成熟中起作用的细胞因子,主要参与调节免疫反应和炎症传导过程,有研究发现通过阻断IL6信号传导可减少结肠相关肿瘤的发生[29]。也有研究表明人结肠中TNF-α和IL6的升高会促进CRC的发生[30]。NFKB1是NF-κB的亚基1,几乎所有细胞类型中存在的多效转录因子,主要参与炎症、免疫、分化、肿瘤发生和细胞凋亡,同时也是NF-κB信号通路的关键基因,而NF-κB信号通路已被证明可用于调节结直肠癌的进展[31-32]。人参-茯苓可能主要通过TNF、PPARG、PTGS2、IL6、NFKB1等靶点来达到治疗作用的。
从富集分析结果发现,其主要与炎症传导和癌症相关信号通路密切相关,包括TNF信号通路、HIF-1信号通路、Toll样受体信号通路、NF-κB信号通路、NOD样受体信号通路、PI3K/Akt信号通路、癌症中的转录失调、病毒致癌作用、AMPK信号通路、PPAR信号通路、IL-17信号通路等。其中TNF的信号传导中的TNF-α、TNF-β都被证明与CRC密切相关,可调节炎症转录因子(NF-κB)及其生物标志物,影响肿瘤的增殖、侵袭、转移和细胞存活[33]。NF-κB信号通路主要参与免疫应答和炎症调节,与癌症的发生和进展密切相关,其主要通过参与细胞增殖和凋亡途径来介导CRC的发展[34-35]。PI3K/Akt信号传导也是癌症中最易被激活的传导途径之一,其在CRC中被过度激活,导致癌细胞凋亡减少,刺激癌细胞的生长[36]等。以上证据表明人参-茯苓药对主要是通过炎症传导和肿瘤相关传导途径来防治CRC的。
综上,本研究使用生物信息分析技术,挖掘到人参-茯苓药对中176个有效化合物,共同干预的潜在靶基因415个,CRC疾病相关靶基因892个,其中药对-疾病共同的靶点共23个,通过对核心靶点基因进行GO分析和KEGG分析得出,人参-茯苓药对可能通过干预 TNF、PTGS2、IL6、LEP、APOE、NFKB1 等靶基因,调控癌症、炎症相关信号通路,TNF信号通路、Toll样受体信号通路、PI3K/Akt信号通路、癌症中的转录失调途径、NOD样受体信号通路、NF-κB信号通路等,从而通过调控细胞凋亡和炎症反应来防治CRC。但本试验仅从GEO数据中获取了36个样本,未包含大样本的基因组分析,也受限于算法和软件的限制,目前只是进行实验数据的分析整理,仍需后期实验的进一步验证。

