子宫血管周上皮样细胞肿瘤一例报告及文献复习
王敏,马帅,简文文,鱼庆,杨淑莉
血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor,PEComa)是一种恶性潜能待定的间叶性肿瘤,由邻近血管壁的血管周上皮样细胞(PEC)组成,临床上比较少见,发生于子宫更为罕见。由于子宫PEComa容易与其他子宫肿瘤相混淆,加之其生物学行为尚未完全确定,早期诊断有一定难度,故备受关注。本文回顾1例子宫PEComa病例资料,旨在提高临床医生对此类肿瘤的认识。
1 病例资料
患者 女,42岁,因体检发现子宫肌瘤进行性增多1年,于2018年10月21日收入吉林大学第二医院(我院)。患者为围绝经期女性,1年前体检发现子宫肌瘤大小约2 cm,未予治疗。后定期复查,入院1 d前于我院复查彩色超声(彩超)提示:子宫腺肌病合并子宫多发肌瘤,遂收入院。妇科超声:子宫前位,7.6 cm×8.0 cm×7.9 cm,内膜厚0.5 cm,宫壁回声不均匀,肌层可见大量点状强回声,肌层增厚明显,于子宫前后壁可见多个低回声结节,最大位于前壁3.7 cm×3.6 cm;双附件区未见明显包块。影像诊断:子宫腺肌病合并子宫多发肌瘤。宫颈液基细胞学检查:无异常。人乳头瘤病毒(HPV)-DNA检测为阴性。于2018年10月25日在全身麻醉下拟行腹腔镜下全子宫及双侧输卵管切除术,术中剖视子宫见肿瘤内容物为灰黑色样组织,其间散在黄色点状组织,见图1。快速病理:(子宫)考虑为PEComa,待通过术后病理进一步确定。不能明确区分良恶性,待术后病理回报后再定下一步治疗方案。术后常规病理:子宫结合免疫组织化学(免疫组化)染色结果支持PEComa,细胞呈上皮样改变,胞浆内见色素颗粒,核分裂像1~2个/50高倍镜视野(HPF),浸润周围平滑肌,无坏死,脉管无浸润,子宫平滑肌瘤,分泌型宫内膜,慢性宫颈炎,(双侧输卵管)慢性炎,见图2。免疫组化染色结果:黑色素瘤特异性抗体 45(HMB45)(+)、MelanA(-)、平滑肌肌动蛋白(SMA)(-)、肌间线蛋白(Desmin)(-)、H-Caldesmon(-)、细胞增殖标志(Ki67)(阳性率小于10%)、神经组织标志(S-100)(-)、波形蛋白(Vimentin)(-)、内皮细胞标记(CD10)(+)、细胞角蛋白 7(CK7)(-)、转录因子 E3(TFE3)(+)、CK(AE1/AE3)(-)。术后病理送至北京协和病理会诊中心会诊,病理诊断同前。患者及家属要求出院,嘱其定期复查。现出院随访中,无瘤生存中。
2 讨论
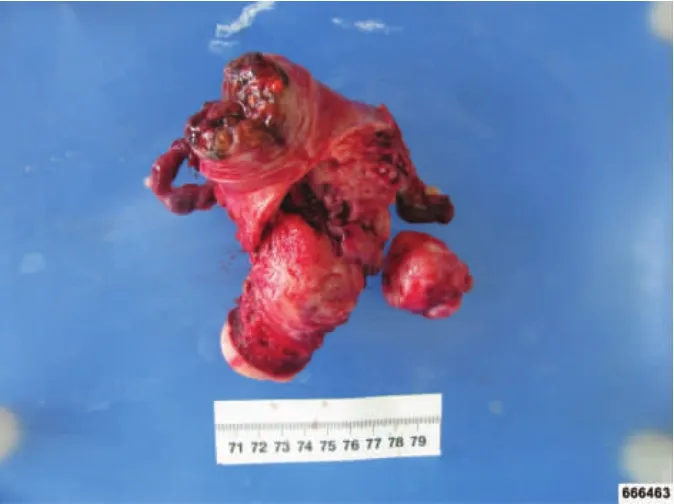
图1 手术切除肿瘤组织

图2 肿瘤组织病理图(HE染色×400)
2.1 PEComa定义及病因Bonetti等[1]于1994年首次提出PEC的概念,Zamboni等[2]1996年通过病例报道首先命名了PEComa。2013年世界卫生组织(WHO)将PEComa定义为免疫表型和病理组织学上具有PEC特征的间叶性肿瘤[3],肿瘤家族包括肺的透明细胞“糖”瘤(clear cell“sugar”tumour of the lung,CCST)、网韧带或镰状韧带的透明细胞肌黑色素细胞肿瘤(clear cell myomelanocytic tumors,CCMMT)、淋巴管平滑肌瘤病(lymphangiomyomatosis,LAM)及肝和肾上皮样血管平滑肌脂肪瘤(angiomyolipoma,AML)等。此外,非特异性PEComa非常少见[4],子宫是非特异性PEComa的好发部位。目前PEComa病因尚不明确,有报道称激素在其病因、发病机制方面可能有一定影响[5]。也有学者认为结节性硬化症(tuberous sclerosis complex,TSC)的基因突变[6]、转录因子 E3(translocation facor E3,TFE3)易位[7]与其发病有关。但上述病因机制还需进一步研究证实。
2.2 PEComa临床表现非特异性PEComa较罕见,最常发生部位在子宫[8],多见于宫体,宫颈罕见,恶性者更为罕见[9]。子宫PEComa年龄分布广泛,19~75岁均可发生,中位年龄为49岁[10]。临床症状多表现为不规则阴道出血或下腹包块,偶伴腹痛,术前极易误诊为平滑肌瘤[11]。多数病例为孤立性结节,但个别也可多发,多位于肌壁间及浆膜下,少数发生于黏膜下[12],直径多为5~8 cm,最大者直径可达30 cm。本例患者术前一度误诊为子宫平滑肌瘤,术中见多个孤立结节,浆膜下黏膜下均有分布,根据病理回报确诊。
2.3 病理特点及免疫表型该病在临床表现和影像学方面缺乏特异性,因此明确诊断主要基于病理学。显微镜下示:肿瘤组织边界清楚,肿瘤细胞呈多边形,胞质丰富,细胞核呈卵圆形或圆形;一些肿瘤表现出侵袭性生长,类似子宫内膜间质肉瘤。2005年Folpe等[11]对PEComa提出的试行标准。①良性者:肿瘤直径多<5 cm,无异常组织学表现。②恶性潜能未定者:仅有肿瘤直径>5 cm,或仅有核多形或多核巨细胞。③恶性者符合下述标准中的2条及以上,肿瘤直径>5 cm,富于细胞和高度核异型,侵袭性生长,核分裂象(>1/50 HPF),伴有血管侵犯和坏死。依据Folpe标准,本例患者肿瘤直径>5 cm,浸润周围平滑肌,核分裂象1~2个/50 HPF,恶性肿瘤的可能性大。PEComa通常表达HMB45、MelanA,其中HMB45最敏感[12];也同时表达肌源性标志物如广谱肌动蛋白、SMA、肌球蛋白[13]。研究发现PEComa常伴有TFE3易位,PEComas大部分细胞对TEF3的表达阳性率明显高于HMB及SMA[14],目前还需多方面探讨PEComa与TFE3基因间的关系[15]。本例患者不仅HMB表达阳性,同时TEF3阳性表达,与以上研究符合。从细胞学水平确诊PEComa非常困难,Stone等[16]2013年首次报道1例通过宫颈细胞学检查发现宫颈PEComa的病例。也有研究发现PEComa可表达神经元特异性烯醇化酶(NSE)、朗格汉斯细胞标志物CD1a[11],但是否具有特异性仍需研究。
2.4 治疗与预后由于子宫PEComa发病率低,临床试验缺少足够相关病例和相关治疗指南,目前主要治疗手段是手术完整切除加术后辅助治疗。对于年轻、有生育要求的女性,若肿瘤性质表现为良性,瘤体较小,可行单纯肿瘤切除术;若恶性可疑大,可切除淋巴结、大网膜及阑尾,术后辅以放化疗,转移或残留的PEComa更适合化疗,如长春新碱、多柔比星、异环磷酰胺等,但疗效尚不确定。有研究用哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂靶向治疗PEComa取得良好效果[11],但有待进一步观察。目前手术治疗仍是唯一有效的治疗手段。核分裂象>1个/50 HPF、瘤体直径≥5 cm与术后复发关系密切,子宫恶性PEComa局部易侵犯阴道、卵巢和肠管,较易远处转移至肺部[17]。术后坚持长期随访,定期复查盆腔彩超,必要时行计算机断层扫描(CT)检查。本例患者核分裂象1~2个/50 HPF,浸润周围平滑肌,恶性倾向性大,该患者虽无坏死及脉管浸润,但仍应坚持术后随访,必要时需辅助治疗。
综上,子宫PEComa属于恶性潜能未确定的肿瘤,生物学特性多样,临床罕见,术前诊断困难,可复发和转移,严重者可致命。临床医生应给予足够重视,根据有无恶性病理表现、患者年龄及有无生育要求等多方面决定具体治疗方案。

