EMSY基因表达水平和多态性与早期卵巢上皮癌患者预后的关系研究
佟春艳,柳春韬,王学慧,刘丽霞
卵巢癌占所有女性生殖系统肿瘤的30%左右,其具有高致死率以及高隐匿性[1]。研究发现,近70%的卵巢癌患者发现时已为晚期,失去最佳治疗时机,主要与卵巢位于盆腔内、早期卵巢癌症状不明显以及缺乏特异性高的生物标志物等有关[2]。卵巢癌的发生、发展与多种因素有关,如环境、工作压力、激素水平变化、绝经前后以及遗传因素等有关。EMSY与乳腺癌易感基因2(breast cancer susceptibility gene 2,BRCA 2)相互作用,参与DNA损伤修复[3]。研究显示,EMSY基因扩增及过表达与多种癌症的发生有关[4]。目前对于早期卵巢癌与EMSY基因表达水平及多态性相关性研究较少,其是否存在相关性仍值得深入研究。本研究旨在探讨EMSY基因表达水平及多态性与早期卵巢上皮癌的关系,以期为临床进一步深入研究早期卵巢上皮癌的发病及预后提供一定的基础。
1 资料与方法
1.1 一般资料选取2010年4月—2013年5月在大连大学附属中山医院(我院)妇科行腹腔镜或开腹行全面分期手术治疗的早期卵巢上皮癌患者118例作为研究组,年龄28~57岁,平均(46.23±8.61)岁,经产史者 107例,绝经者53例。所有患者经术中冰冻切片快速病理检查或石蜡包埋病理切片确诊为卵巢癌,根据国际妇产科联盟(FIGO)分期标准(2009版)进行手术病理分期,确定为Ⅰ~Ⅱ期。纳入标准:①术前及术中检查无腹水或者含少量盆腹腔积液;②病灶仅局限在一侧或双侧卵巢;③盆腹腔、大网膜以及其他部位未见肿瘤病灶组织。排除标准:①诊断不明确或诊断出其他种类恶性肿瘤;②FIGO分期为Ⅲ~Ⅳ期;③合并有糖尿病、高血压、冠心病等慢性病;④临床资料不全或缺少病理标本。另选取同期来我院接受检查的良性妇科肿瘤患者63例作为对照组,经病理检查证实为卵巢囊肿、子宫肌瘤等,年龄29~59岁,平均(47.51±8.83)岁,经产史者57例,绝经者28例。2组年龄(t=-0.944,P=0.346)、经产史(χ2=0.002,P=0.965)和绝经(χ2=0.004,P=0.952)差异无统计学意义,2组具有可比性。
1.2 研究方法
1.2.1 病理组织RNA及全血DNA的提取 采用总RNA提取试剂盒(美国Omega公司)提取所有患者病理组织中总RNA,采用Axygene全血基因组DNA提取试剂盒(美国Axygen公司)提取DNA。经电泳以及紫外分光光度法检测RNA、DNA的浓度及质量,所有样品保存于-80℃冰箱中备用。全血经离心后获得血清,采用酶联免疫吸附(ELISA)试剂盒检测血清中BRCA2的表达水平。
1.2.2 逆转录-聚合酶链反应(RT-PCR)检测EMSY mRNA水平 采用逆转录酶将总RNA逆转录为cDNA,使用PCR仪分别扩增EMSY mRNA、BRCA2 mRNA以及内参基因βactin。其中 β-actin上游引物序列:5′-AGTCTTGCTAGCTACGCGCCT-3′,下游引物序列:5′-CGCTAAAGCTAGCTACGCATCGA-3′,产物长度为290 bp;EMSY mRNA上游引物序列:5′-TAGCGGCTAACGTTTACGCC-3′,下游引物序列:5′-AGGCTGCTAGCTAACCGTCAA-3′,产物长度为 342bp;BRCAmRNA上游引物序列:5′-TGCCATCGATCAATTCGC-3′,下游引物序列:5′-GCATGCTAGCCTTAACGCATCAAC-3′,产物长度为220 bp。引物由上海生工生物工程股份有限公司合成。将5 μL扩增产物经5%琼脂糖电泳进行分离,后经溴化乙锭染色,采用电泳凝胶成像分析系统测定EMSY/β-actin的灰度比,作为EMSY mRNA相对表达量。
1.2.3 基因分型检测 采用PCR-限制性片段长度多态性(RFLP)技术检测EMSY基因421+242A>G位点多态性。引物以及探针经Primer Express 2.0软件进行设计,并经上海生工生物工程股份有限公司合成。上游引物序列:5′-CGCGTGCGTTTCGAACCGCTGGCTAGC-3′,下游引物序列:5′-GGCGTCAAATCAGTACGCTGGTAC-3′。PCR扩增体系为25 μL,其中含有 5 μL PCR缓冲液,上游及下游引物各0.5 μL,5 U/L Taq DNA 聚合酶 0.25 μL,2.5 mmol/L 三磷酸碱基脱氧核苷酸(deoxyribonucleotide triphosphates,dNTPs)4.0 μL,剩余加入双蒸水。EMSY基因421+242A>G位点的扩增反应条件为:94℃预变性2 min,而后按照94℃30 s、59℃30 s、62℃ 15 s的顺序进行40个循环,最后以62℃延伸1 min。PCR扩增产物长度为310 bp。所有样本均在ABI-7500 Fast RT-PCR电泳仪上进行反应,抽取10%的样本进行基因测序,从而确定基因分型检测的准确性。
1.2.4 随访 通过电话咨询、门诊复诊等方式详细记录患者信息,随访时间从术后出院至随访截止时间(2018年7月31日),随访中位时间38个月,记录研究组患者术后化疗、术后复发以及术后生存情况(主要包含术后死亡原因、死亡时间以及生存时间等)。
1.3 统计学方法采用SPSS 19.0统计软件进行数据分析。定量资料用均数±标准差(±s)表示,两组间比较采用两独立样本均数的t检验,多组间比较采用单因素方差分析;采用卡方检验或Fisher确切概率法分析2组等位基因和基因型频率分布情况;群体基因型采用Hardy-Weinberg平衡检验;采用Kaplan-Meier法进行卵巢上皮癌患者术后的生存分析,比较采用Log-rank检验;采用Cox回归模型分析评估各病理参数对预后的相对危险度。P<0.05为差异有统计学意义。
2 结果
2.1 RT-PCR检测EMSY mRNA表达RT-PCR检测结果显示,研究组EMSY mRNA相对表达量(0.813±0.126)高于对照组(0.274±0.088),差异有统计学意义(t=33.592,P=0.000);研究组 BRCA2 mRNA 相对表达量(0.366±0.060)高于对照组(0.170±0.044),差异有统计学意义(t=25.046,P=0.000)。见图1。

图1 RT-PCR检测2组EMSY mRNA表达情况
2.2 EMSY mRNA表达与早期卵巢上皮癌患者临床病理因素的关系年龄、绝经、FIGO分期、分化程度、病理类型、术后化疗和术后复发与患者EMSY mRNA表达水平有关,差异均有统计学意义(均P<0.05)。经产史和体质量指数(BMI)与患者EMSY mRNA表达水平无关,差异无统计学意义(均P>0.05)。见表1。
表1 EMSY mRNA表达与早期卵巢上皮癌患者临床病理因素的关系 (±s)

表1 EMSY mRNA表达与早期卵巢上皮癌患者临床病理因素的关系 (±s)
变量 n EMSY mRNA相对表达量 t或F P年龄 18.823 0.000≥45岁 70 0.870±0.065<45岁 48 0.650±0.058经产史1.274 0.239是107 0.770±0.041否11 0.740±0.077绝经19.262 0.000是53 0.880±0.065否65 0.640±0.069 BMI(kg/m2)1.371 0.173≥25 42 0.790±0.061<25 76 0.773±0.067 FIGO分期 17.611 0.000Ⅰ97 0.607±0.050Ⅱ21 0.910±0.075分化程度 224.967 0.000低分化 53 0.909±0.057中分化 33 0.759±0.095高分化 32 0.560±0.072病理类型 27.854 0.000浆液性乳头状癌 79 0.650±0.065黏液腺癌 32 0.727±0.068透明细胞癌 7 0.803±0.074术后化疗11.279 0.000是110 0.614±0.065否8 0.883±0.064术后复发18.801 0.000是18 0.900±0.076否100 0.610±0.057
2.3 EMSY基因421+242A>G位点电泳产物EMSY基因421+242A>G位点酶切过程中呈现一条亮带且长度为326bp的条带为GG型;长度分别为123、286、326 bp的3条亮带为AG型;长度分别为123、286 bp的2条亮带为AA型。随机选取EMSY基因421+242A>G位点的PCR扩增产物行基因测序,结果显示碱基的改变与酶切结果一致。见图2。

图2 EMSY基因421+242A>G位点电泳及基因扩增序列图
2.4 EMSY基因421+242A>G位点基因频率分布情况2组患者EMSY基因421+242A>G位点基因型(χ2=1.287,P=0.149)及 A、G 等位基因频率(χ2=1.056,P=0.164)符合 Hardy-Weinberg遗传平衡定律,提示样本具有群体代表性。研究组该位点3种基因型和2种等位基因分布频率与对照组比较,差异有统计学意义(均P<0.05)。见表2。
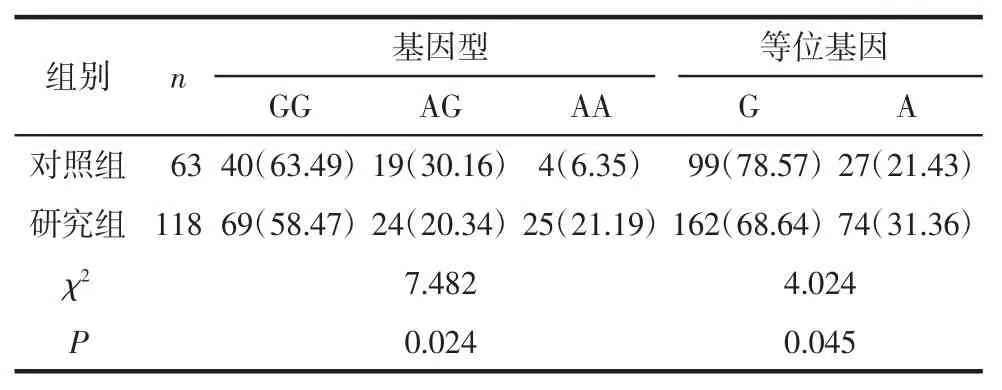
表2 EMSY基因421+242A>G位点基因频率分布情况[n(%)]
采用ELISA法检测2组不同基因型患者血清BRCA2表达水平。结果显示,研究组AA型BRCA2(29.79±3.68)mg/L、AG 型 (28.31±4.19)mg/L、GG 型(25.87±6.38)mg/L,对照组 AA 型 BRCA2(20.69±6.74)mg/L、AG 型(21.78±7.21)mg/L、GG 型(21.19±7.39)mg/L,2组差异均有统计学意义(t=9.954,P=0.000;t=6.617,P=0.000;t=4.445,P=0.000)。
2.5 研究组不同基因型生存分析研究组不同基因型之间总生存期、疾病无进展生存期差异有统计学意义(χ2=7.590,P=0.022;χ2=8.415,P=0.015)。GG 基因型总生存期、疾病无进展生存期与AA基因型比较差异有统计学意义(Log-rank χ2=7.482,P=0.006;Log-rank χ2=8.406,P=0.004)。见图 3。将年龄、FIGO分期、分化程度、病理类型、EMSY mRNA、EMSY多态性及术后化疗纳入Cox风险回归模型行多变量分析,结果显示EMSY mRNA高表达是影响患者总生存期的危险因素(OR=2.322,95%CI:1.277~5.031,P=0.027),AA基因型是影响患者疾病无进展生存期的危险因素(OR=1.882,95%CI:1.192~4.323,P=0.039)。

图3 Kalplan-Meier法分析早期卵巢上皮癌患者总生存期、疾病无进展生存期情况
3 讨论
上皮性卵巢癌是妇科较为常见的女性生殖系统肿瘤,5年生存率约30%。研究显示,我国卵巢癌发病率较高,且呈逐年上升趋势。卵巢癌组织类型较为复杂,发病时隐匿性高,多数患者初诊时已为晚期(Ⅲ~Ⅳ期),而早期卵巢癌(Ⅰ~Ⅱ期)预后较好,因此早发现、早治疗对于患者预后有明显改善作用。Matsuo等[5]研究显示,早期卵巢癌患者行腹腔镜全面分期手术术后复发率约为13%。本研究发现经手术治疗后复发率为15.25%(18/118),略高于国外研究报道,原因可能为:①纳入的Ⅱ期卵巢癌患者例数稍多;②纳入的118例患者有53例为低分化,属于高危患者。
EMSY位于染色体11q13,编码1 322个氨基酸,其“N”末端约有100个保守的氨基酸序列。而在恶性肿瘤中常伴有11q13位点的扩增[6]。Dansonka-Mieszkowska等[7]研究采用荧光原位杂交法(fluorescence in situ hybridization,FISH)检测28个乳腺癌细胞系EMSY的扩增情况,发现有5个细胞系伴有EMSY扩增。Jelinic等[8]对875例散发性妇科肿瘤患者的研究发现,65例患者表现出EMSY高扩增。EMSY能够与BRCA家族中BRCA2以“伙伴”形式出现,且EMSY蛋白可与BRCA2结合并抑制BRCA2的活性,当EMSY过表达时,可使BRCA2失活,导致染色体不稳定以及癌变[9]。目前研究发现散发性乳腺癌、卵巢癌、胰腺癌、甲状腺癌以及前列腺癌等癌细胞系中均能检测到EMSY mRNA及蛋白产物。本研究发现,卵巢上皮癌患者病理组织中EMSY mRNA与BRCA2 mRNA相对表达量均高于对照组,且ELISA检测发现研究组不同基因型BRCA2表达水平高于对照组,提示EMSY与BRCA2以“伙伴”形式共表达于早期卵巢上皮癌患者体内,从而影响疾病的发生、发展。需要指出的是,BRCA2在绝经、年龄≥45岁的卵巢癌患者体内高表达,而本研究也发现≥45岁、绝经、FIGO分期Ⅱ期、低分化、透明细胞癌、术后未化疗和术后复发患者EMSY mRNA表达水平均较高,提示上述因素可能与EMSY、BRCA2过表达和卵巢癌患者预后有关。
目前对于EMSY基因多态性与早期卵巢上皮癌预后的关系研究报道较少,尤其是国内鲜有关于该基因位点与早期卵巢癌关系的研究报道。本研究发现,研究组EMSY基因421+242A>G位点AA基因型、A等位基因频率高于对照组,提示EMSY基因421+242A>G位点可能为早期卵巢上皮癌发病的易感基因。为进一步探讨EMSY基因421+242A>G位点与早期卵巢上皮癌预后的关系,Kalplan-Meier法分析显示,该位点GG基因型总生存期、疾病无进展生存期高于AA基因型;Cox风险模型显示,AA基因型是早期卵巢上皮癌患者疾病无进展生存期的危险因素,提示EMSY基因421+242A>G位点为早期卵巢上皮癌预后的重要基因位点。
综上所述,初步研究证实EMSY基因表达水平及421+242A>G位点多态性与早期卵巢上皮癌预后有关。目前对于BRCA2与卵巢癌的关系已经得到初步证实,但不同基因型卵巢癌患者BRCA2表达水平不尽相同,表明EMSY基因表达可能影响BRCA2的表达,从而影响卵巢癌患者预后。仍有待进一步大样本、多中心研究,为卵巢癌的临床治疗和预防提供依据。

