沸石处理模拟生活污水中氨氮效果影响因素分析
(哈尔滨商业大学食品工程学院环境工程系,哈尔滨 150076)
0 引 言
沸石(Zeolite),是沸石族矿物的总称,是一种含水的碱金属或碱土金属的铝硅酸矿物[1-2],化学组成可以在相当大的范围内变化,因而很多沸石只能给出近似的化学式,理想的沸石化学式为[3]:Mx/n[AlxSiyO2(x+y)]·pH2O,式中M为碱金属(如Na、K、Li)和/或碱土金属(如Ca、Mg、Ba、Sr),n是阳离子电荷数。一般沸石的化学式还可写成氧化物形式:M2/nO·Al2O3·xSiO2·yH2O,从上式可以看出,沸石的化学成分实际上是由Al2O3、SiO2、H2O和金属阳离子四部分构成。
黑龙江省海林沸石岩矿区有丰富的沸石资源,目前天然沸石是一种新兴材料,被广泛应用于工业、农业、国防等部门[4],由于天然沸石对氨氮具有选择交换性,因此已经被成功地应用于污水处理领域[5]。例如,美国和日本都已经建造了一定规模的天然沸石污水处理厂。对比传统活性法生物脱氮工艺,沸石去除氨氮具有效果好,节约曝气能耗等优点[6-8]。文中采用海林地区的天然沸石,用于处理模拟生活污水,考察投加量、吸附时间、氨氮初始浓度和pH值等因素对污水中氨氮的处理效果。
1 实验材料与方法
1.1 实验方法
称取30 g相同粒径天然沸石放入500 mL锥形瓶中,加入所配制的10 g/LNH3-N(C0)的NH4Cl溶液200 mL,置恒温水浴振荡器中于25 ℃下振荡,使氨氮在液相和沸石固相间分配达到平衡,72 h后取出样品静置15 min,取上清液测定NH3-N平衡浓度(Ce),计算沸石对NH3-N的吸附容量(mg/g),其计算公式如下:
Q= (C0-Ce)×V/m
(1)
式中,C0为NH4Cl溶液起始浓度,mg/L;Ce为吸附后NH4Cl溶液平衡浓度,mg/L;V为溶液体积,L;m为沸石重量,g。
1.2 实验水质
实验向蒸馏水中分别加入适量啤酒,氯化铵以及磷酸二氢钾以模拟生活污水作为实验原水,使原水中氨氮含量、COD及正磷酸盐含量,维持于下表1所示范围以内。

表1实验用水水质范围
1.4 分析项目与方法
实验分析项目与方法见表2。

表2分析项目及方法
2 实验结果与分析
2.1 沸石投加量的影响
称取沸石1、2、3、4、5 g,置于盛有200 mL废水、氨氮浓度为100 mg/L的烧杯中,进行搅拌吸附实验(25 ℃、150 rpm),3 h后测水中的氨氮值。不同沸石量对氨氮吸附的影响。
随着沸石量的不断增加,对于氨氮的去除呈不断增加的趋势,当沸石量为1 g时,3 h后对于氨氮的去除率为33.4%,再增加到4 g的时候,沸石对氨氮的去除率达到80.5%。之后,再随着沸石量的增加,氨氮去除率逐渐趋于平缓,氨氮的去除率基本维持这个水平。因此,在模拟生活污水的氨氮浓度条件下,适宜的沸石投加量为4 g/200mL。
2.2 沸石吸附时间的影响
选择沸石的投加量为4 g,考察不同的吸附时间对氨氮去除效果的影响,吸附时间选择1~10 h,在1~3 h之间,随着吸附时间的增加,氨氮去除效果增加较快。3~10 h之后氨氮去除率变化不明显,基本维持在70%~80%左右。因此,吸附时间选择3 h较适宜。
2.3 氨氮初始浓度影响
氨氮的浓度差为克服由水相到固相表面传质阻力提供了动力,同时也影响着沸石对其吸附的能力和效率,通过考察不同氨氮初始浓度下沸石对其的去除情况,可以大致了解沸石的去除能力。
取4 g沸石放在6个盛有200 mL、氨氮浓度分别为30、50、100、150、200 mg/L的烧杯中,进行搅拌吸附实验(25 ℃、150 rpm),每隔半个小测定水样中剩余氨氮的浓度。
不同氨氮初始浓度(30~200 mg/L)下沸石对其吸附去除的情况,可见沸石对氨氮具有较好的去除能力,去除率达到了56%~95.2%。在开始的2小时之内,对氨氮的吸附速率很快,之后速率逐渐降低并达到吸附平衡,氨氮的去除率趋于稳定。
在吸附达到平衡后,计算了平衡时的去除率和氨吸附量。然而随着氨氮初始浓度由30 mg/L增加至200 mg/L,其去除率呈下降趋势,由95.2%降为56%,相反沸石的吸附能力则由1.9 mg/g提高到7.5 mg/g。其原因是沸石表面的吸附位随着氨氮浓度增加很快达到饱和,从而造成目标物去除率的明显降低,同时氨氮浓度的提高也会加大吸附过程的传质动力,进而强化其向沸石内部扩散,使沸石吸附能力得到大大提高。
2.4 pH值影响
废水的pH值是影响沸石吸附性能的重要影响因素,一方面因为它影响着被吸附物质的存在形式,另一方面也影响到吸附剂表面电荷的特性。pH对于氨氮的去除影响主要是由于H+与氨氮的竞争吸附和在不同的pH条件下会改变氨氮的形态,随着氨根离子的被沸石吸附,溶液的pH会不断升高,见公式2所示。因此,pH影响沸石对于氨氮的吸附。
(2)
取7份4 g沸石,在常温下进行3 h的搅拌实验(25 ℃、150 rpm)。原水的体积为200 mL,氨氮浓度为100 mg/L。调整溶液的pH值分别为4.0、5.0、6.0、7.0、8.0、9.0、10.0,然后静沉测水中剩余氨氮浓度,计算去除率。结果如图1所示。
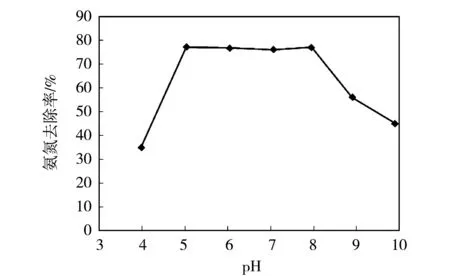
图1pH对氨氮去除的影响
实验结果表明,当原水pH值在5~8时,沸石的吸附量与氨氮的去除率变化不大;当原水pH值在5~8之外时,沸石的吸附量与氨氮的去除率急剧下降。这是由于在pH值较低时,由于H+的浓度较高,NH4+必然在沸石交换位置上与H+产生竞争交换,故沸石对NH4+的去除率较低。当水的pH值接近7时,H+的影响较小,主要表现为沸石对NH4+的交换吸附,因而沸石对NH4+的吸附率达到最高。当pH值继续升高,水中OH-增多,NH4+易与OH-结合,形成游离态的NH3。NH3不带电,不易与沸石中的Na+发生离子交换,主要依靠沸石的表面吸附作用,故沸石对NH4+的去除率降低,而当pH值达到碱性范围后,NH4+与OH-结合形成氨气,溶液中NH4+浓度逐渐变小,从而使水体中NH4+浓度进一步降低。
可见污水pH值范围在5~8时,沸石吸附氨氮效果最好,而在pH在5~8范围以外运行时,沸石对氨氮吸附能力会降低。
3 结束语
采用天然沸石处理模拟生活污水,考察投加量、吸附时间、氨氮初始浓度和pH值等因素对污水中氨氮的处理效果,结果如下:
(1)模拟生活污水的氨氮浓度条件下,适宜的沸石投加量为4 g/200 mL。
(2)在1~3 h之间,随着吸附时间的增加,氨氮去除效果增加较快。3~10 h之后氨氮去除率变化不明显,基本维持在70%~80%左右,吸附时间选择3 h较适宜。
(3)不同氨氮初始浓度(30~200 mg/L)下,氨氮的去除率达到了56%~95.2%。2 h后去除速率逐渐降低并达到吸附平衡,氨氮的去除率趋于稳定。吸附达到平衡后,随着氨氮初始浓度增加,去除率呈下降趋势。
(4) pH值范围在5~8时,沸石吸附氨氮效果最好。

