乳腺组织中SMG-1mRNA和SOX4mRNA检测在乳腺癌监测中的应用*
李 娜,赵晓娟,苏晓明
(咸阳市第一人民医院,a.检验科;b.妇产二科,陕西咸阳 712000)
乳腺癌是一个重要的公共卫生问题,近年来其较高的发病率严重影响妇女的生活质量[1]。有报道认为乳腺浸润性导管癌(invasive ductal carcinoma,IDC)占所有乳腺癌发病率的75%[2]。乳腺非典型增生(atypical ductal hyperplasia,ADH)被认为是IDC生物学连续性的早期步骤[3-4]。研究认为生殖器形成抑制基因-1(SMG-1)和SOX4基因与多种肿瘤的发生发展密切相关,并且在乳腺癌的发生中发挥潜在的作用[5-6]。本研究通过分析乳腺组织SMG-1mRNA和SOX4mRNA的表达,旨在探讨其与IDC发生发展的关系,并为IDC的早期发现提供基因依据。
1材料与方法
1.1 研究对象 收集2008年5月~2015年5月于咸阳市第一人民医院就诊的45例IDC患者(IDC组)以及32例ADH患者(ADH组)的临床资料和病理组织标本进行回顾性分析,同时取癌旁正常乳腺组织30例作为对照。所有患者均为女性,IDC组患者年龄35~73岁,平均年龄51.6±9.3岁,ADH组患者年龄30~65岁,平均年龄45.6±7.7岁,对照组患者年龄33~71岁,平均年龄49.3±8.3岁。所有患者术前均未行放、化疗等抗肿瘤治疗。45例IDC患者术后18例被发现远处转移,8例死亡,无转移27例,随访截止至2017年10月。所有病例HE切片均按照最新乳腺病理诊断标准统一复核后入组。乳腺癌的复发或转移病灶确诊均行活检证实。本研究经本院伦理委员会批准,并获得所有患者或其亲属的知情同意。
1.2 试剂和仪器 RNA提取应用美国Invitrogen公司产品。PCR试剂盒购自上海久盛医疗用品有限公司。lightCycler荧光PCR仪和罗氏Modular P800生化分析仪采用德国Roche公司产品。
1.3 研究方法 血清CA153和CEA水平采用罗氏Modular P800生化分析仪测定。SMG-1mRNA和SOX4mRNA的检测应用RT-PCR技术。
1.3.1 标本收集与处理:所有患者于术前采集空腹静脉血4 ml,分离血清于-80℃保存,用于检测CA153和CEA水平。乳腺组织标本均来源于石蜡标本。
1.3.2 RNA提取:采用Trizol法提取组织中的总RNA,采用260 nm和280 nm波长处的光密度比值来验证RNA的纯度。
1.3.3 引物设计:采用pfimer5软件设计引物,引物序列如下:SMG-1mRNA上游5’-AAGAUUGUGAUCCCGUCUGACCG-3’,下游5’-CCUUCGGGGAUCAAUUAGUUAG-3’,扩增产物长度为390bp;SOX4mRNA上游5’-TGTAGTTT CGGAGTTAGTGTCGCGC-3’,下游5’-CCTACGATCGAAAACGACCCGAACG-3’,扩增产物长度为350bp;采用β-actin作为内参,其引物序列为上游5’-AGAAAGCGCGGGTCTGACGTA-3’,下游5’-GTGGAGGACGACGGGATGG-3’,扩增产物长度为720bp。
1.3.4 PCR扩增:取2 μl RNA溶液,加入2 μl的RT Primer和7 μl的无核酸酶水,于70℃反应10 min。然后加入5 μl RT buffer,2 μl dNTP,0.5 μl RNase inhibitor,0.5 μl RT 酶,6 μl ddH2O,然后进行逆转录,反应条件为42℃ 60 min,70℃ 10 min,于4℃保存。扩增产物采用3 g/dl琼脂糖凝胶电泳分析,用花青素溴化乙锭染色,并通过凝胶成像仪扫描得到Ct值。Ct值的变化以△Ct表示。△Ct=β-actinCt-XnCt,β-actinCT表示内参的Ct值,Xn表示检测对象的Ct值。SMG-1mRNA和SOX4mRNA的相对表达量通过2—△Ct得到。
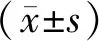
2结果
2.1 各组血清CA153和CEA水平及异常率比较 见表1。与对照组比较,血清CA153和CEA水平在ADH组与IDC组中显著增高;而与ADH组比较,两肿瘤指标物在IDC组中的水平显著增高;以上比较差异均有统计学意义(均P<0.01)。与对照组比较,血清CA153在ADH组与IDC组中的异常率显著增高;而CEA则仅在IDC组中显著增高,差异均有统计学意义(P<0.01或0.05)。

表1 各组CA153和CEA水平与异常率比较
注:与对照组比较,*P<0.01或0.05,@P<0.01或0.05,#P>0.05;与ADH组比较,$P<0.01,&P>0.05。
2.2 各组组织SMG-1mRNA和SOX4mRNA表达水平及异常率比较 见表2,图1~2。与对照组比较,组织SOX4mRNA在ADH组与IDC组中的异常率和表达量均显著增高,而SMG-1mRNA则显著降低;与ADH组比较,组织SOX4mRNA在IDC组中的异常率和表达量显著增高,而SMG-1mRNA则显著降低,差异均有统计学意义(P<0.01或0.05)。

表2 各组SMG-1mRNA和SOX4mRNA表达量与异常率比较
注:与对照组比较*P<0.01或0.05,@P<0.01;与ADH组比较#P<0.01。

M.DL2000;1.IDC组;2.ADH组;3.对照组;4.阴性对照 M.DL2000;1.IDC组;2.ADH组;3.对照组;4.阴性对照
2.3 相关性分析 见表3。

表3 SOX4mRNA和SMG-1mRNA表达与乳腺癌临床病理因素的关系(%)
注:*P<0.05,#P>0.05。
在IDC组织中,组织SMG-1mRNA和SOX4mRNA表达量具有负相关性(r=-0.832,P<0.01)。SMG-1mRNA表达与血清CA153和CEA水平有负相关性(r=-0.767,-0.623,P<0.01),而SOX4mRNA表达则有正相关性(r=0.779,0.605,P<0.01)。组织SOX4mRNA的表达与乳腺癌患者的年龄、TNM分期和肿瘤组织学分级无明显相关(P>0.05);而与肿瘤大小和淋巴结转移具有显著相关性(P<0.05)。SMG1mRNA表达与乳腺癌患者的年龄无明显相关性(P>0.05);而与乳腺癌的肿瘤大小、TNM分期、淋巴结转移及组织学分级均有相关性(P<0.05)。
3讨论近年来研究发现SMG-1参与许多病理生理过程的调节,包括电离辐射的应激反应、内切酶介导的DNA双链断裂、缺氧反应以及抗肿瘤坏死因子-α依赖性细胞凋亡等[7]。研究证实SMG-1对于肿瘤细胞的生长具有抑制作用。在人乳头状瘤病毒阳性的头颈部鳞癌肿瘤细胞中,SMG-1的表达显著下调。研究显示上调SMG-1的表达有助于增强肿瘤细胞对治疗药物的敏感性[8-9]。目前研究认为,SMG-1导致的DNA损伤信号传导到下游靶蛋白后启动应激系统,诱导p53基因第15丝氨酸位点的磷酸化,通过p53信号传导通路调控p2l基因的表达,引起细胞周期的阻滞,从而为DNA的修复提供时间[10]。p53基因被认为是一种与人类肿瘤发生相关性极高的抑癌基因[10],SMG-1对p53基因的调控作用提示其与肿瘤的发生发展密切相关。研究发现肾癌组织中SMG-1的表达显著低于癌旁组织。肾癌的良好预后与SMG-1表达的上调显著相关[11]。目前SMG-1在乳腺癌中的研究比较少见。赵倩等[12]分析68例乳腺癌患者及40例配对癌旁组织的结果显示SMG-1在乳腺癌组织及癌旁组织中的阳性表达率分别为27.9%和77.5%。进一步的研究发现SMG-1在乳腺癌组织的低表达与乳腺癌肿瘤大小、组织学分级有相关性,提示SMG-1可能参与乳腺癌的发生和发展[12]。GUBANOVA等[7]研究认为SMG-1通过调节细胞分裂周期25A(CDC25A)和周期蛋白依赖激酶2(CDK2)的活性参与乳腺癌细胞的病理过程。他们发现SMG-1丢失可能导致CDC25A和CDK2活性增加而促进肿瘤的进展。本研究采用RT-PCR的分析显示乳腺癌组织SMG-1mRNA的表达和异常率均显著低于ADH组和对照组(P<0.01或0.05),提示SMG-1的抑癌作用的减弱可能与乳腺癌的发生有关。非典型增生是一种高风险的良性病变,有报道认为约10%的良性病变活组织检查发现存在ADH[13]。本研究结果显示ADH组SMG-1mRNA表达和异常率均显著低于对照组(P<0.01或0.05),提示SMG-1mRNA的差异性表达可能增加ADH病变的癌变风险。
近年来的研究表明SOX4基因作为体内的一种转录因子参与许多肿瘤的发生发展。在前列腺癌、黑色素瘤、非小细胞肺癌、肝癌及急性白血病等肿瘤组织中均发现SOX4过表达。然而SOX4在肿瘤组织中的具体作用机制尚不清楚。过表达的SOX4可能增强肿瘤细胞的侵袭和迁移能力并诱导乳腺上皮细胞发生上皮-间质转化[14]。这种转化过程被证实与肿瘤的侵袭和转移有关[15]。杨会杰等[16]的研究认为乳腺癌细胞的迁移和侵袭能力可通过转染SOX4-siRNA(沉默SOX4基因)后而显著降低。他们进一步地研究发现SOX4在腋窝淋巴结转移的乳腺癌组织中呈现较高的表达且与ER和PR表达显著相关。另外的研究证实乳腺癌组织中过表达的SOX4与乳腺癌转移抑制因子-1具有显著相关性,后者被认为与乳腺癌的发生及转移显著相关[17]。本研究结果显示乳腺癌组织SOX4mRNA的表达和异常率均高于ADH组和对照组(P<0.01或0.05)。提示SOX4可能与乳腺癌的发生发展密切相关。VIERKANT等[12]认为患有ADH的妇女继发乳腺癌的风险大约增加三倍。本研究显示ADH组SOX4的表达及异常率显著高于对照组(P<0.01或0.05)。因此认为检测SOX4可用于发现高风险的ADH,判断乳腺癌发生的风险性,提高乳腺癌的早期检出率,并有可能通过监测SOX4抑制剂的应用进而促进乳腺癌的治疗。
CA153已被证实在乳腺癌组织中高度表达,在转移病灶中也具有较高的表达率,其被认为是乳腺癌的相关抗原肿瘤标志物[18]。研究证实CEA水平升高提示患者可能增加全身转移性疾病的风险,也有研究指出CEA 能够作为预测乳腺癌肝转移和骨转移的重要指标物[19]。本研究的分析结果发现乳腺癌患者血清CA153和CEA水平均高于其它两组,其异常率也高于对照组(P<0.01或0.05)。相关性分析的结果显示组织SMG-1mRNA和SOX4mRNA表达具有负相关性(P<0.01)。SMG-1mRNA表达与CA153和CEA水平均有负相关性(P<0.01),而SOX4mRNA表达则有正相关性(P<0.01)。进一步地研究显示组织SMG-1mRNA表达与乳腺癌的肿瘤大小、TNM分期、淋巴结转移及组织学分级均有相关性,组织SOX4mRNA的表达与乳腺癌患者的肿瘤大小和淋巴结转移具有相关性。以上提示两基因标志物可能与乳腺癌的发生发展密切相关,其在乳腺癌组织中的差异性表达显示两标志物可能参与乳腺癌的病理进展。综上所述,检测组织SOX4mRNA和SMG 1 mRNA表达,可应用于乳腺癌的早期发现,降低乳腺癌的漏检率。

