碧迪FACS CantoⅡ流式细胞仪性能评价及实验室应用*
方佩琪,孙 林,顾梅秀,吴 蕙,潘柏申,郭 玮,王蓓丽
(复旦大学附属中山医院检验科,上海 200032)
流式细胞术(flow cytometry,FCM)是一种利用流式细胞仪对单细胞或生物颗粒进行多参数、快速分析的技术[2]。近年来随着FCM不断发展,逐渐从科研扩大到临床,在肿瘤、感染、免疫和血液系统疾病的诊治和监测中发挥了至关重要的作用[3]。尤其是分选技术的建立,为获取目标细胞提供了强有力的技术平台[4]。临床对该技术在疾病检测的应用范围不断扩大,例如淋巴细胞亚群分析、白血病/淋巴瘤/骨髓瘤免疫分型、CD34+干细胞绝对计数、人类白细胞抗原(HLA)-B27检测、阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria,PNH)检测、血小板功能检测以及人类白细胞表面CD64检测等,都是目前临床比较常规的项目,与疾病诊断、治疗和预后监测密切相关[5-8]。因此流式细胞仪的性能评价是保障实验室检测结果准确的必要基础[9]。此项研究以《YY/T0588-2017流式细胞仪》为依据,结合中华医学会《流式细胞术临床应用建议》[10]及多篇国内外参考文献[11-13],旨在建立本实验室BD FACS CantoⅡ流式细胞仪的性能评价方法,为实验室所开展的临床及科研应用提供有效的保障。
1材料与方法
1.1 研究对象 收集2019年1月30日复旦大学附属中山医院住院患者全血标本,共20份,标本使用BD乙二胺四乙酸(EDTA-K2)抗凝真空采血管采集,当天检测。
1.2 试剂和仪器 BD FACS CantoⅡ流式细胞仪;BD FACS Calibur流式细胞仪;BD MultitestTM6-color TBNK Reagent试剂盒(BD六色淋巴细胞亚群试剂盒,CD3/CD4/CD8/CD19/CD16/56/CD45抗体),货号644611;BD MultitestTMIMK Kit试剂盒(BD四色淋巴细胞亚群试剂盒,包括A试剂:CD3/CD4/CD8/CD45抗体,B试剂:CD3/CD19/CD16/CD56/CD45抗体),货号340503;BD FACSTMLysing Solution(BD溶血剂),货号349202;BD TrucountTMTubes(BD 绝对计数管),货号340334;BD Calibrite APC Beads校准微球,货号340487;BD FACS Diva CS&T Research Beads定标微球,货号655050;BD DNA QC Particles标准微球,货号349523;Beckman coulter IMMUNO-TROL Cells(贝克曼质控品),货号6607077;BD SpheroTMRainbow Calibration Particles(8peaks)3.0~3.4μm微球,货号559123;SpheroTMNano Fluorescent Particle Size Standard Kit微球,货号NFPPS-52-4K。
1.3 方法
1.3.1 仪器校准:
1.3.1.1 流式细胞仪的工作条件应符合:仪器说明书所规定的环境温度、相对湿度、电源电压、大气压力,并且防止阳光直射、避免热源。在此基础上实验前应对仪器进行正确的操作和校准。
1.3.1.2 荧光检出限和荧光线性:在1 ml磷酸盐缓冲液(phosphate buffered saline,PBS)中加入1滴BD SpheroTMRainbow Calibration Particles(8peaks)3.0~3.4 μm微球,振荡混匀后上机检测,计算并得到相应的等量可溶性荧光分子数(molecules equiva-lent soluble fluorochrome,MESF)及MESF(Y)和平均荧光强度(X)的线性回归方程、相关系数(r)。要求:流式细胞仪对FITC的荧光检出限应不大于200 MESF,流式细胞仪对PE的荧光检出限应不大于100 MESF,流式细胞仪对其他激光器所对应通道荧光素的荧光检出限应符合制造商的要求;r≥0.98。
1.3.1.3 前向角散射光(FSC)检出限:在1 ml去离子水中分别加入1.35,0.88,0.45和0.22 μm微球各1滴,振荡混匀后上机检测,得到直方图上显示的峰值信号和显示峰值信号的标准微球直径。要求:FSC检出限≤1 μm。
1.3.1.4 仪器分辨率:取1滴BD CS&T 加入装有500 μl PBS的试管中,混匀后上机检测,获得各通道的CV。要求:FSC,FITC和PE通道的CV≤3%。
1.3.1.5 FSC和侧向角散射光(SSC)分辨率:①在1 ml PBS中,加入5 μl EDTA-K2抗凝外周血,混匀后上机检测。要求:在FSC/SSC图上可以区分外周血红细胞和血小板。②在1 ml溶血剂中加入50 μl EDTA-K2抗凝外周血,混匀后上机检测。要求:在FSC/SSC图上可以区分外周血白细胞三群(淋巴细胞、单核细胞、粒细胞)。
1.3.1.6 倍体分析线性:用BD DNA QC Particles中小鸡有核红细胞(CEN)经过碘化丙啶(PI)染色后上机检测,获取G2/M期与G0/G1期平均荧光强度,计算两者比值。要求:比值范围1.95~2.05。
1.3.1.7 表面标志物检测的准确度:使用BD六色淋巴细胞亚群试剂对贝克曼质控品进行CD3,CD4,CD8,CD16/CD56,CD19和CD45标记,依次记录每次检测的CD3,CD4,CD8,CD16/CD56和CD19阳性值的百分比,分别计算平均值。重复测定5次。要求:结果应在质控品说明书给定的靶值参考范围内。
1.3.1.8 表面标志物检测的重复性:使用BD六色淋巴细胞亚群试剂对贝克曼质控品进行CD3,CD4,CD8,CD16/CD56,CD19和CD45标记,分别计算CD3,CD4,CD8,CD16/CD56和CD19阳性百分比结果的CV。重复测定10次。要求:①阳性百分比≥30%时,CV值应不大于8%;②阳性百分比<30%时,CV值应不大于15%。
1.3.1.9 携带污染率:取BD Calibrite APC Beads三滴到BD绝对计数管中,加入PBS混匀后连续上机检测3次,每次至少收集100 000个标准微球,计算标定区域的颗粒数,分别标记为Hi-1,Hi-2,Hi-3。再进行空白数量测试,连续测试3次,计算标定区域的颗粒数,分别标记为Li-1,Li-2,Li-3。按照此步骤重复循环3次,计算携带污染率(Ci),取最大值。要求:携带污染率应不大于0.5%。
式中:Ci为第i次循环的携带污染率值;i=1~3。
1.3.1.10 仪器稳定性:取1滴BD CS&T 加入装有500 μl PBS的试管中,混匀后上机检测,测试完成后,利用直方图分析实验结果,计算开机0 h的标准微球的平均荧光强度(FL1)。连续开机8 h后,在相同参数设置条件下重复前步骤,计算得到标准微球的平均荧光强度(FL2)。按公式计算FL1,FL2的B值。要求:环境温度变化不超过设定温度的5%时,在开机8 h内检测FSC及所有荧光通道峰值荧光道数的波动范围应不超过10%。
式中:FL1为开机0 h的标准微球平均荧光强度。FL2为开机8 h后的标准微球平均荧光强度。
1.3.2 实验室应用:仪器校准后,使用BD FACS Calibur流式细胞仪及其配套的BD四色淋巴细胞亚群试剂盒(包括A试剂:CD3,CD4,CD8,CD45抗体;B试剂:CD3,CD19,CD16/CD+56,CD45抗体),对全血标本分别进行CD3,CD4,CD8,CD45和CD3,CD19,CD16/CD56,CD45标记,每份标本需标记两管,共做20份,按标准操作规程上机检测并分析结果。使用BD FACS CantoⅡ流式细胞仪及其配套的BD六色淋巴细胞亚群试剂盒(CD3,CD4,CD8,CD16/CD56,CD19,CD45抗体),对全血标本进行CD3,CD4,CD8,CD16/CD56,CD19,CD45标记,每份标本只需标记一管,共做20份,按标准操作规程上机检测并分析结果。分别记录两者的标本前处理、上机检测和分析结果所用时间,并比较两台仪器的检测结果,计算结果的平均数、标准差和两者P值。
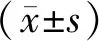
2结果
2.1 仪器校准
2.1.1 荧光检出限和荧光线性:通过检测计算得到FITC通道的荧光检出限为40.18 MESF,PE通道的荧光检出限为23.77 MESF;两者的r都为0.999 9,均符合行业标准。
2.1.2 FSC检出限:通过微球检测,仪器可以很好区分四种大小的微球,最小可以检测到0.22μm微球,符合行业标准。见图1。
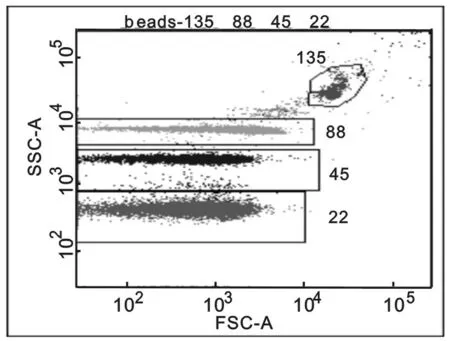
注:135表示1.35 μm微球;88表示0.88 μm微球;45表示0.45 μm微球;22表示0.22 μm微球。
图1四种大小微球在FSC图上检测结果
2.1.3 仪器分辨率:FSC,FITC及PE荧光通道的CV值分别为2.3%,2.4%和2.4%,均符合行业标准。
2.1.4 FSC/SSC分辨率:通过FSC,SSC散点图能够将外周血中红细胞和血小板明显的区分开;且能区分淋巴细胞、中性粒细胞、单核细胞。均符合行业标准。见图2。
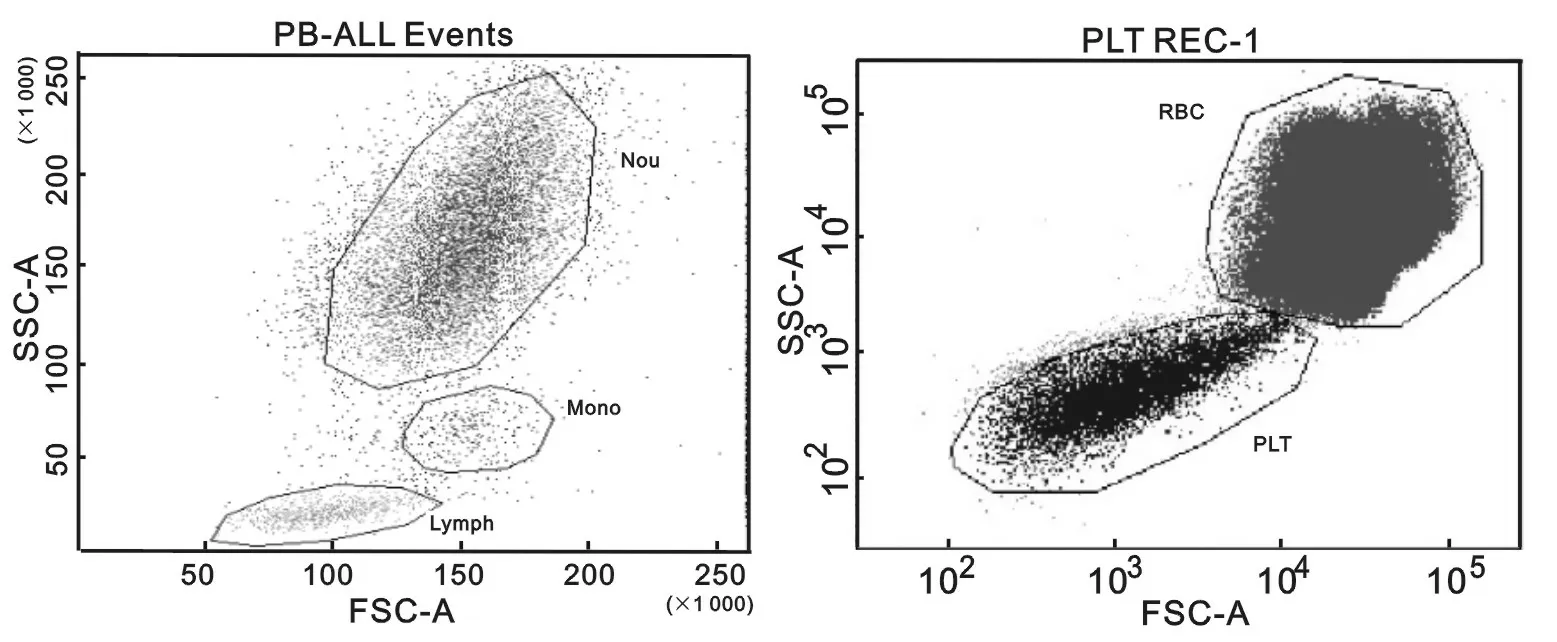
注:Neu表示中性粒细胞;Mono表示单核细胞;Lymph表示淋巴细胞;RBC表示红细胞;PLT表示血小板。
2.1.5 倍体分析:线性上机检测后计算G0/G1期和G2/M期的平均荧光强度比值为1.98。结果符合行业标准。
2.1.6 表面标志物检测的准确度:通过对Beckman coulter IMMUNO-TROL Cells质控品的检测,得到并计算 CD3,CD4,CD8,CD16/CD56和CD19阳性值的平均值,所有平均值均在质控品说明书给定的靶值参考范围内,见表1。
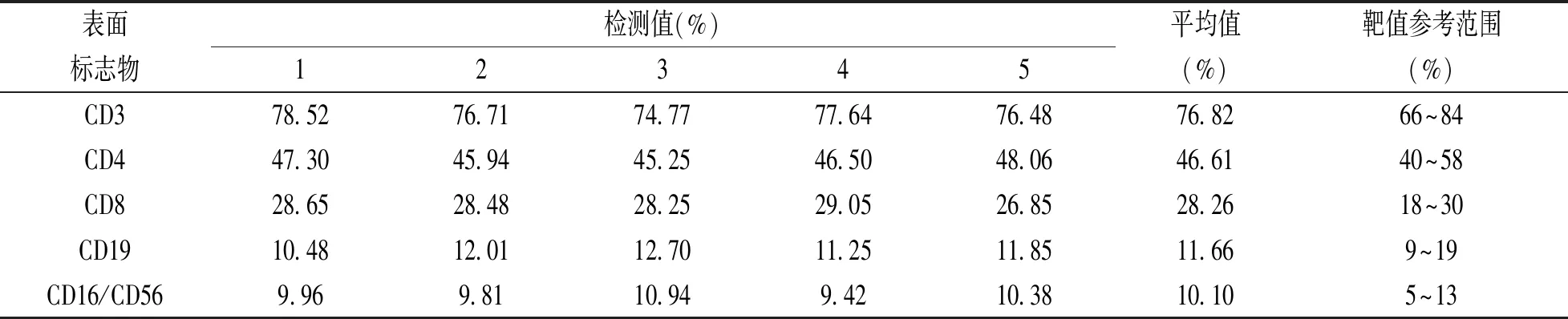
表1 表面标志物CD3,CD4,CD8,CD19,CD16/CD56阳性百分比(%)及参考范围(%)
2.1.7 表面标志物检测的重复性:通过对Beckman coulter IMMUNO-TROL Cells质控品分别连续检测10次,得到每个表面标志的阳性结果并计算CV,分别为CD3:2.75%,CD4:1.86%,CD8:5.14%,CD16/CD56:7.33%,CD19:11.26%。结果均符合行业标准。
2.1.8 携带污染率:每管检测后执行SIT FLUSH(仪器检测标本时,每管间的管路自动清洗步骤)清洗,携带污染率分别为0.01%,0.03%和0.02%;不执行SIT FLUSH清洗,携带污染率分别为0.05%,0.04%和0.03%,结果均符合行业标准。
2.1.9 仪器稳定性:通过检测开机0 h和8 h的FSC及各荧光通道平均荧光强度(FL1,FL2),计算得到B值,结果均符合行业标准,见表2。
2.2 实验室应用 使用BD FACS Calibur流式细胞仪及其配套的BD四色淋巴细胞亚群试剂盒,标本前处理时间为43 min,标本检测时间为56 min,标本分析时间为12 min,共计111 min。使用BD FACS CantoⅡ流式细胞仪及其配套的BD六色淋巴细胞亚群试剂盒,标本前处理时间为31 min,标本检测时间为25 min,标本分析时间为5 min,共计61 min。两台仪器分别检测20份全血标本后所得的结果比较,差异均无统计学意义,见表3。
表2FSC和各荧光通道在0 h和8 h的平均荧光强度及偏差(%)
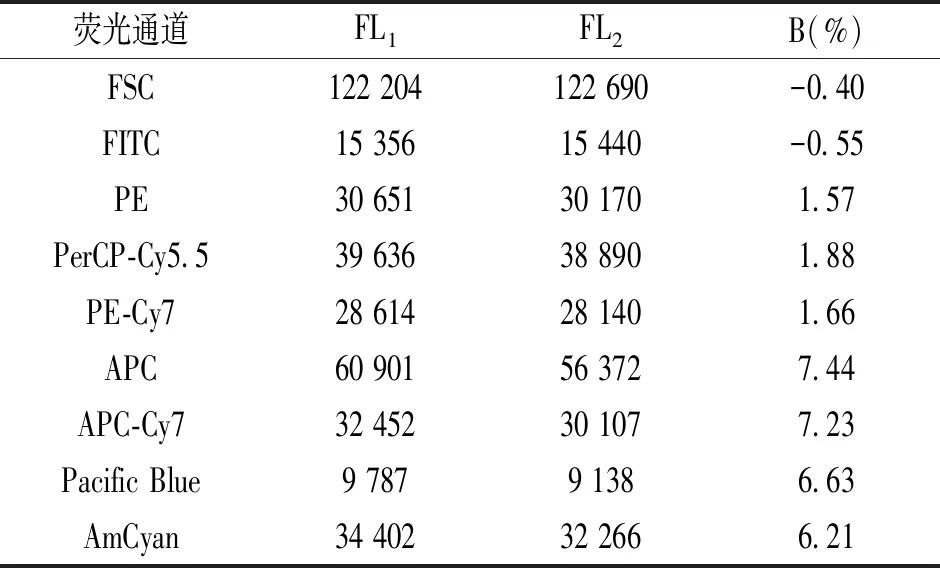
荧光通道FL1FL2B(%)FSCFITCPEPerCP-Cy5.5PE-Cy7APCAPC-Cy7Pacific BlueAmCyan122 20415 35630 65139 63628 61460 90132 4529 78734 402122 69015 44030 17038 89028 14056 37230 1079 13832 266-0.40-0.551.571.881.667.447.236.636.21
注:FL1为开机0 h的标准微球平均荧光强度;FL2为开机8 h后的标准微球平均荧光强度。
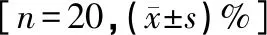
表3 BD FACS Calibur与BD FACS CantoⅡ流式细胞仪检测标本结果比较
3讨论本次性能评价是依据国家食品药品监督管理局最新发布的医药行业标准《YY/T0588-2017流式细胞仪》所进行,此新版标准是基于2005版《YY/T0588-2005流式细胞仪》所进行的调整,修改了荧光检出限、荧光线性、前向角散射光检出限、仪器分辨率和携带污染率的实验方法;在原标准的基础上新增了表面标志物CD19,CD16/CD56的准确度和重复性,从而进一步完善了对仪器的性能评价标准。
本实验室首次将新版流式细胞仪的行业标准运用在BD FACS CantoⅡ流式细胞仪的性能评价中。通过本次实验所得数据,对比参考文献中迈瑞BriCyte E6流式细胞仪[14]和Beckman Coulter Navios流式细胞仪的性能评价结果,BD FACS CantoⅡ流式细胞仪在荧光检出限、荧光线性和FSC灵敏度检出限这三项性能指标中所得结果更为出色。三台流式细胞仪在FSC,SSC分辨率和倍体分析线性方面均符合新版行业标准。BD FACS CantoⅡ流式细胞仪在表面标志物检测准确度和重复性评价上均符合新版行业标准,且检测结果的离散程度小于BD FACS Calibur流式细胞仪,而在仪器分辨率CV、携带污染率和仪器开机8 h稳定性这三项中,迈瑞BriCyte E6流式细胞仪和Beckman Coulter Navios流式细胞仪的性能指标较为出色。
在实验室应用方面,BD FACS CantoⅡ流式细胞仪检测淋巴细胞亚群时所用的BD六色淋巴细胞亚群试剂盒,相比原先BD FACS Calibur流式细胞仪所用的BD四色淋巴细胞亚群试剂盒,大幅减少了标本前处理的步骤、缩短了上机检测所需的时间,全面提升了标本分析过程。使用BD FACS CantoⅡ流式细胞仪利于本实验室快速处理大批量标本,有效提高检测效率,使工作人员在相同的时间内能处理并检测分析更多的标本,从而为实验室未来与临床合作开展更多样化的检测项目提供了技术保证。
目前,随着流式细胞术在临床诊疗及实验室科研等领域的广泛应用,对仪器的性能评价方面提出了更为严格的要求,实验室在日常工作中应更为全面地掌握各项评价指标的操作方法[15]。本次研究我们在新版标准的基础上对实验方案步骤深度细化,同时对各项指标的计算方法和结果进行了详细说明。通过本次研究,证实了我科BD FACS CantoⅡ流式细胞仪各方面性能指标均符合新版行业标准技术要求,满足临床应用需求,可以为临床各领域提供准确的数据输出支持,并能依托新版行业标准与医院内与其他临床实验室的各型流式细胞仪开展室间比对。随着流式细胞技术在未来的不断向前发展,其所涉及的技术标准和应用领域会进一步扩大,而稳定良好的仪器性能是必要的基础,所以当我们在不断重视实验数据结果的同时,应更进一步将关注点投向仪器的性能与状态,探索更完善的实验室仪器评价方案。

