阻塞性睡眠呼吸暂停综合征患者心律失常的发生与心率变异性分析*
马毓 温华知 曾晓杰 徐盛开 谢萍 张福 谢宇平 王莺
以往诸多研究表明伴有睡眠呼吸障碍的患者心律失常发生率显著高于无症状的患者[1-2]。最近研究表明,阻塞性睡眠呼吸暂停综合征(obstructive sleep syndrome,OSAS)与心律失常密切相关[3]。此外,由OSAS引起的血流动力学变化,自主神经改变,心房和心室电和结构改变可能导致心血管疾病的风险增加[4-5]。因此,增加对OSAS和心律失常关系的认识对减少心血管疾病患者的发病率和死亡率起着至关重要的作用。心率变异性(HRV)是分析心脏自主神经调节功能的一项非侵入性检测方法,笔者主要探讨OSAS患者心律失常的发生情况,并对其与HRV的相关性进行分析。
1 资料与方法
1.1 研究对象
该项研究经甘肃省人民医院伦理委员会批准,所有参与调查患者均知情同意。本研究纳入了2016年1月到2017年12月就诊于甘肃省人民医院的睡眠打鼾患者250例,其中不符合入选标准或符合排除标准的有38例,实际入选病例组为212例,其中男性185例(87.3%),女性27(12.7%),年龄(46.7±12.1)岁。所有纳入人群均进行多导睡眠及24 h 动态心电图监测。根据中华医学会呼吸病学分会睡眠呼吸障碍学组OSAS诊治指南( 2011 年修订版),OSAS是指每夜7 h睡眠过程中呼吸暂停及低通气反复发作30 次以上,或呼吸暂停低通气指数(AHI)≥5 次/小时。睡眠呼吸暂停是指在睡眠过程中口鼻呼吸气流消失或明显减弱,持续时间> 10 s;低通气是指在睡眠过程中呼吸气流的强度与基础气流量相比下降> 50% 和伴血氧饱和度降低4%以上;AHI是指平均每小时睡眠中呼吸暂停加低通气的次数;根据标准将入选患者分为对照组(AHI<5)和OSAS 组(AHI≥5),再根据AHI 将OSAS分为轻中度组(5≤AHI≤30) ,重度组( AHI > 30)。
排除标准:①急性心肌梗死;②急性心功能衰竭;③急性肺动脉栓塞;④伴有严重神经系统疾病:脑卒中、癫痫、痴呆、脑炎、脑外伤等;⑤有严重基础心脏病:风湿性瓣膜性心脏病、先天性心脏病、冠心病、心肌病、心力衰竭患者;⑥合并甲状腺功能减退症、腺垂体功能减退症、原发性醛固酮增多症等内分泌疾病;⑦伴有严重肝、肾功能不全者,严重电解质紊乱;⑧多导睡眠检测当晚服用镇静安眠药者;⑨接受氧疗者。
1.2 一般资料采集
将签署知情同意书的患者纳入研究人群,详细询问病史,取基线资料,包括年龄、性别、体重、身高、用药情况、高血压、糖尿病、血脂等基础疾病情况;计算体质指数(BMI):BMI =体重(kg)/身高2(m2)。
1.3 多导睡眠呼吸监测
所有入选者均接受澳大利亚生产 Com2pumedics2 E 型多导睡眠呼吸监测仪完成监测分析。夜间持续监测时间≥7 h。同步监测了血氧饱和度、心率、氧减指数(ODI)、AHI、血氧低于90%以下的总时间占睡眠总时间的百分比(T90)等。所得结果通过电脑自动分析和专业技术人员判读。监测当晚测量受试者的颈围、腹围、身高、体重等基本指标,并计算体质指数BMI。
1.4 24 h动态心电图监测
所有纳入病例均采用世纪今科(MIC-12H-3 型)12 导联全信息实时心电记录仪进行动态心电图监测,连续记录24 h动态心电图。分析心律失常的发生情况,包括:房性早搏、房性心动过速、室性早搏、缓慢性心律失常、早复极和异位搏动,其中缓慢性心律失常诊断根据动态心电图按《实用内科学》第15版标准。同时获取HRV的相关指标:正常RR间期的标准差(SDNN)、RR间期平均值标准差的平均值(SDANN Index)、RR间期标准差的平均值(SDNN Index)、相邻RR间期差值的均方根(rMSSD)、相邻RR之差>50ms的个数占总窦性心搏个数的百分比(PNN50)、低频功率(LF)、高频功率(HF)、低频功率与高频功率比值(LF/HF)。
1.5 统计学分析
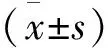
2 结果
2.1 三组基线资料比较
在三组中,年龄、性别和BMI方面无显著差异。多导睡眠呼吸监测之前的收缩血压和舒张压也无显著差异。高血压、糖尿病、冠心病和血脂异常的发生率,各组之间亦没有统计学差异。表1。
2.2 三组各种心律失常发生情况比较
重度组房性心动过速、窦性心动过缓发生率显著高于轻中度组(χ2=4.57,P<0.05;χ2=7.68,P<0.05),见表2;重度组短阵房性心动过速发作频率>100阵的比例显著高于对照组、轻中度组(χ2=3.98,P<0.05;χ2=5.35,P<0.05),见表3。
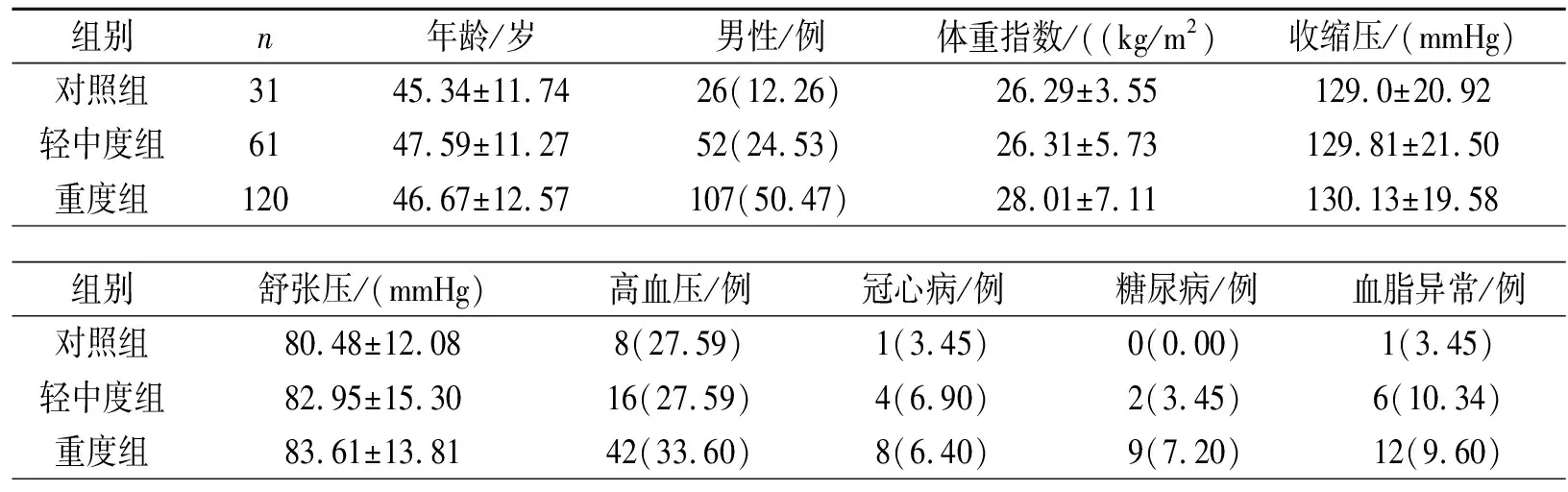
表1 一般资料比较
注:括号内为百分数
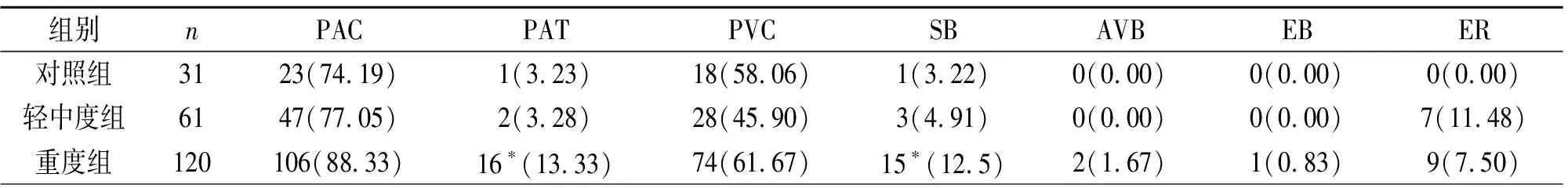
表2 3组各种心律失常发生情况
注:PAC=房性早搏;PAT=短阵房性心动过速;PVC=室性早搏;SB=窦性心动过缓;AVB=房室传导阻滞;EB=逸搏;ER=早复极。与轻中度组比较,*P<0.05

表3 房性心动过速的时间规律
注:与轻中度组比较,*P<0.05;与对照组比较,#P<0.05
2.3 HRV指标比较
SDNN在三组间有明显差异,见表4。重度组与对照组比较SDNN差异有显著性(t=2.112,P=0.036),见表4。
2.4 多导睡眠呼吸参数
平均血氧饱和度、最低血氧饱和度、ODI、T90在三组间差异均有统计学意义。重度组与对照组比较最低血氧饱和度、ODI差异均有显著性(P<0.01)。重度组与轻中度组比较平均血氧饱和度、最低血氧饱和度、ODI及T90差异均有显著性(P均<0.05),见表5。
2.5 睡眠呼吸监测指标与HRV参数的相关性分析
OSAS患者的AHI与LF、HF呈正相关(P分别<0.05和0.001),T90与SDNN和HF分别呈正相关(P均<0.05);与SDANN呈负相关(P<0.001)(表6)。
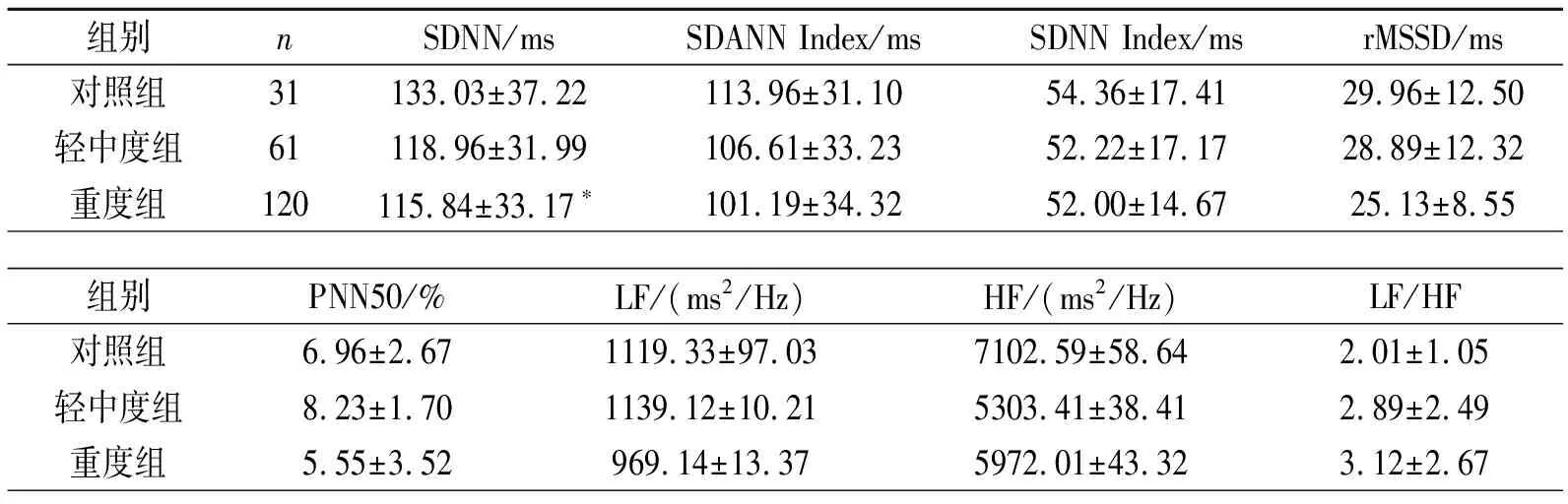
表4 心率变异性参数比较
注:与对照组比较,*P<0.05
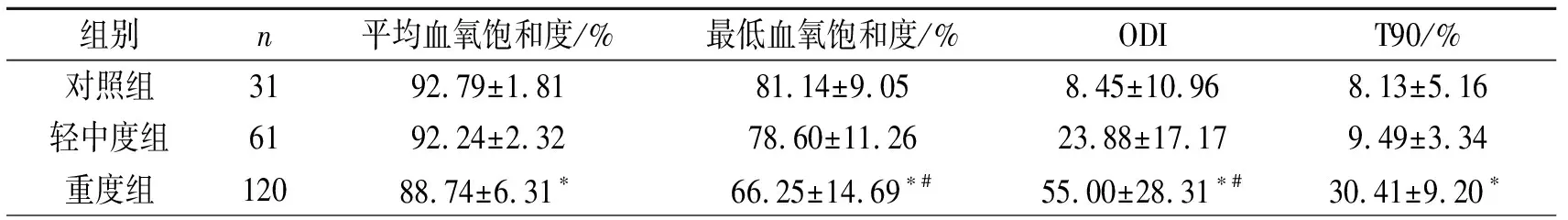
表5 PSG指标比较
注:与轻中度组比较,*P<0.05;与对照组比较,#P<0.05
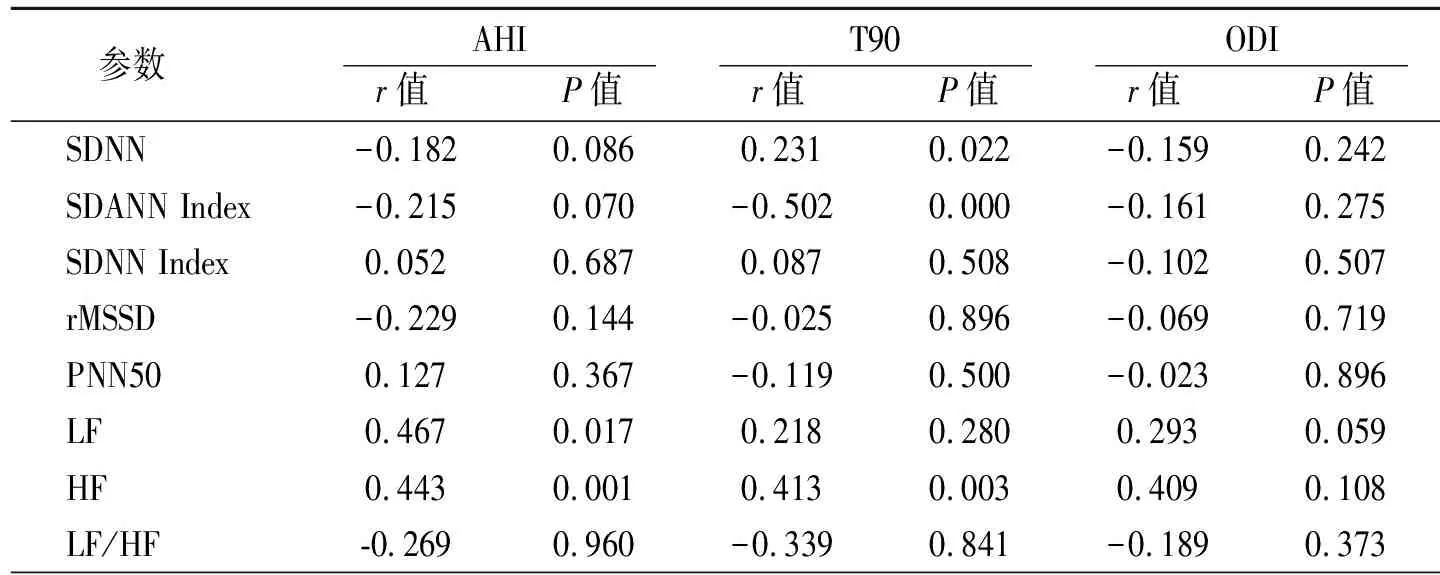
表6 OSAS患者睡眠呼吸监测指标和HRV参数之间的相关性分析
3 讨论
在OSAS患者中可以观察到几乎所有类型的心律失常,与器质性心脏病患者不同 ,OSAS患者的心律异常主要发生在睡眠期间, 其中窦性心动过缓、心房颤动、室性早搏等为与相关的主要心律失常类型[6]。我们研究结果表明,重度组房性心动过速发生率显著高于轻中度组,且在大于100阵的较高频率的房性心动过速中OSAS组比在对照组发生率更高。OSAS患者夜间睡眠时,由于心肌氧的需求和动脉血氧含量不足之间不协调从而可能引起心肌缺血、缺氧[7];低氧状态下可使血管内皮生长因子、内皮素-1等基因的表达增加,睡眠时反复出现的低氧-复氧使OSAS 患者机体内产生过多的氧自由基,使心房细胞受到损伤[8]。心房长期在缺氧、高碳酸血症以及儿茶酚胺增加的条件下引起交感神经兴奋,使心房肌除极速度不一致,会更利于短阵房性心动过速发生。除了可以观察到缺氧带来的直接病理生理变化以外,自主神经张力的变化也是一个重要的因素。本研究中观察到自主神经张力的变化,即交感活性增强而迷走活性降低占主导,易于房性心动过速的诱发[9]。此外,重度组窦性心动过缓发生率显著高于轻中度组。呼吸暂停致血氧饱和度下降迷走神经活性增加, 常出现心动过缓或严重的房室传导阻滞,这是OSAS患者出现缓慢性心律失常最常见的机制。
HRV参数经常被用来研究OSAS患者自主神经功能的变化,SDNN、SDNN-Index、SDANN-Index、rMSSD和PNN50等这些指标代表交感神经与副交感神经对HRV的影响。SDNN 主要反映交感及迷走神经张力大小,用来评价自主神经系统受损与恢复的总体指标,RMSSD、PNN50及HF反映心率变异性的快变化,即副交感神经张力敏感指标,其值降低提示迷走神经功能张力降低。SDNN、SDANN及LF反映心率变异性的慢变化,即交感神经张力大小,其值降低提示交感神经张力增高,LF/HF意味着交感神经和迷走神经的相互影响。本研究中,在三组间SDNN差异有统计学意义,重度组与对照组比较SDNN差异也有统计学意义,这表明OSAS患者自主神经功能紊乱,稳定性较正常人差,以迷走神经张力降低而交感神经张力增高为主[10-11]。这与Aydin等[12]的研究结果基本一致。
OSAS患者夜间反复出现低氧血症,这是导致一系列疾病的病理生理学基础。重度组的最低血氧饱和度低于对照组,提示重度组在睡眠中血氧下降幅度大,而ODI明显高于对照组,说明重度组有着更为频发的间断低氧血症。此外,重度组与轻中度组比较平均血氧饱和度、最低血氧饱和度、ODI及T90差异均有统计学意义,说明重度组睡眠中血氧下降幅度大于轻中度组,也更容易发生低氧血症。在相关性分析中,AHI与LF、HF呈正相关,这说明随着OSAS病情加重, 交感迷走失衡明显。T90与SDNN、及HF呈正相关,而与SDANN Index呈负相关,说明OSAS患者夜间反复间歇低氧与HRV 改变有一定关系,其可能机制为OSAS患者睡眠中反复呼吸暂停伴低氧血症、高碳酸血症,刺激主动脉弓、颈动脉体内的化学感受器,影响自主神经对心率调节的作用。

