长期生存的晚期肺腺癌患者的个体化全程管理一例
邓梓涵 罗 莉 李倩婷 秦 蘅 傅 瑶 李 会 吴国明
病例资料
患者女性,68岁,焊工,因“间断发热伴右侧胸痛半月”于2009-06-18入院。半月前患者于受凉后出现畏寒、间断发热,最高体温39.4 ℃,伴右侧胸痛,呈间歇性隐痛,无咳嗽、咳痰、咯血、盗汗、胸闷、气促、纳差、腹痛、腹泻等。当地医院胸部CT示“双肺炎性病变,不除外其他”,为求进一步诊治入我院。入院查体:右侧锁骨上可扪及一枚肿大淋巴结,约蚕豆大小,质硬,活动度欠佳;听诊双肺呼吸音清晰,未闻及干湿啰音;心、腹部无特殊。既往史无特殊。诊疗经过:入我院后胸部CT示右肺上叶占位性病变,病灶大小为6.3 cm×6.1 cm,肿块与前胸壁下胸膜分界不清,双侧肺门和纵隔内未见明显肿大的淋巴结,见图1。支气管镜检查:右上叶后段可见一菜花样新生物,将开口大部分堵塞。支气管镜钳取物病理示腺癌,未行肿瘤驱动基因检测。完善腹部CT、头颅MRI、骨扫描等检查后,诊断为“右原发性支气管肺癌 腺癌 T3N3M0 Ⅲb期 ,胸壁侵犯,右侧锁骨上淋巴结转移癌”。于2009-06-29、2009-07-22 予以“紫杉醇 280 mg D1+卡铂450 mg D1”第一、第二周期化疗。2009-08-12复查胸部CT示右上肺病灶无明显缩小,周围可见斑片状密度增高影,考虑合并阻塞性肺炎,疗效评估为SD,因出现末梢神经炎,故更换化疗方案。于2009-08-13、2009-09-05予以“长春瑞滨 40 mg D1、D8+卡铂 500 mg D1”第三、第四周期化疗,由于出现输注局部静脉炎,故再次更换化疗方案。于2009-09-27予以“吉西他滨1.6 g D1、D8+卡铂500 mg D1”第五周期化疗。2009-10复查胸部CT示右肺病灶较前稍缩小,约6.0 cm×5.1 cm,见图2。由于患者已完成五个周期化疗,总体疗效评估为SD,不愿接受进一步化疗;患者系东方人、女性、腺癌、不吸烟,为表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors, EGFR- TKIs)治疗的“优势人群”,故于2009-10开始予以吉非替尼250 mg qd维持治疗。2010-01复查胸部CT示右肺病灶明显减小,约4.0 cm×2.0 cm,见图3,疗效评估为PR。此后每2个月(2009-10至2013-03)复查胸部CT,提示右肺病灶稳定。2013-03-06胸部CT示右肺病灶较前稍增大,约2.5 cm×4.1 cm。2014-03-05胸部CT示右肺病灶逐渐增大,约4.8 cm×5.3 cm。2016-09-05胸部CT示右上肺病灶明显增大,约7.0 cm×7.3 cm,双肺散在小结节影,右侧少量胸腔积液。提示病灶逐渐增大,呈缓慢进展,但因患者无明显症状,亦不愿意接受化放疗,遂继续予以吉非替尼治疗。2016-11患者出现痰中带血,约2~3次/d。2016-11-02复查胸部CT示右上肺病灶大小约7.3 cm×8.5 cm,且双肺转移灶增多增大,右侧胸腔积液明显增多。腹部CT示右肾上腺区小结节影,考虑转移;余分期检查未见明显异常。诊断为“右原发性支气管肺癌腺癌 T3N3M1b Ⅳ期,胸壁侵犯,右侧锁骨上淋巴结、纵隔淋巴结转移癌,双肺转移癌 ,右侧肾上腺转移性癌”。考虑肿瘤进一步进展,故于2016-11-18、2016-12-09予以“培美曲塞700 mg D1+奈达铂100 mg D1+重组人血管内皮抑制素注射液15 mg bid D1-D7”两个周期化疗。2017-01-04复查胸部CT示右肺病灶较前缩小,约5.2 cm×6.9 cm,疗效评估为SD,建议继续化疗,患者因自身原因拒绝,遂继续予以口服吉非替尼治疗。2017-07-05复查胸部CT示右上肺病灶明显增大,约8.1 cm×8.5 cm。动员患者入院行肺穿剌二次活检,病理示腺癌,肺癌驱动基因检测示EGFR 21外显子L858R突变,T790M阴性,ALK阴性,遂继续口服吉非替尼。2018-03-05复查胸部CT示右上肺病灶约8.7 cm×9.4 cm,双肺转移灶增多增大,右侧胸腔积液较前增多。患者及家属强烈要求试用奥希替尼,结合文献,有研究表明部分T790M阴性患者使用奥希替尼仍可能获益[1]。遂于2018-03开始给予奥希替尼 80 mg qd治疗,2018-05-02复查胸部CT示右上肺病灶无明显缩小,约8.7 cm×9.4 cm,右侧胸腔积液似有减少,疗效评估为SD。患者因经济原因停用奥希替尼。遂于2018-07开始予以吉非替尼250 mg qd联合盐酸安罗替尼胶囊12 mg qd D1-D14治疗。2018-07-04胸部CT示右上肺病灶大小约8.8 cm×9.5 cm,见图4A-C。2018-09-05复查胸部CT示右上肺病灶明显缩小,约6.3 cm×7.5 cm,出现空洞,右侧胸腔积液明显吸收,见图5A-C。考虑该联合治疗方案有效,故继续至今。2019-03复查胸部CT示右上肺病灶继续缩小,约6.2 cm×6.6 cm。联合治疗期间,患者血压正常,多次监测尿常规均无明显异常。建议其继续密切随访。

图1入院胸部CT;图22009-10复查胸部CT;图32010-01复查胸部CT
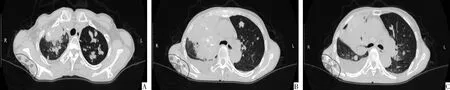
图42018-07-04胸部CT

图52018-09-05复查胸部CT
讨 论
在全球范围内,肺癌是发病率第二,病死率第一的恶性肿瘤[1-2]。2016年全球肺癌新发病例228,150人,新增死亡病例142,670人[3]。非小细胞肺癌(non-small cell lung cancer, NSCLC)占到肺癌总人数的80%~85%,其中大部分是局部晚期或晚期的患者[4]。过去,晚期NSCLC的治疗手段有限,以含铂双药的化疗为主,患者的总生存(overall survival, OS)仅为8~10个月[5]。随着靶向治疗,免疫治疗等多种治疗手段的加入,个体化治疗成为晚期NSCLC治疗的新趋势,患者的总生存提高到2年以上[6]。
靶向治疗的引入,成为了晚期NSCLC综合管理的里程碑事件。在IPASS研究中,研究者入组了亚洲、不吸烟的NSCLC腺癌患者,1︰1接受吉非替尼250 mg/d或卡铂(AUC=5-6)联合紫杉醇(200 mg/m2)的治疗,两组患者12个月的PFS率分别是24.9%vs. 4.7%(HR 0.74,95% CI 0.65-0.85;P<0.001),结果具有统计学差异[7]。后续的研究证实,表皮生成因子受体(epidermal growth factor receptor, EGFR)突变的人群是吉非替尼等EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)的优势获益人群。使用第一代EGFR-TKI,治疗携带EGFR突变的NSCLC患者的无进展生存期(progress free survival, PFS)从3~5个月提高到8~10个月[8-11]。
晚期NSCLC患者接受第一代EGFR-TKI治疗,将不可避免的面临耐药的问题。获得性耐药突变被认为是一代EGFR-TKI耐药进展的主要原因[12]。其中最常见的类型是T790M门卫突变,占到总人群的50%左右[13]。针对T790M门卫突变,第三代EGFR-TKI奥希替尼研发上市。在AURA3研究中,研究者入组了T790M阳性的NSCLC患者,以2︰1的比例,分别接受奥希替尼80 mg/d,或培美曲塞(500 mg/m2)联合卡铂(AUC=5)或顺铂(75 mg/m2)的治疗。两组的PFS分别是10.1vs. 4.4个月(HR 0.30,95% CI 0.23~0.41;P<0.001),具有统计学差异[14]。进一步的研究证实,在未经治疗的,携带有EGFR敏感突变(L858R或19外显子缺失)的NSCLC患者中,使用奥希替尼对比一代EGFR-TKI药物,同样能够带给患者PFS获益(18.9vs. 10.2 m;HR 0.46,95% CI 0.37-0.57;P<0.001)[1]。
肿瘤的血管生成被认为是肿瘤的十大特征之一,因此抗肿瘤血管生成也成为抗肿瘤治疗的新思路[15]。最先研发成功的药物贝伐单抗,是血管内皮生长因子(vascular endothelial growth factor, VEGF)的单克隆抗体[16]。在E4599研究中,贝伐单抗联合卡铂+紫杉醇的方案,首次将晚期NSCLC患者的总生存提高到1年以上[17]。后续上市了索拉菲尼、舒尼替尼等多个小分子、多靶点的抗血管生成TKI药物,但在NSCLC,鲜有成功的案例[18-22]。
安罗替尼是我国自主研发成功的,对血管内皮生长因子受体(vascular endothelial frowth factor receptor, VEGFR)、血小板衍生生长因子受体(platelet-derived growth factor receptor, PDGFR)以及成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)等多种血管生成相关通路有抑制作用的,小分子TKI药物[23-24]。在ALTER0303研究中,研究者入组了经两线化疗治疗失败的NSCLC 患者,以2︰1的比例,分别接受安罗替尼12 mg/d或安慰剂的治疗。结果显示,安罗替尼相比于安慰剂,能够带给患者OS的获益(9.6vs. 6.3 m;HR 0.68,95% CI 0.54-0.87;P=0.002)[25]。
研究发现,抗血管生成治疗具有“血管正常化”,增加肿瘤血流量,提高药物在肿瘤组织浓度的作用,因此抗血管生成药物与靶向治疗联合,也成为新的研究方向[26-27]。JO25567研究证实,针对携带EGFR突变的NSCLC患者,贝伐单抗联合厄洛替尼,与厄洛替尼单药相比,能够显著提高患者的PFS(16.0vs. 9.7 m; HR 0.54,95%CI 0.36~0.79;P=0.0015)[28]。
综上所述,该患者之所以能取得长达10年的生存获益,回顾其整个的治疗经过,得益于对该病例的全程管理。随着治疗药物的种类越来越多,加之我们合理地调整治疗方案,使其获得更长的PFS和OS,从而有望实现更多晚期NSCLC患者慢性病化的可能。 同时,我们也深深地体会到,个体化治疗的重要性,不仅体现在不同的人群,而且对于同一个患者在不同的时间段,也需要个体化的治疗。 因此我们期待更多的新药及治疗方案相关的临床研究的结果,比如免疫治疗、联合治疗等,从而为晚期NSCLC的长程管理提供更多更强有力的帮助。

